肝癌介入栓塞用盐酸吉西他滨温敏凝胶的制备与质量评价*
2019-03-06潘倩雯李力李涵赵彦兵刘宏
潘倩雯,李力,李涵,赵彦兵,刘宏
(1.中国人民解放军中部战区总医院药剂科,武汉 430070;2.湖北中医药大学药学院,武汉 430065;3.华中科技大学生命科学与技术学院,武汉 430075;4.国家纳米药物工程技术研究中心,武汉 430075)
肝细胞癌(hepatocellular carcinomas,HCC)是我国死亡率较高的恶性肿瘤之一,因其发病隐匿,确诊时多处中晚期。因肝肿瘤体积过大、肝储备功能不佳等原因,大部分患者无法通过肝切除及肝移植来治疗,经导管动脉化学栓塞(transcatheter arterial chemoembolization,TACE)已经成为此类无法行手术治疗肝癌患者的一线治疗方案[1-2]。吉西他滨(gemcitabine)是核糖核酸还原酶抑制剂,主要作用于DNA合成期肿瘤细胞,使其DNA合成停止,杀灭肿瘤细胞。研究发现,一定浓度范围内的吉西他滨可显著促进肿瘤细胞凋亡[3],临床常采用的治疗方法是盐酸吉西他滨静脉注射,但全身用药不良反应较大且靶向性差,因此在肝癌细胞附近不易达到较高治疗浓度。N-异丙基丙稀酰胺-co-甲基丙烯酸丁酯(N-isopropyl-acrylamide-co-butyl methylacrylate,PIB)是一种温敏凝胶,在常温下为液体,生理温度时可发生胶凝的永久性栓塞。碘海醇(iohexol)为临床常用造影剂。含碘海醇的盐酸吉西他滨温敏凝胶是一种具有化疗、栓塞、造影作用的新型抗肿瘤栓塞剂,不仅能有效阻断肝癌细胞血供,减少TACE单用复发率,同时可使吉西他滨在肝组织达到局部高浓度,提高化疗效果,避免全身大剂量用药,降低吉西他滨不良反应。为保证制剂质量,笔者在本实验对盐酸吉西他滨温敏凝胶的黏度、复合模量及胶凝温度进行评价,测定盐酸吉西他滨温敏凝胶的体外释放度;还建立了同时测定盐酸吉西他滨温敏凝胶中盐酸吉西他滨和碘海醇含量的测定方法。
1 仪器与试药
1.1仪器 电子分析天平( BS323S,德国Sartorius公司,感量:0.001 g);多头磁力加热搅拌器(HJ-6,常州国华电器有限公司);Malvern高级旋转流变仪(Kinexus Pro KNX2100,上海百思吉仪器有限公司);高效液相色谱仪(DGU-20A5R,日本岛津公司);pH计(HS-25,上海精密科学仪器有限公司);紫外-可见分光光度计(UV-1750,日本岛津公司);Welchrom C18色谱柱(250 mm×4.6 mm,5 μm);高速离心机(TG16,长沙英泰仪器有限公司);蠕动泵(保定兰格恒流泵有限公司);恒温磁力搅拌器(85-2型,上海司乐仪器有限公司);数控超声波清洗器(KQ-50DS,昆山市超声仪器有限公司)。
1.2试药 盐酸吉西他滨原料药(上海阿达玛斯试剂有限公司,批号:P07052-201506,含量:99%);PIB(国家纳米药物工程技术研究中心馈赠,批号:20170527);盐酸吉西他滨温敏凝胶(自制,批号:20170607,20170609,20170611);碘海醇(浙江海昌药业有限公司,批号:C001504003);乙酸铵[色谱级,阿拉丁试剂(上海)有限公司,含量≥99.0%,批号:A112057];氨丁三醇(深圳市优普惠药品有限公司,批号:8386I036,);乙二胺四乙酸钙钠盐水合物(上海笛柏化学品技术有限公司,含量≥98.0%,批号:K562008);乙-腈(色谱纯)。磷酸二氢钠(分析纯,国药集团化学试剂有限公司,批号:F20111123);磷酸氢二钠(分析纯,国药集团化学试剂有限公司,批号:20130802)。
2 方法与结果
2.1盐酸吉西他滨温敏凝胶的制备 精密称取碘海醇、稳定剂(氨丁三醇、EDTA钙钠盐水合物),置于干燥洁净烧杯,待其溶解后置于100 mL量瓶,加适量去离子水摇匀并定容。将配置好的碘海醇溶液倒入干燥洁净烧杯,精密称取处方量PIB、吉西他滨倒入烧杯,放入搅拌子,于冰浴条件下多头磁力搅拌器上以恒定转速搅拌24 h,直至得到淡蓝色均匀溶液,于4 ℃冰箱中静置60 min即得。
2.2盐酸吉西他滨温敏凝胶黏度的测定 取3批样品,分别采用旋转流变仪测定温敏凝胶黏度,设定流变仪底板温度为25 ℃,剪切速率300 s-1,记录黏度数据。结果为(31.06±1.72) mPa·s-1(n=3)。在常温状态下,温敏凝胶应为可自由流动液体,本制剂将温敏凝胶黏度期望值设定为20~35 mPa·s-1。当黏度值<20 mPa·s-1,温敏凝胶虽可胶凝,但易被血流冲刷;当黏度值大于35 mPa·s-1时,温敏凝胶流动性显著变差,在介入栓塞过程中,不易经导管导入肿瘤供血动脉栓塞。故本制剂黏度值符合要求。
2.3盐酸吉西他滨温敏凝胶复合模量及胶凝温度的测定 取3批样品,分别采用旋转流变仪测定温敏凝胶的胶凝温度及37 ℃时温敏凝胶复合模量,设定流变仪底板温度变化范围为25~40 ℃,记录数据。测得温敏凝胶胶凝温度为(34.30±0.01) ℃,温敏凝胶在37 ℃下复合模量为(120.20±9.15)Pa。对于介入栓塞用制剂,应在常温下保持较好的流动性,导入靶点后应能在原位胶凝,并具有一定强度,防止血流冲刷。本制剂胶凝温度略低于人体体温而高于室温,并且具有较高的复合模量,符合介入制剂的要求。
2.4盐酸吉西他滨温敏凝胶中盐酸吉西他滨和碘海醇的含量测定
2.4.1色谱条件 色谱柱:Welchrom-C18色谱柱(250 mm×4.6 mm,5 μm);流动相:醋酸铵缓冲液(取醋酸铵3.08 g溶于500 mL水中,用冰醋酸调节pH值至5.5±0.1,然后加水至1000 mL,搅匀即得):乙腈=(97.5:2.5);流速:1.0 mL·min-1;检测波长:270 nm;柱温:30 ℃;理论板数分别按吉西他滨和碘海醇计算,均不低于4000。
2.4.2溶液的制备 ①盐酸吉西他滨温敏凝胶供试品溶液的制备。精密量取“2.1”项盐酸吉西他滨温敏凝胶适量(相当于含盐酸吉西他滨0.2 g,碘海醇8.87 g),置超滤管中,高速离心,滤液置于4 ℃冰箱内保存。
精密量取滤液适量于100 mL量瓶,加去离子水至刻度,摇匀,制成每毫升约含盐酸吉西他滨0.2 mg、碘海醇以碘计1.37 mg的溶液,用孔径0.22 μm滤膜过滤,即得供试品溶液。
②对照品溶液的制备。精密称取盐酸吉西他滨0.1000 g、碘海醇4.3600 g、稳定剂适量于同一50 mL量瓶,加纯化水溶解并稀释至刻度摇匀,制成盐酸吉西他滨、碘海醇浓度分别为2和87.2 mg·mL-1(碘海醇浓度以碘计为13.71 mgI·mL-1)的溶液,并以此作为对照品储备液。精密吸取上述储备液1 mL于10 mL量瓶,加去离子水稀释至刻度并摇匀,用孔径0.22 μm滤膜滤过即得混合对照品溶液。
精密称取盐酸吉西他滨0.100 0 g适量于50 mL量瓶,加纯化水并稀释至刻度定容,制成2 mg·mL-1盐酸吉西他滨对照品溶液。
精密称取盐酸吉西他滨4.360 0 g适量于50 mL量瓶,加纯化水并稀释至刻度定容,制成13.71 mgI·mL-1碘海醇对照品溶液。
③空白凝胶溶液的制备。按“2.4.2”①项制备不含药及碘海醇的空白凝胶,置于超滤管中,离心后取滤液,稀释后经孔径0.22 μm滤膜滤过即得空白凝胶溶液。
2.4.3专属性实验 分别取按“2.4.2”项制备的盐酸吉西他滨、碘海醇对照品溶液、盐酸吉西他滨温敏凝胶供试品溶液及空白凝胶溶液各20 μL,按“2.4.1”项色谱条件进样分析,记录色谱图,见图1。盐酸吉西他滨出峰时间约11.5 min,碘海醇因其异构体结构,出双峰,分别约在18.5和20 min处出峰。空白辅料及溶剂对盐酸吉西他滨和碘海醇的含量测定无干扰。
2.4.4标准曲线的绘制 精密吸取“2.4.2”②项混合对照品储备液50,100,200,500,1000,2000 μL,置于10 mL量瓶,加入去离子水稀释至刻度,摇匀。分别得到盐酸吉西他滨浓度为5,10,20,50,100,200 μg·mL-1,碘海醇以碘计浓度为34.29,68.57,137.14,342.86,685.71,1371.43 μgI·mL-1标准溶液。将上述溶液过孔径0.22 μm滤膜后分别精密吸取20 μL,按照“2.3.1”项色谱条件依次进样分析,测定峰面积(A)。每个浓度测定3次,取峰面积平均值。以浓度(C,μg·mL-1)为横坐标,以A为纵坐标,进行线性回归。得回归方程。盐酸吉西他滨:A=30 295C+2 330.6,r=0.999 9;碘海醇:A=11 879C-29 613,r=0.999 6。结果表明,盐酸吉西他滨在5~200 μg·mL-1浓度范围内线性关系良好,碘海醇在34~1372 μgI·mL-1浓度范围内线性关系良好。
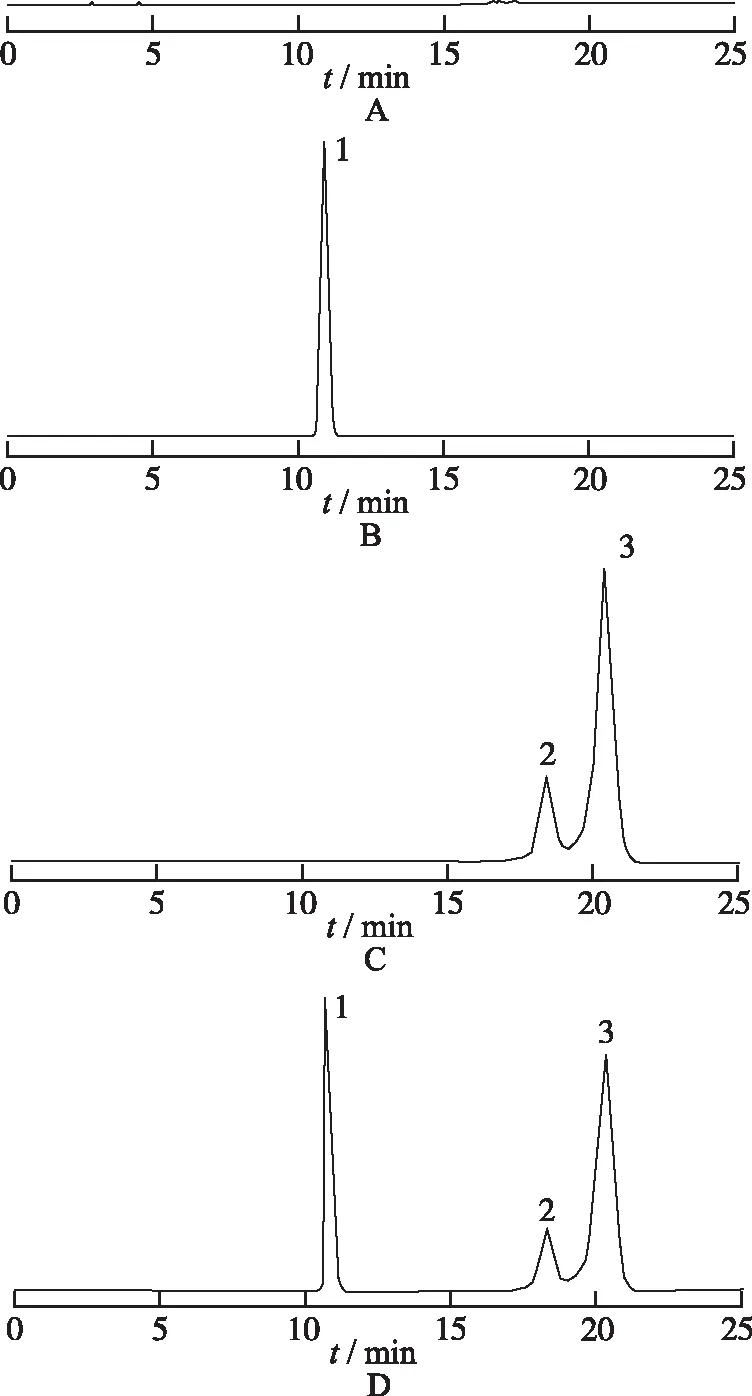
A.空白凝胶溶液;B.盐酸吉西他滨;C.碘海醇;D.盐酸吉西他滨温敏凝胶;1.吉西他滨;2-3.碘海醇
图14种溶液的HPLC图
A.blank gel solution;B.gemcitabine hydrochloride;C.iohexol;D.gemcitabine hydrochloride thermosensitive hydrogel;1.GEM;2-3.IOH
Fig.1HPLCchromatogramoffourkindsofsolution
2.4.5重复性实验 取同一批(批号:20170607)盐酸吉西他滨温敏凝胶样品6份,按“2.2.3”项制备样品溶液,测定峰面积,计算得到盐酸吉西他滨RSD为0.02%(n=6);碘海醇RSD为0.27%(n=6),表明该方法重复性良好。
2.4.6精密度实验 按“2.4.2”②项配制以盐酸吉西他滨计10,50,100 μg·mL-1;以碘海醇计68.57,342.86,685.71 μgI·mL-13种浓度混合对照品溶液,精密吸取20 μL,每个样品测定3次,于同一天3个时间段分别测定一次,测定其日间精密度;每天在同一时间段进样,分别连续测定3 d,测定其日间精密度。日内精密度:低中高浓度盐酸吉西他滨日内RSD分别为0.12%,0.05%,0.04%(n=3);碘海醇日内RSD分别为0.25%,0.32%,0.51%。日间精密度:低中高浓度盐酸吉西他滨日间RSD为0.22%,0.05%,0.09%(n=3);碘海醇日间RSD分别为0.24%,0.66%,0.61%(n=3)。表明该方法下日内及日间精密度均良好。
2.4.7加样回收率实验 配制80%,100%,120%溶液:精密吸取按“2.3.2”项制备的混合对照品溶液2.5 mL,置10 mL量瓶,分别加入供试品溶液1.5,2.5,3.5 mL,加入去离子水稀释定容至刻度,摇匀。每个浓度配制3份[4]。 精密吸取上述过滤后溶液20 μL注入色谱仪,按“2.4.1”项色谱条件依次进行分析,记录色谱图,计算回收率。结果低、中、高浓度盐酸吉西他滨的加样回收率分别为(100.0±0.8)%,(101.8±0.7)%,(99.80±2.3)%,RSD分别为0.63%,0.88%,0.93%。平均回收率100.53%,RSD=0.95(n=9);低、中、高浓度碘海醇加样回收率分别为(99.9±0.3)%,(99.5±0.7)%,(100.1±0.9)%,RSD分别为0.25%,0.31%,0.56%。平均回收率99.83%,RSD=0.77%(n=9)。
2.4.8样品含量测定 精密吸取3批温敏凝胶样品各6份(批号:20170607,20170609,20170611),每份1 mL。按“2.4.2”项制备供试品溶液,滤过后分别进样20 μL,记录峰面积,根据回归方程计算样品中盐酸吉西他滨及碘海醇的含量。结果见表1。盐酸吉西他滨平均含量为100.4%,RSD为0.73%;碘海醇平均含量为99.97%,RSD为0.31%。3批样品含量测定结果均在95%~105%,符合规定。
表1盐酸吉西他滨和碘海醇含量测定结果
Tab.1Resultsofcontentdeterminationofgemcitabinehydrochlorideandiodohexanol

%
2.5盐酸吉西他滨温敏凝胶体外释放度测定 采用蠕动泵进行体外释放实验,整个实验采用自制装备,本实验中用到的释放池为专门订制的三开口池。上端开口配玻璃塞,用于加样,加样后用玻璃塞封闭。释放池两端开口,左右对称,为直径0.5 cm、长约1 cm玻璃管,用于橡胶管与管道之间的连接。释放池一端连接蠕动泵,一端连接烧杯接收释放液,同时将释放池置于37 ℃恒温水浴锅;蠕动泵另一端连接同样置于37 ℃恒温水浴锅中PBS缓冲液,将泵转速设置为10 r·min-1(8.67 mL·h-1),待释放池中温敏凝胶相转变为半固体时,启动蠕动泵,等缓冲液流入释放池,开始计时[5]。分别在1,2,4,6,8,10,12,24,48 h定时取样,用孔径0.22 μm滤膜滤过后取续滤液按“2.3.1”项色谱条件进柱分析,测定峰面积,并根据回归方程计算含量,从而计算药物累积释放率。并采用零级动力学方程、一级动力学方程、Higuchi方程、Ritger-Peppas 方程、Neibergull方程对体外释放结果进行拟合。释放曲线见图2,拟合结果见表2。由图2和表2可知,盐酸吉西他滨在12 h处累积释药可达90.98%,从拟合方程R2值可知,释放曲线与Ritger-Peppas 方程拟合度最高,特征指数n=0.53,介于0.45~0.89,说明盐酸吉西他滨温敏凝胶中药物的释放为non-Fick释放,即扩散与骨架溶蚀共同控制释放过程。

图2 盐酸吉西他滨温敏凝胶累积释药曲线
Fig.2Curveofcumulativedrugreleaseofgemcitabinehydrochloridethermosensitivehydrogel
表2盐酸吉西他滨温敏凝胶体外释药曲线拟合结果
Tab.2Fittingequationofinvitroreleaseofgemcitabinehydrochloridethermosensitivehydrogel

模型拟合方程R2零级动力学方程Q=8.642 6t+4.750 40.971 9一级动力学方程Ln(100-Q)=0.235lnt+5.050 70.921 6Higuchi方程Q=38.532t1/2-41.480.949 7Ritger-Peppas 方程lnQ=1.1558lnt+1.733 50.990 6Neibergull方程(100-Q)1/2=0.679 7t+10.8630.960 1
3 讨论
介入栓塞剂与抗肿瘤药联合使用可显著提高介入治疗的效果,核糖核酸还原酶抑制剂盐酸吉西他滨主要代谢物在细胞内可以掺入DNA,主要作用于肿瘤细胞的G1/S期,使肿瘤细胞内脱氧核苷三磷酸酯减少。其毒性主要是骨髓抑制,其中对中性粒细胞和血小板影响较常见。与介入栓塞剂合用后,盐酸吉西他滨使用量可大幅减少,而肿瘤局部浓度可大幅提高。
常用于考察温敏凝胶制剂体外释放度的方法有透析袋法、无膜溶出法。笔者在本实验曾采用透析袋法对盐酸吉西他滨温敏凝胶的体外释放做过考察,但累积释放率不理想。考虑PIB为高分子材料,可能对透析袋的空隙造成一定堵塞,同时,经过一定时间振荡,透析袋内外浓度差可能达到平衡,这些都可能使盐酸吉西他滨不能释放完全。此外,盐酸吉西他滨温敏凝胶为肝癌动脉介入栓塞用制剂,故选用蠕动泵法模拟体内血流对凝胶冲刷的场景,相较于透析袋可更真实反映释放过程,同时可避免透析袋的上述缺陷。对于释放介质的选择,本实验则参考肿瘤微环境,选择了pH值6.8的PBS缓冲液作为释放介质。
对温敏凝胶中盐酸吉西他滨和碘海醇的含量测定采用HPLC法,而具有温度敏感性的化合物在作为药物载体时,对其中药物成分进行检测时通常会遇到各种困扰。PIB凝胶作为一种温度敏感性高分子聚合物[6],通过粒径检测仪检测,其平均粒径150~300 nm,若直接进柱进行液相分析,极有可能造成色谱柱堵塞,损坏仪器;同时因为盐酸吉西他滨温敏凝胶在常温下为液态,到达胶凝温度时会发生相变转化为半固体状态,在进入色谱柱后发生相变也极易堵塞色谱柱;因此在进柱前必须对样品进行处理,防止PIB对色谱柱产生影响。常用的有高温法、透析袋法,以及超滤法。其中高温法可能会对GEM产生影响;而透析袋法虽操作简单,但耗时较长。因此本研究采用超滤法,选用截留分子量为30 000的超滤管,将盐酸吉西他滨温敏凝胶、空白凝胶放入超滤管中,在5000 r·min-1条件下离心10 min后取其滤液,稀释到所需倍数然后进柱分析。该方法既解决了PIB凝胶对色谱柱的影响,又提高了实验效率,同时也为各种凝胶类药物的进柱前处理提供了一种新思路。
