炎症性肠病中MT、NF-κB及HIF-1α表达的相关性
2019-03-06张目涵王斌斌杜晓博王丹丹杨贝贝王许平冯百岁
高 闯,张目涵,王斌斌,杜晓博,王丹丹,杨贝贝,耿 丽,王许平,冯百岁
(郑州大学第二附属医院消化内科暨炎症性肠病中心,吴阶平医学基金会炎症性肠病联盟河南省炎症性肠病中心,郑州 450014;*通讯作者,E-mail:fbs163@163.com)
炎症性肠病(inflammatory bowel disease,IBD)是一类多种病因引起、异常免疫反应介导的肠道慢性复发性炎症,包括溃疡性结肠炎(ulcerative colitis,UC)和克罗恩病(crohn’s disease,CD)。肠道黏膜屏障功能受损是炎症性肠病的重要发病机制,当肠道黏膜屏障受损后加重致病菌的感染,通过细菌氧耗增加、激活缺氧敏感通路等途径造成肠道缺氧区域的形成[1]。金属硫蛋白(metallothionein,MT)是一类富含半胱氨酸的低分子量蛋白质,共有四种亚型,分别为MT-1、MT-2、MT-3和MT-4。其中主要亚型为MT-1和MT-2,广泛分布于多种组织器官中[2]。MT-1/2作为体内重要的抗氧化剂,因为它的结构域中含有大量处于还原状态的巯基,是其发挥抗氧化作用的活性中心[3],在肠道炎症中MT可能通过参与抑制氧化损伤作用来发挥保护肠道屏障功能的作用。正常条件下核因子-κB(nuclear factor-κB,NF-κB)的表达受到抑制,当组织发生缺氧及炎症条件下可以促进NF-κB的表达[4]。缺氧诱导因子-1α(hypoxia-inducible factor-1α,HIF-1α)在组织中具有高度的氧敏感性,细胞正常氧浓度下HIF-1α可以发生降解,缺氧环境可以增加HIF-1α的结构稳定性且处于高表达状态[5]。本文通过检测MT、NF-κB及HIF-1α的表达水平及其相关性来探究它们在炎症性肠病中的作用,从而为炎症性肠病的治疗提供新思路。
1 资料与方法
1.1 一般资料
收集2017-06~2018-06郑州大学第二附属医院住院的炎症性肠病患者结肠组织活检石蜡包埋标本及血清样本,其中UC患者30例,年龄18-55岁,平均(35.4±6.6)岁;CD患者30例,年龄20-60岁,平均(38.2±7.8)岁。所有患者均符合2018年中华医学会消化病学分会炎症性肠病学组制定的UC及CD诊断标准[6]。另外选取的30例结肠组织对照组均为结直肠癌患者外科手术切除距癌组织5 cm以上的结肠组织,年龄25-55岁,平均年龄(40.7±8.5)岁。30例健康志愿者血清标本作为对照,年龄23-50岁,平均年龄(31.2±7.4)岁。所有对象受试前均未接受糖皮质激素及免疫抑制剂等治疗,未合并其他自身免疫性疾病。研究对象均签署知情同意书。
1.2 常规免疫组织化学SABC法检测
MT及NF-κB的表达IBD患者的活检组织及结直肠癌患者的癌旁组织进行石蜡包埋切片,组织切片经脱蜡、水化、封闭、抗原微波修复、分别滴加兔抗人多克隆抗体MT(博奥森生物技术公司)及NF-κB p65(美国Affinity公司)(稀释浓度分别是1 ∶400及1 ∶100)、滴加生物素标记的二抗、过氧化物酶复合物、DAB显色、苏木素复染、各步骤之间用PBS冲洗3次,每次5 min,依次脱水、透明、封片。以PBS代替一抗作阴性对照,以已知阳性切片作阳性对照。均严格按照试剂盒说明书步骤进行操作。免疫组织化学染色在光镜(400倍)下选取5个不重复视野观察,胞浆内出现棕褐色颗粒的细胞为阳性细胞,取每个视野下平均阳性细胞作为计数标准,阳性细胞所占百分比:0-25%为0分,26%-50%为1分,51%-75%为2分,≥75%为3分;染色强度:无色或黄色为1分,棕色为2分,褐色为3分,以上两项得分之和≥3分为阳性,<3分为阴性。
1.3 ELISA法检测血清中HIF-1α的质量浓度
所有研究对象均在清晨空腹抽取3 ml静脉血,离心后取血清冻存,应用ELISA试剂盒检测UC组、CD组及健康对照组血清中HIF-1α的质量浓度,试剂购买自美国R&D公司,实验严格按照试剂盒说明书进行。
1.4 统计学处理
2 结果
2.1 炎症性肠病患者结肠黏膜中MT、NF-κB的表达比较
正常对照组、UC组、CD组结肠黏膜组织中MT表达阳性率分别为80%(24/30),20%(6/30)和24%(7/30);NF-κB的表达阳性率分别为17%(5/30),90%(27/30)和87%(26/30)。各组结肠组织中MT和NF-κB表达差异均有统计学意义(P<0.01)。其中MT的表达UC组和CD组低于正常对照组,NF-κB的表达UC组和CD组高于正常对照组。各组结肠组织中MT的表达见图1,NF-κB的表达见图2。
2.2 各组血清中HIF-1α的质量浓度
CD组和UC组血清中HIF-1α的表达水平高于正常对照组(均P<0.05,见表1)。
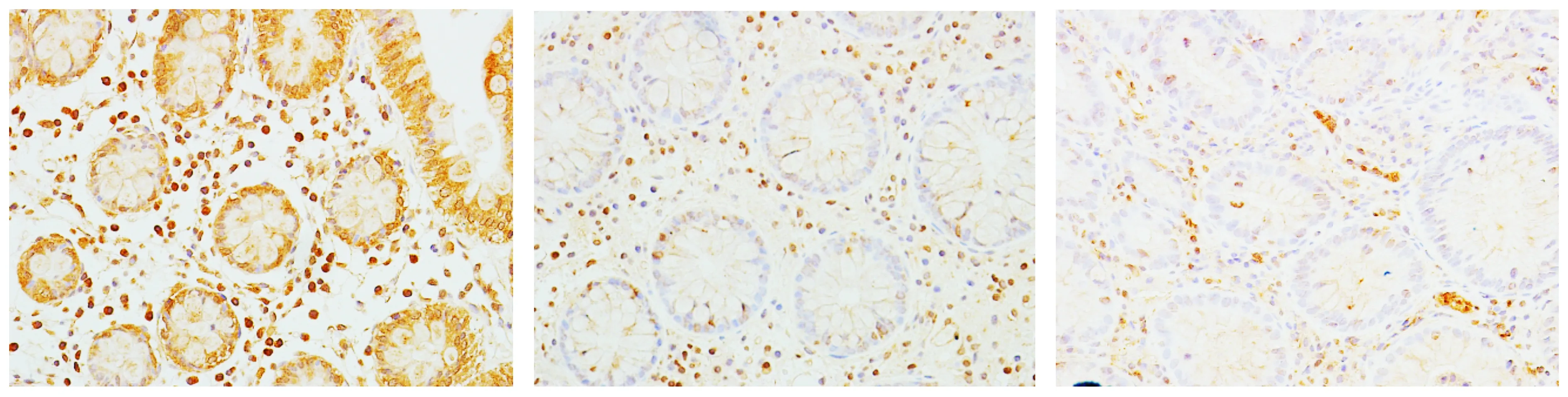
A.正常对照组B.CD组C.UC组图1 各组结肠组织中MT的表达Figure 1 Expression of MT in colon tissue of each group
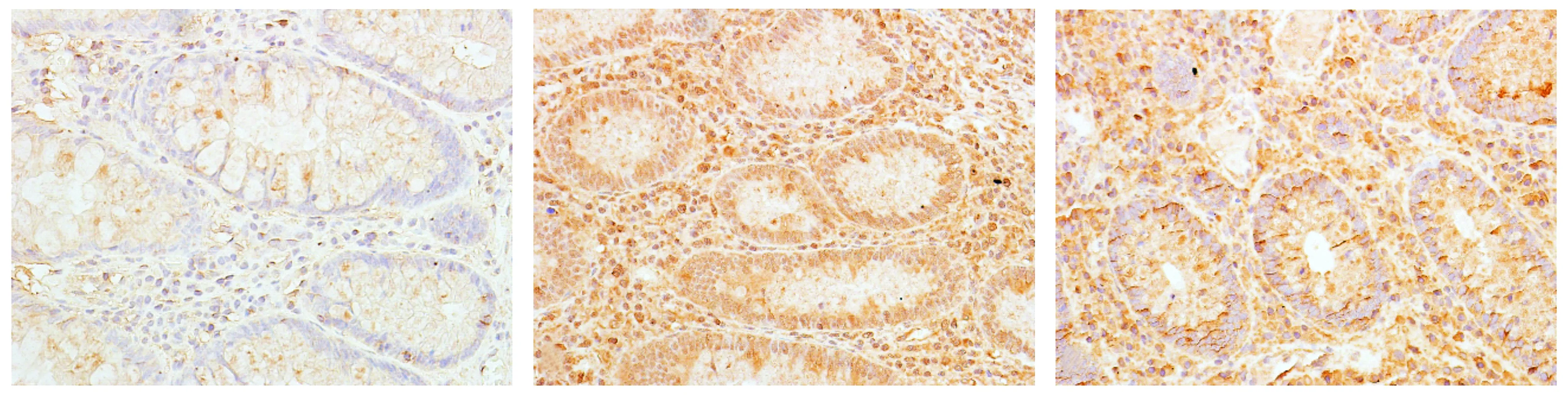
A.正常对照组B.CD组C.UC组图2 各组结肠组织中NF-κB的表达Figure 2 Expression of NF-κB in colon tissue of each group
表1各组血清中HIF-1α的表达水平(pg/ml)
Table1ExpressionlevelsofHIF-1αinserumofeachgroup(pg/ml)
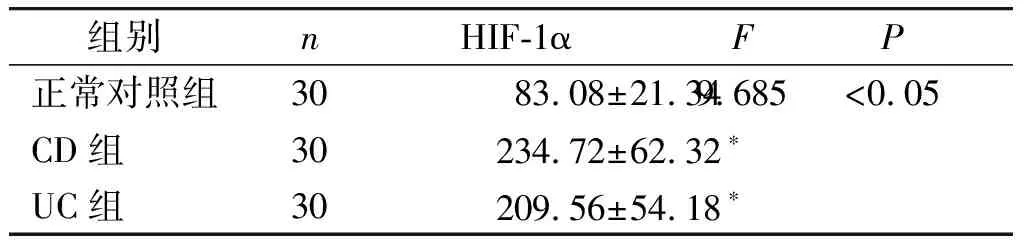
组别nHIF-1αFP正常对照组3083.08±21.349.685<0.05CD组30234.72±62.32∗UC组30209.56±54.18∗
与正常对照组比较,*P<0.05
2.3 MT、NF-κB及HIF-1α之间表达的相关性分析
使用Pearson相关性分析检测各组结肠组织中MT的表达与结肠组织中NF-κB的表达呈负相关(r=-0.792,P<0.01);各组结肠组织中MT的表达与血清中HIF-1α的表达呈负相关(r=-0.746,P<0.01);各组结肠组织中NF-κB的表达与血清中HIF-1α的表达呈正相关(r=0.814,P<0.01)。
3 讨论
炎症性肠病是一种病因和发病机制尚不十分清楚的肠道慢性非特异性炎症性疾病,其发病机制十分复杂,涉及感染、免疫、遗传、环境等因素[7]。研究发现在炎症条件下造成结肠黏膜缺氧区域形成是炎症性肠病重要的发病机制之一[8]。结肠炎症反应可以引起多种活性氧物质,包括过氧化物、超氧化物、有机氧、单体氧等,这类活性氧主要在内源性线粒体氧化呼吸链产生,肠道炎症条件下促进活性氧物质大量表达,抑制线粒体氧化反应,减少ATP的产生,影响结肠细胞能量供给,进一步加重炎症反应[9]。
MT是由多种应激条件下诱导产生的一类应激反应蛋白,它的结构中大量巯基结构可以直接发挥抗氧化作用,同时研究表明MT可以直接参与氧化呼吸中三羧酸循环中ATP酶硝基化促进葡萄糖利用及能量供给[10],又可以通过抑制活性氧合成酶减少活性氧的产生来减轻炎症损伤,所以MT可以通过多种机制发挥其高效细胞保护剂的作用[11]。
NF-κB是1986年在B淋巴细胞的细胞核提取物中发现的,正常条件下NF-κB与细胞内源性抑制物IB(inhibitor of NF-κB,IB)结合呈非活性状态[12]。研究证明NF-κB是一种多效的信号转录因子,受多种因素如趋化因子、氧化应激等刺激而激活后可以参与机体多种炎症反应、免疫反应、细胞凋亡等多种变化过程[13]。本研究结果显示不同结肠黏膜中MT和NF-κB的表达差异有统计学意义(P<0.05),同时MT与NF-κB的表达水平呈负相关(r=-0.792,P<0.01),研究发现MT可以通过抑制IB解离来抑制NF-κB的转录活性[14],提示MT可能通过抑制NF-κB的激活在肠道的保护机制中发挥作用。
HIF-1α是一种随细胞氧含量变化而产生的转录激活因子,正常细胞环境中HIF-1α处于不稳定状态,容易被氧依赖的泛素蛋白酶体所降解,缺氧环境中HIF-1α稳定性增加并且在多种组织中大量表达[15]。HIF-1α可以促使多种基因表达通过增加缺氧组织供氧能力或增强缺氧细胞的缺氧耐受能力来代偿性维持细胞内环境稳定性[16]。研究表明NF-κB信号通路激活可以促进HIF-1α的表达[17]。本研究结果显示UC及CD患者血清中HIF-1α的表达高于正常对照组(P<0.05)。各组结肠黏膜中NF-κB的表达与血清中HIF-1α的表达呈正相关(r=0.814,P<0.01)。
综上所述,MT表达变化可能影响NF-κB及HIF-1α的表达参与炎症性肠病的发病过程,因此进一步了解MT的作用机制可以提供炎症性肠病新的治疗靶点。
