仿生磷酸钙缓释涂层改性三维支架的制备及性能研究
2019-03-06刘昌奎
刘 宁,朱 勇,刘昌奎,郭 芳,黄 硕,李 芳
(1西安医学院口腔医学系口腔颌面外科学教研室,西安 710021;2军事口腔医学国家重点实验室,国家口腔疾病临床医学研究中心,陕西省口腔医学重点实验室,空军军医大学口腔医院修复科;*通讯作者,E-mail:ningliu@xiyi.edu.cn)
随着口腔种植学的飞速发展,口腔种植义齿已不再是传统义齿修复的补充手段,而成为患者较为理想的义齿修复方式,被赞誉为人类的第三副牙齿。然而,由于牙齿拔除后牙槽嵴的吸收改建,常导致患者牙槽嵴宽度、高度不足,限制种植体的植入。自体骨移植是骨组织缺损修复的金标准,但由于口腔内种植区可利用的自体骨量有限,异位取骨又伴随多种并发症,因此多种骨替代材料被研制和开发出来[1]。去蛋白牛骨无机材料(deproteinized bovine bone,DBB)是目前口腔临床广泛应用的骨替代材料,具有较高的亲水性、与人体骨组织相似的晶体结构,但其生物相容性一般、缺乏成骨诱导能力、不能促进多潜能间充质干细胞向成骨细胞方向分化,限制其成骨效果[2]。淫羊藿苷(icariin,ICA)是一种良好的骨性诱导因子,性质稳定,能够促进骨髓间充质干细胞成骨分化[3]。碱性磷酸酶(alkaline phosphatase,ALP)是间充质干细胞早期成骨分化的指标。本研究拟运用仿生磷酸钙涂层技术,将ICA负载到DBB表面的磷酸钙(calcium phosphate,CaP)涂层中,检测脂肪干细胞(adipose derived mesenchymal stem cells,ASCs)在改性材料上的ALP活性,为改性材料用于临床骨再生治疗提供实验室依据。
1 材料和方法
1.1 实验动物
健康雄性C57小鼠,2周龄,4只,向空军军医大学动物实验中心申领。
1.2 主要试剂和仪器
α-MEM培养基、胎牛血清、PBS缓冲液(Hyclone,美国),胶原酶Ⅰ型(Sigma,美国),淫羊藿苷(源叶生物,中国),成骨诱导分化培养基试剂盒、成脂诱导分化培养基试剂盒、茜素红、油红O染液(赛业,中国)。超净工作台、低温高速离心机(Thermo,美国),二氧化碳恒温培养箱(三洋,日本),倒置相差显微镜及照相系统(Nikon,日本),扫描电镜(JEOL,日本),酶标仪(Tecan,瑞士)。
1.3 脂肪干细胞的分离、培养及形态学观察
4只2周龄C57雄鼠过量麻醉处死,无菌条件下,取双侧腹股沟脂肪组织置于培养皿中,清除外包膜及肉眼可见的小血管,PBS清洗后剪碎成约为1 mm3组织块,加入0.075%的胶原酶37 ℃振荡消化60 min。待消化完成后,1 000 r/min离心5 min。弃上清,向离心管内加入2 ml含10%胎牛血清的α-MEM培养液,再次1 000 r/min离心5 min。加入5 ml培养液重悬,将悬液接种于25 cm2培养瓶内,置于37 ℃、5% CO2孵箱中培养。培养3 d后换液,显微镜下观察细胞形态。细胞融合度达到80%时传代,将细胞培养至第3代,进行后续实验。
1.4 成骨诱导及成脂诱导
成骨诱导实验取第3代ASCs,消化后以105个/孔的密度接种于包被0.1%明胶的6孔板中培养。当细胞达到60%-70%融合度时,向6孔板中加入2 ml脂肪间质干细胞成骨诱导分化培养液,每3 d换1次液。培养至21 d,4%多聚甲醛溶液固定30 min,PBS漂洗3遍,茜素红染液常温染色15 min,PBS漂洗3遍,将培养板置于显微镜下观察成骨染色效果。
成脂诱导实验取第3代ASCs,消化后以105个/孔的密度接种于6孔板中培养。当细胞达到100%融合时,小心地吸走培养液,向孔板中加入2 ml成脂诱导分化培养液。成脂诱导18 d,4%多聚甲醛溶液固定30 min,PBS漂洗3遍,油红O染料工作液染色30 min,PBS漂洗3遍,将培养板置于显微镜下观察成脂染色效果。
1.5 仿生矿化磷酸钙涂层的制备及扫描电镜观察
将0.1 g DBB材料浸泡在10 ml 5倍模拟体液(simulated body flude,SBF)(684 mmol/L NaCl;21 mmol/L NaHCO3;5 mmol/L Na2HPO4·2H2O;7.5 mmol/L MgCl2·2H2O)中24 h,冷冻干燥,则在材料表面形成一层无定型CaP涂层。然后将其浸泡在1 ml饱和SBF(2 mmol/L Na2HPO4·2H2O;40 mmol/L HCl;4 mmol/L CaCl2·2H2O;50 mmol/L TRIS base)中48 h,冷冻干燥,则在无定型CaP涂层表面形成结晶状CaP涂层[4]。将材料脱水、干燥、喷金,场发射扫描电子显微镜观察材料表面形态。
1.6 细胞附着的扫描电镜观察
取生长状态良好的第3代ASCs,0.25%胰蛋白酶消化1 min,1 000 r/min离心5 min,收集细胞,调整密度为106个/ml的细胞悬液。将0.1 ml上述细胞悬液均匀滴加于板底放有DBB或CaP涂层改性DBB的96孔板中。细胞接种于支架材料上24 h,吸弃原培养液,PBS小心漂洗3遍,2.5%戊二醛固定12 h。50%,70%,80%,90%,95%的乙醇脱水1次,100%乙醇脱水2次,每次15 min。临界点干燥,喷金,扫描电镜观察细胞在材料上的附着、伸展情况。
1.7 碱性磷酸酶活性检测
涂层制备时在饱和SBF溶液中加入5 mg/L的ICA,ICA会随着结晶状CaP涂层的形成沉积到CaP晶体中,从而制备负载ICA的CaP涂层改性DBB材料。将实验分为3组:DBB组(未经处理的DBB);CaP组(CaP涂层改性的DBB);ICA-CaP组(CaP涂层内含有ICA的DBB)。将各组材料置于12孔板中,每孔放入0.2 g材料,用含10% FBS的α-MEM培养液润湿材料。取生长状态良好的第3代ASCs,消化、离心、重悬,血细胞计数器计数,将细胞密度调整为5×105个/ml的细胞悬液,12孔板每孔加入1 ml细胞悬液均匀接种,5% CO2孵育箱内孵育,每3-4 d换一次培养液。培养至第7天吸弃培养液,PBS漂洗3遍,每孔加入1 ml 1% Triton X-100,37 ℃孵育1 h,吸出裂解液,离心后取上清。在96孔板中,按照碱性磷酸酶测定试剂盒和BCA蛋白含量检测试剂盒说明书要求进行检测。根据公式计算碱性磷酸酶活性:碱性磷酸酶(U/g)=(测定孔吸光度-空白孔吸光度)/(标准孔吸光度-空白孔吸光度)×酚标准品浓度(0.02 mg/ml)÷待测样品蛋白浓度(g/ml)。
1.8 统计学分析
使用SPSS18.0软件进行统计学分析,计量数据以均数±标准差表示,实验结果采用one-way ANOVA进行统计分析,并采用最小显著差法(least significant difference,LSD)进行组间比较,以双侧P<0.05为差异有统计学意义。
2 结果
2.1 脂肪干细胞形态学观察
原代细胞培养3 d,显微镜下ASCs呈簇或散在分布,大部分细胞呈纤维细胞样梭形,突起细长,部分细胞呈多边形(见图1)。
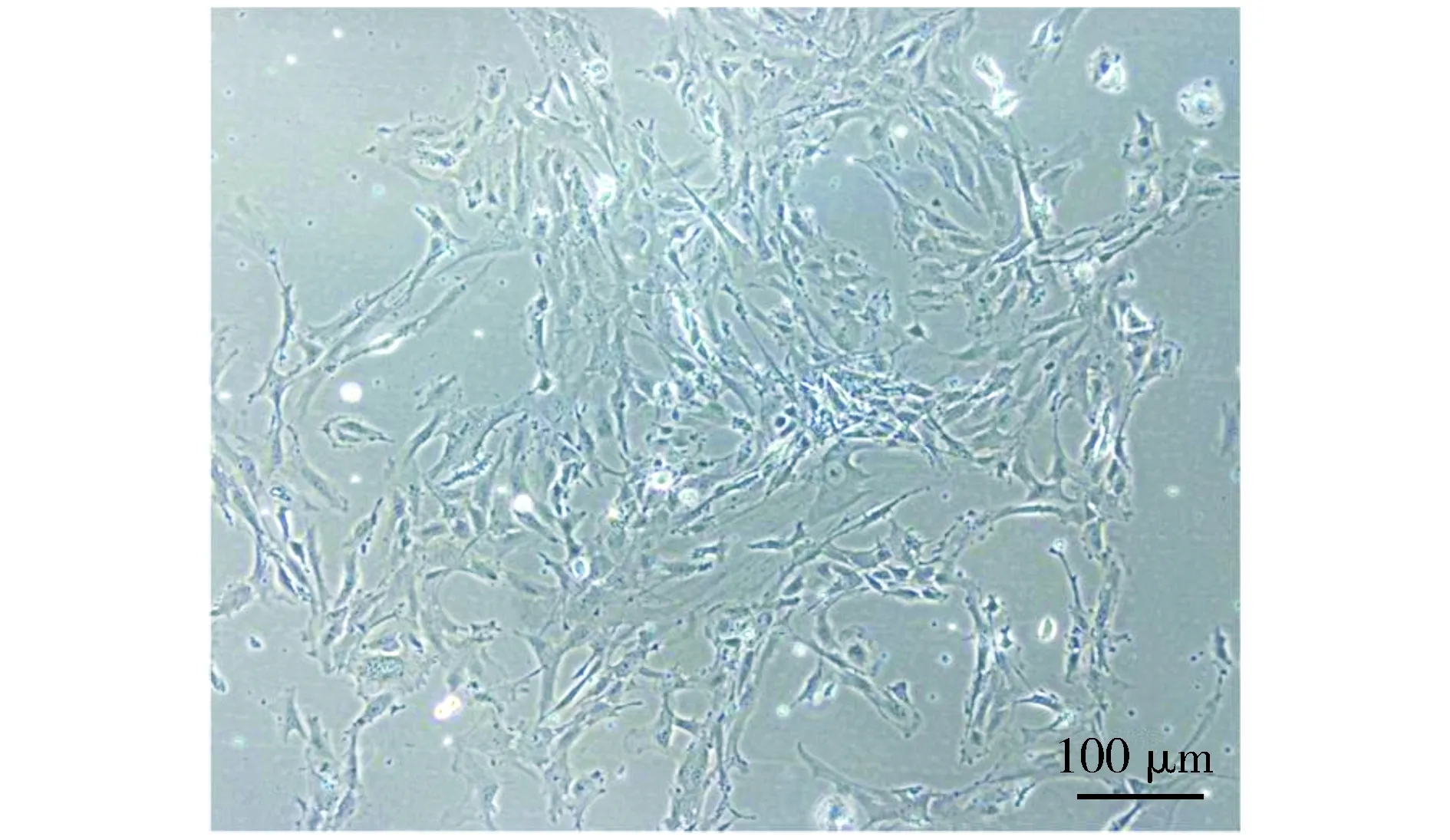
图1 显微镜下观察ASCs的细胞形态 (×100)Figure 1 The morphology of ASCs under a microscope (×100)
2.2 成骨诱导及成脂诱导
ASCs成骨诱导21 d,茜素红染色,显微镜下观察可见大量散在分布的红色矿化结节,外围呈橘红色,中心呈红棕色(见图2A)。ASCs成脂诱导18 d,油红O染色,显微镜下观察可见细胞胞质内含有大量大小不等的橘红色圆形脂滴(见图2B)。
2.3 材料表面形貌及细胞附着的扫描电镜观察
DBB的表面为不平坦的沟壑状形貌(见图3A、3B)。CaP涂层改性DBB的表面为相互交错的网格状结晶体(见图3D、3E)。ASCs接种在支架材料上24 h后的细胞形态,DBB和CaP涂层表面附着的细胞均铺展良好,细胞形态完整呈扁平多角形,伸出伪足,但CaP涂层表面附着的细胞量相对较多,彼此连接呈片状(见图3C、3F)。
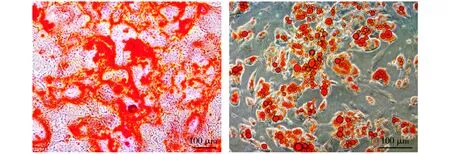
A.茜素红染色(×100) B.油红O染色(×200)图2 ASCs成骨和成脂诱导染色Figure 2 Staining of ASCs osteogenesis and lipogenic induction
2.4 碱性磷酸酶活性检测
ASCs在支架材料上培养7 d后的ALP活性结果(见图4)。DBB组与CaP组的ALP活性差异无统计学意义。ICA-CaP组的ALP活性显著高于DBB组和CaP组(P<0.05)。
3 讨论
DBB是目前口腔临床骨再生手术中广泛应用的骨替代材料[5-7]。它是将小牛松质骨经多次煅烧和化学处理,彻底去除其中的有机成分,从而保留下来的基本骨小梁结构,是一种天然的具有骨引导性能的多孔支架材料。DBB的主要成分是羟基磷灰石,化学组成及晶体结构与人体松质骨接近。其具有较高的亲水性,三维立体的多孔结构,可引导细胞向其内部生长和营养物质的进入。然而,DBB自身缺乏成骨诱导性能,不能诱导间充质干细胞向成骨细胞分化[7]。为了克服这个缺点,本研究拟运用仿生磷酸钙涂层技术,将ICA负载到DBB表面,从而提高DBB促进骨再生的能力。
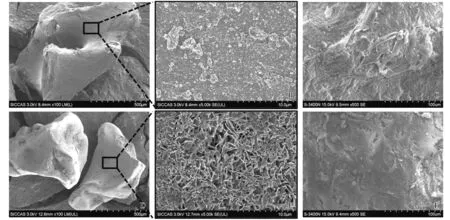
A.低倍镜下DBB表面形貌 (×100); B.高倍镜下DBB表面形貌 (×5 000); C.ASCs在DBB表面附着24 h后细胞形态 (×500);D.低倍镜下CaP涂层表面形貌 (×100);E.高倍镜下CaP涂层表面形貌 (×5 000);F.ASCs在CaP涂层表面附着24 h后细胞形态 (×500)图3 材料表面形貌及细胞附着的扫描电镜观察Figure 3 Observation of surface morphology and cell attachment of scaffolds under scanning electron microscopy
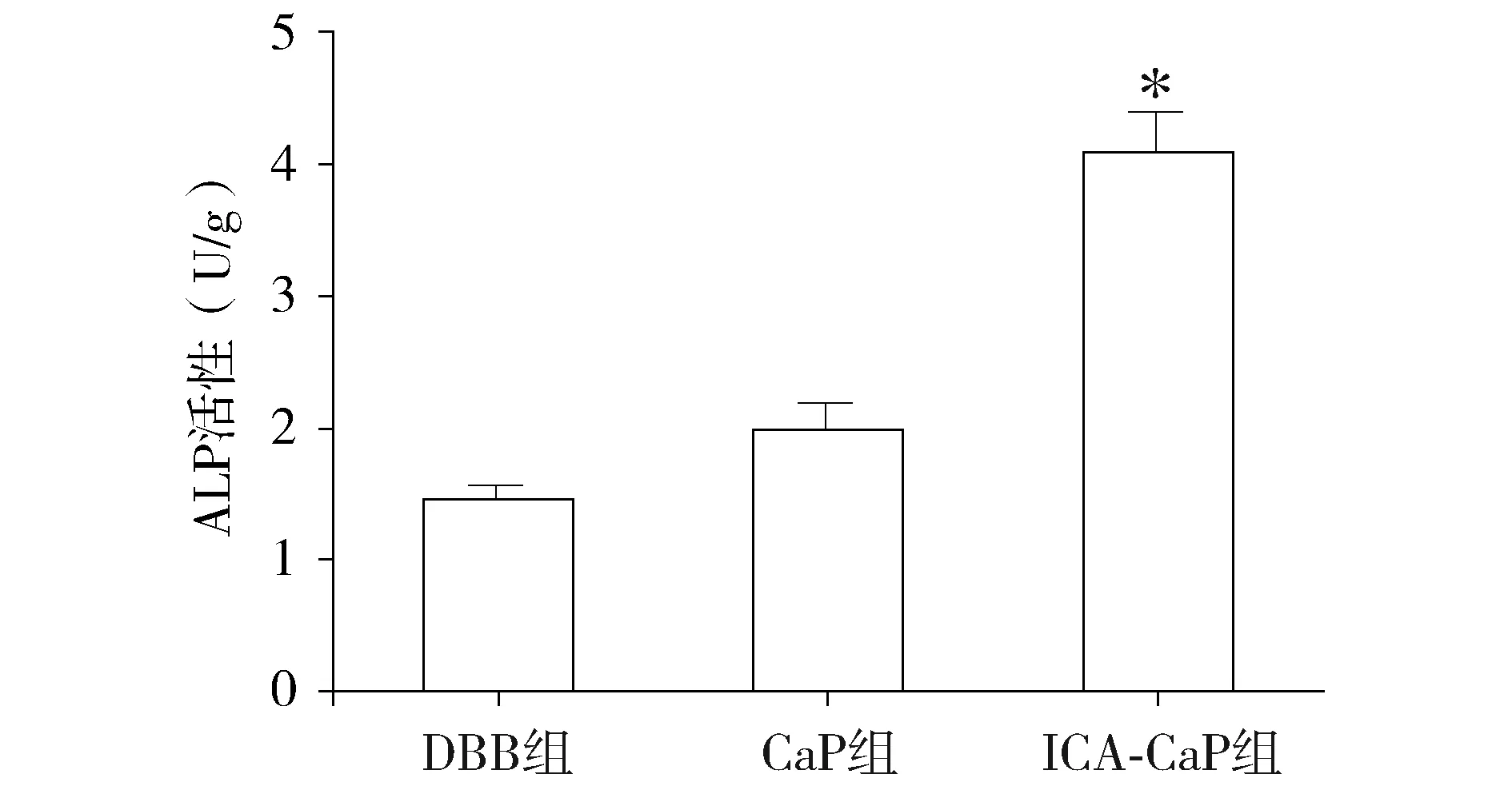
与其他两组比较,*P<0.05图4 ASCs在支架材料上培养7 d后的ALP活性Figure 4 The ALP activity of ASCs cultured on the scaffolds for 7 d
ASCs是近年研究发现的一种新的成体干细胞,该细胞取材方便,增殖能力强,具有一定的免疫调节能力和多向分化潜能。De Ugarte等[8]的研究显示,人脂肪来源间充质干细胞与骨髓来源间充质干细胞的成骨分化能力没有明显区别。近年来,人们逐渐认识到ASCs与三维支架材料联合应用,可方便临床上ASCs的移植操作,并且可有效促进组织再生[9,10]。因此,本研究选择ASCs作为研究诱导成骨分化的种子细胞。然而细胞的原代培养是细胞学实验研究的基础,实验首先采用胶原酶消化和密度梯度离心法对细胞进行分离培养,镜下观察细胞呈纤维细胞样梭形。多向分化潜能是干细胞的重要生物学特性之一,成骨和成脂分化是干细胞的两个基本分化方向,是目前公认的用于鉴定干细胞分化功能的方法。实验分别将ASCs进行成骨和成脂诱导,诱导一段时间后可见细胞间出现大量的矿化结节和脂滴,表明细胞具备多向分化潜能,为本研究改性材料生物相容性和成骨诱导性能的检测提供所需要间充质干细胞。
在众多的涂覆方式中,仿生磷酸钙涂层技术是一种简便、高效的涂覆方法。不同于高温等离子喷涂,仿生磷酸钙涂层在生理温度和pH条件下就会发生沉积,形成的晶体结构与骨质结构类似[11],且随着CaP涂层晶体的形成,成骨诱导因子通过共沉积会结合到涂层的网络结晶中并保持活性,从而赋予材料成骨诱导性能[12]。本研究采用仿生磷酸钙涂层技术对DBB表面进行改性。扫描电镜实验结果表明,CaP涂层成功实现在DBB表面沉积,DBB表面原本是不平坦的沟壑状形貌,CaP涂层沉积后变成相互交错的网格状结晶体,CaP涂层增大了DBB的孔隙和表面积。ASCs附着实验的扫描电镜结果显示,CaP涂层表面附着的细胞数量相对较多,说明相比未经处理的DBB,ASCs在CaP涂层改性的DBB表面更容易附着。
ICA是从淫羊藿中提取的一种黄酮类化合物,是淫羊藿的主要活性成分之一,分子式为C33H40O15,分子量为676.65,价格低廉,性质稳定,常用于治疗骨折及与骨代谢相关的疾病[13]。目前淫羊藿苷对骨髓间充质干细胞的成骨作用研究较多,体外和体内实验证实ICA能够促进骨髓间充质干细胞成骨分化,是一种良好的骨性诱导因子[14-16]。近年研究表明,淫羊藿苷亦可促进脂肪、牙周膜等组织来源的间充质干细胞成骨分化,但是此类研究相对较少。在ICA作用于ASCs的成骨分化研究上,仅检索到宁兆荣等[17]通过兔下颌骨缺损再生的体内研究,证实ASCs复合负载淫羊藿苷的支架材料具有明显的促进骨缺损修复能力,效果优于其他组。ALP是间充质干细胞早期成骨分化的指标,本研究将ASCs接种在ICA-CaP涂层改性的DBB表面并培养7 d,随后检测ALP活性,结果显示ICA-CaP组的ALP活性显著高于其他组(P<0.05),表明ICA可以有效促进ASCs的成骨分化,从而证明ICA-CaP涂层改性的DBB具有成骨诱导性能。然而,淫羊藿苷在材料上的最佳负载量以及改性DBB在体内促进骨再生的作用如何,课题组将在本实验的基础上做进一步研究。
本研究运用仿生磷酸钙涂层技术对DBB进行改性,将ICA负载到DBB表面的磷酸钙涂层中,检测ASCs在材料上的附着及成骨分化,结果表明改性DBB具有良好的生物相容性及骨诱导性,有望为口腔临床骨再生手术提供理想的骨替代材料。
