miR-128通过调控NOVA1的表达抑制肾透明细胞癌发展的进程
2019-03-06毛晓娟付晓亮杨增悦郭金刚
徐 冰,毛晓娟,付晓亮,舒 涛,杨增悦,王 东*,郭金刚
(1陕西航天医院泌尿外科,西安 710025;2渭南市妇幼保健院;3空军医科大学唐都医院泌尿外科;*通讯作者,E-mail:wangdongtangdu@163.com)
肾透明细胞癌(clear cell renal cell carcinoma,ccRCC)属于泌尿系统肿瘤,在所有肾癌中发病率最高,且在泌尿系统中发病率仅次于膀胱癌[1-3]。在世界范围内,ccRCC的发病率及死亡率都呈现快速上升趋势,严重影响人类的身体健康和生活质量[4]。目前ccRCC最有效的治疗方法为根治性肾癌切除手术。约60%的肾透明细胞癌患者会发生病灶转移,发生病灶转移的患者在接受上述方式治疗后仍有约30%的患者发生复发病灶转移现象,并且发生病灶转移的患者生存率非常低[5]。目前关于ccRCC的发生发展机制研究非常少,深入探索ccRCC的分子机制可以为其治疗或诊断提供重要的理论基础。
近年来,越来越多的研究显示,微小RNAs(microRNAs,miRNAs)可通过调控功能基因转录后的表达水平,参与调控多种细胞生命过程,其中包括细胞的新陈代谢、增殖、分化以及凋亡等,并且在多种肿瘤发生发展过程中,miRNAs发挥重要的调控作用[6,7]。本研究表明:miR-218可通过调控NOVA1的表达抑制肾透明细胞癌发展的进程,这为了解ccRCC的发病机制提供理论基础。
1 材料与方法
1.1 细胞株与主要试剂
HK-2、Caki-1和Caki-2细胞系购于上海继和生物科技有限公司,NOVA1、GAPDH、U6、miR-128等引物由生工生物工程(上海)有限公司合成;KSFM培养基购于上海博升生物科技有限公司;McCoy’s 5A培养基购于生工生物工程(上海)有限公司;胎牛血清、Trizol和Lipofectamine2000脂质体购自美国Invitrogen公司;mRNA、miRNA反转录试剂盒和Power SYBR Green PCR Master Mix均购于美国Gibco公司;Matrigel胶购于美国BD公司;NOVA1、GAPDH抗体和辣根过氧化物酶标记二抗均购于美国Santa公司;DharmaFECT Duo试剂、RIPA裂解液、ECL试剂均购于上海宝赛生物科技有限公司。
1.2 细胞培养
本研究以正常人肾上皮细胞HK-2细胞系和肾透明细胞系Caki-1、Caki-2等作为研究模型,利用KSFM培养基培养HK-2细胞,利用McCoy’s 5A培养基培养Caki-1和Caki-2细胞,培养基中均含有10%胎牛血清以及浓度为100 μmol/ml链霉素/青霉素。将加入培养基的细胞转移至37 ℃ 5% CO2培养箱中继续培养48 h,挑选生长状态优良的细胞进行后续实验。
1.3 细胞转染
NC miRNA、miR-128 mimic、miR-128 inhibitor、siNOVA1均于上海吉玛制药技术有限公司购买,利用Lipofectamine2000脂质体与上述合成的核酸片段混合,按使用说明书转染Caki-1或Caki-2细胞系,转染后于培养箱中以正常细胞培养方式继续培养24 h,利用RT-qPCR检测分析细胞转染效率。
1.4 细胞总RNA提取及实时荧光定量PCR
利用消毒无菌离心管收集培养的细胞,离心弃去上清,吸取1 ml Trizol试剂加入至离心管中,振荡器上剧烈震荡1 min;震荡结束后向离心管中加入200 μl预冷氯仿再次震荡,冰上静置5 min;4 ℃ 13 000 r/min离心10 min;将上清液转移至新的无菌无RNA酶污染的离心管中,加入1/2上清液体积的预冷异丙醇,上下颠倒混匀,-20 ℃静置10 min;再次于低温高速离心机中以同样转速离心10 min,弃去上清;加入预冷的75%乙醇,离心机中离心1 min弃去上清,重复1次;吸除并吹干乙醇,利用30 μl RNase free水溶解并混匀;超微量分光光度计检测细胞总RNA OD260/280以及核酸浓度,进行后续实验或-20 ℃保存备用。
利用M-MLV和TaqMan microRNA反转录试剂盒分别合成mRNA和miRNA,操作步骤参考试剂盒说明书,细胞总RNA用量为1 μg;随后利用Power SYBR Green PCR Master Mix试剂盒进行mRNA或miRNA相对表达量检测。检测程序设定为:95 ℃,10 s;55 ℃,15 s;72 ℃,30 s;45个循环。mRNA内参为GAPDH,miRNA内参为U6。
1.5 细胞增殖(MTT)实验
首先按照1.2细胞培养方法培养待检测细胞系,利用胰蛋白酶酶解为单细胞,并充分悬浮,将细胞悬液接种于96孔板中,继续培养48 h,将培养的细胞置于全自动荧光酶标仪中,以波长490 nm检测细胞悬液的吸光值。
1.6 细胞侵袭实验
将细胞培养所用试剂以及ThinCert细胞培养器均置于37 ℃条件下温浴;以正常细胞培养方法培养细胞至对数生长期,胰蛋白酶消化细胞,消化结束以PBS及无血清培养基分别洗涤1次,并用无血清培养基悬浮,使细胞悬液浓度约为2×105个/ml;于下室(24孔板底部)中加入700 μl含有10%胎牛血清的细胞培养基,上室中加入100 μl待检测细胞悬浮液,置于培养箱中培养24 h,擦除上室未发生侵袭的细胞,将发生侵袭的细胞利用1%结晶紫试剂染色,于倒置显微镜下记录实验结果并统计分析。
1.7 细胞凋亡检测
利用干净无菌10 ml离心管收集待检测细胞,每种细胞的数目约为(1-5)×106个/ml,于离心机中以600 r/min离心5 min,将培养液弃除;将收集的细胞利用孵育缓冲液洗涤1次,再次600 r/min离心5 min,弃除洗涤液;加入0.1 ml标记试剂并重悬细胞,室温避光孵育15 min,于离心机中600 r/min离心5 min,弃上清并用孵育缓冲液洗涤1次,加入Annexin/PI双染荧光试剂,置于4 ℃避光孵育20 min,每隔4 min震荡1次;利用流式细胞仪检测细胞凋亡,激发波长为488 nm,FITC荧光检测波长为515 nm,PI荧光检测波长大于560 nm,记录并统计检测结果。
1.8 结合位点预测
利用microRNA.org-Targets and Expression(http://34.236.212.39/microrna/microrna/getGeneForm.do)和Target Scan Human 7.1(http://www.targetscan.org/vert-71/)预测分析miR-128的靶向调控基因,并利用上述分析数据库预测miR-128与靶基因的结合位点。
1.9 双荧光素酶报告载体构建及活性检测
双荧光素酶报告载体为pmirGLO载体,将NOVA1与miR-128预测的3′-UTR靶点序列(NOVA1 WT 3′-UTR)或突变序列的3′-UTR(NOVA1 MT 3′-UTR)构建于上述载体。NOVA1 3′-UTR突变序列以正常序列为模板,对结合位点区域进行点突变。将构建的不同载体分别与NC miRNA、miR-128 mimic或miR-128 inhibitor共转染待检测细胞,转染试剂为DharmFECT Duo,以正常细胞培养条件培养48 h。培养结束后利用Dual-Glo luciferase系统检测细胞荧光素酶活性并记录实验结果。
1.10 蛋白质提取定量及Western blot检测
以方法1.2培养Caki-1或Caki-2细胞,培养结束收集细胞,利用RIPA裂解细胞,加入裂解液后混合均匀并置于冰上孵育20 min;随后于低温高速离心机中13 000 r/min离心20 min,取上清继续实验;利用BCA方法检测细胞总蛋白浓度。将待检测蛋白与加样缓冲液充分混匀并于100 ℃变性,利用SDS-PAGE分离目的蛋白;电泳结束后于转膜缓冲液中将目的蛋白电泳转移至PVDF膜上;将含目的蛋白的PVDF膜置于含5%脱脂奶粉的封闭液中,室温中处理1 h;将一抗NOVA1抗体稀释500倍后孵育含目的蛋白的PVDF膜,4 ℃条件中孵育过夜;弃去或收集一抗,TBST缓冲液洗涤3次;室温条件下,以终浓度为稀释5 000倍的IgG标记羊抗兔二抗孵育1 h;弃去二抗,TBST缓冲液洗涤3次,洗涤结束后加入ECL显影液,显影系统中显影拍照并记录实验数据,GAPDH作为内参。
1.11 统计学分析
本文所有统计数据均以平均值±标准差表示。数据结果统计软件为SPSS19.0。利用单因素方差分析(ANOVA)和Student’st检验统计并分析数据间差异。P<0.05为差异具有统计学意义。
2 结果
2.1 肾脏正常上皮细胞与ccRCC细胞中miR-128的表达差异
在多种肿瘤细胞中,miR-128表达异常,并参与肿瘤的发生发展过程,为了研究miR-128在ccRCC发生发展过程中的生物学功能,首先分析miR-128在ccRCC细胞系中的表达变化。结果显示,与肾脏正常上皮细胞HK-2组相比,miR-128在Caki-1和Caki-2细胞系中的表达水平显著下降(P<0.05,见图1)。
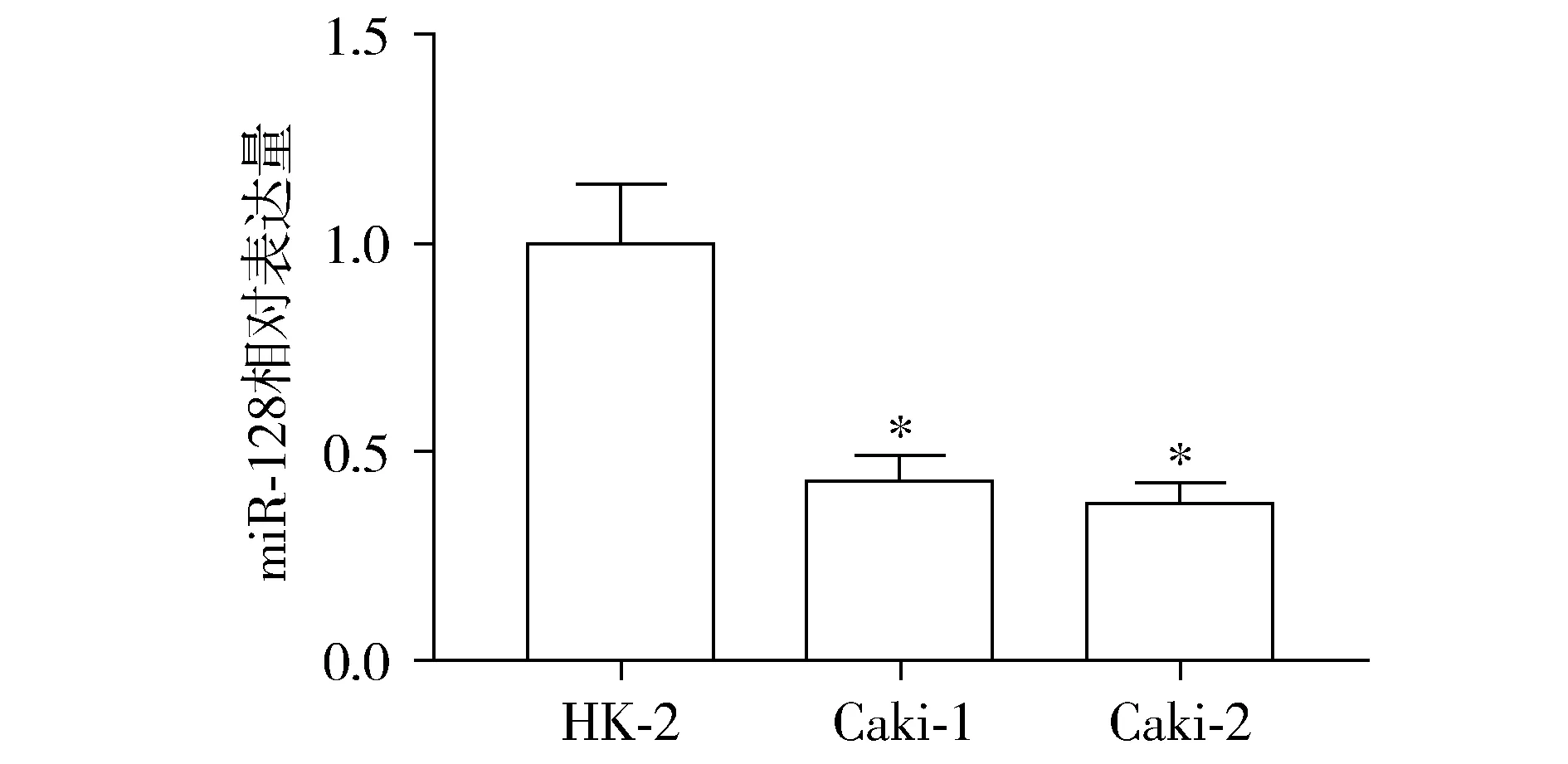
与HK-2细胞相比,*P<0.05图1 miR-128在ccRCC细胞中的相对表达Figure 1 Relative expression of miR-128 in ccRCC cells
2.2 miR-128对ccRCC细胞增殖和侵袭的影响
根据上述结果可知,miR-128在ccRCC细胞中表达异常,为了深入研究miR-128对ccRCC发生发展的影响,本研究将miRNA-NC、miR-128 mimic或miR-128 inhibitor分别转染Caki-1和Caki-2细胞,了解miR-128对ccRCC细胞增殖及侵袭的影响。首先利用RT-qPCR检测细胞转染后miR-128的表达水平,结果显示,与miRNA-NC转染组相比,miR-128 mimic转染组Caki-1和Caki-2细胞中miR-128相对表达水平都显著上调(P<0.01),miR-128 inhibitor转染组相对表达水平都显著下调(P<0.05,见图2A)。再利用MTT检测miR-128表达水平变化对细胞增殖的影响,结果显示,与miRNA-NC转染组相比,miR-128 mimic转染组Caki-1和Caki-2细胞增殖率都显著下降(P<0.05),miR-128 inhibitor转染组细胞增殖率都显著上升(P<0.01,见图2B)。利用Transwell实验检测miR-128表达水平变化对细胞侵袭的影响,结果显示,与miRNA-NC转染组相比,miR-128 mimic转染组每个视野中Caki-1和Caki-2细胞侵袭数量都显著下降(P<0.05),miR-128 inhibitor转染组细胞侵袭数量都显著上升(P<0.05,见图3)。
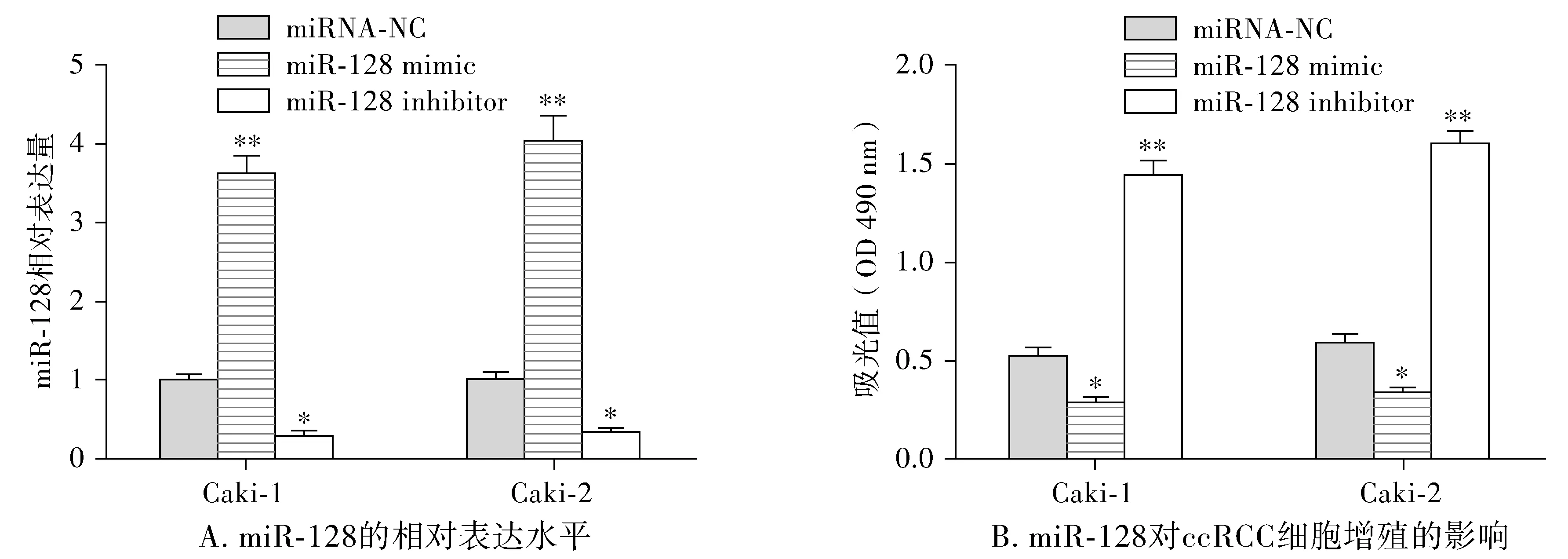
与miRNA-NC组相比,*P<0.05,**P<0.01图2 miR-128抑制ccRCC细胞增殖Figure 2 The miR-128 inhibited the proliferation of ccRCC cells
2.3 miR-128对ccRCC细胞凋亡的影响
在癌症发生发展过程中,细胞凋亡的变化也是一个非常重要的研究指标,当细胞正常凋亡发生紊乱时可引起细胞恶性增殖,促进癌症进程,因此本研究分析了miR-128对ccRCC细胞凋亡的影响。结果显示,与miRNA-NC转染组相比,miR-128 mimic转染组Caki-1和Caki-2细胞凋亡率都显著升高(P<0.01),miR-128 inhibitor转染组细胞凋亡率都显著下降(P<0.05,见图4)。
2.4 miR-128靶向调控NOVA1
在细胞中,miRNAs主要通过调控功能基因的表达水平影响细胞的生命过程,miRNAs为单链核苷酸并且一般不能编码蛋白,成熟的miRNAs一般与靶向调控基因的3′-末端非编码(UTR)区含有6-8互补核苷酸序列。因此本研究利用生物信息学预测分析成熟miR-128的潜在靶向调控基因及其调控结合位点,结果显示,在NOVA1 mRNA的3′-UTR区域含有6个连续核苷酸序列与成熟miR-128互补(见图5)。因此本研究构建了NOVA1基因3′-UTR野生型(WT-UTR)和3′-UTR突变(MT-UTR)荧光素酶报告载体,验证上述序列是否为miR-128的直接靶向调控位点,结果显示,在NOVA1 WT-UTR荧光素酶报告载体转染的细胞中,与miRNA-NC转染组相比,miR-128 mimic转染组细胞荧光素酶活性明显下降(P<0.05),而miR-128 inhibitor转染组细胞荧光素酶活性上升(P<0.05,见图6)。在NOVA1 MT-UTR荧光素酶报告载体转染的细胞中,与NC转染组相比,miR-128 mimic转染组细胞荧光素酶活性无显著性差异(P>0.05),miR-128 inhibitor转染组细胞荧光素酶活性也无显著性差异(P>0.05)。
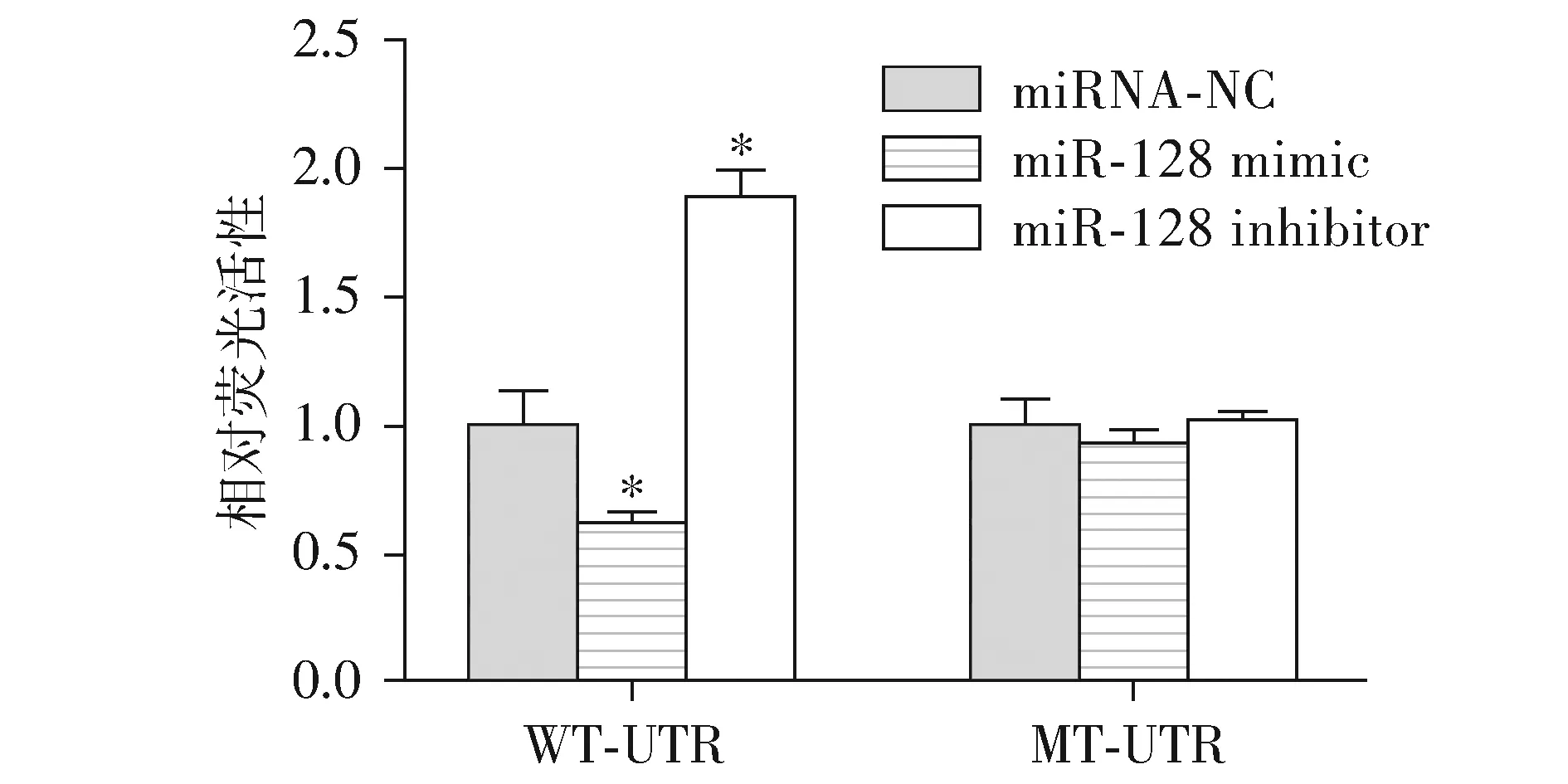
与miRNA-NC组相比,*P<0.05图6 miR-128抑制NOVA1活性Figure 6 The miR-128 inhibited the activity of NOVA1
2.5 miR-128对NOVA1表达的影响
根据2.3研究结果得出,NOVA1可能受miR-128的靶向表达调控,本研究利用RT-qPCR和Western blot验证上述研究结果。利用miRNA-NC、miR-128 mimic或miR-128 inhibitor分别转染Caki-1或Caki-2细胞,并检测两细胞系中NOVA1表达变化,结果显示,与miRNA-NC转染组相比,miR-128 mimic转染组细胞中NOVA1的mRNA(见图7)和蛋白表达水平(见图8)都显著下降(P<0.05),而miR-128 inhibitor转染组细胞中NOVA1的mRNA(见图7)和蛋白表达水平(见图8)都显著上升(P<0.01)。
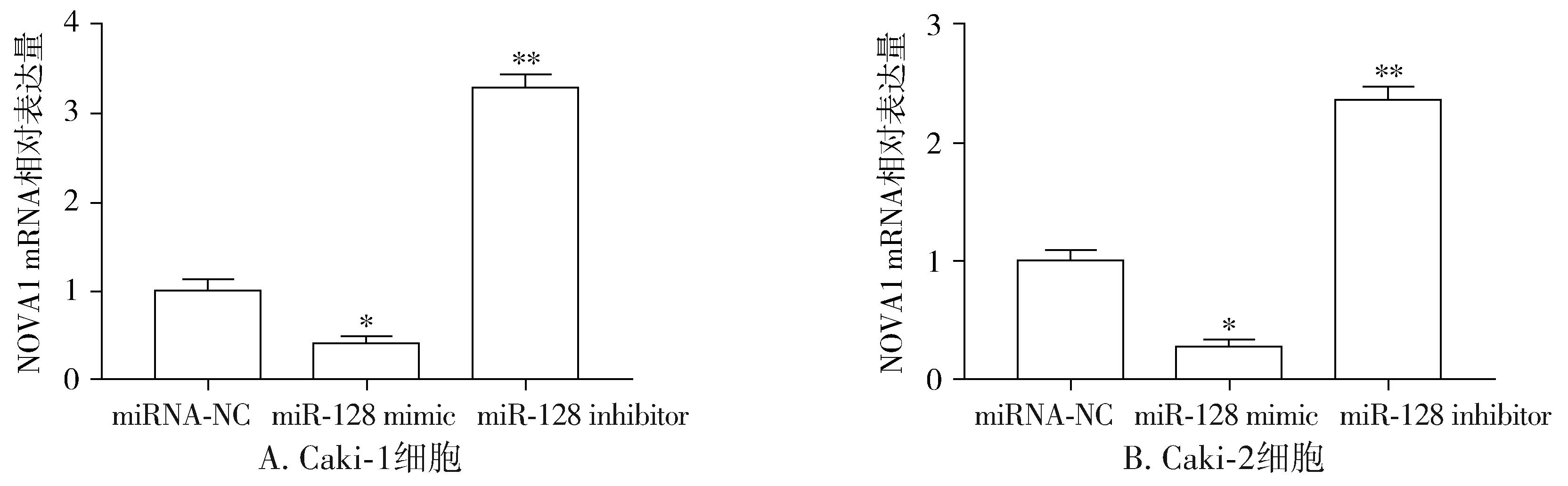
与miRNA-NC组相比,*P<0.05,**P<0.01图7 miR-128抑制NOVA1 mRNA的表达Figure 7 The miR-128 inhibited the mRNA expression of NOVA1
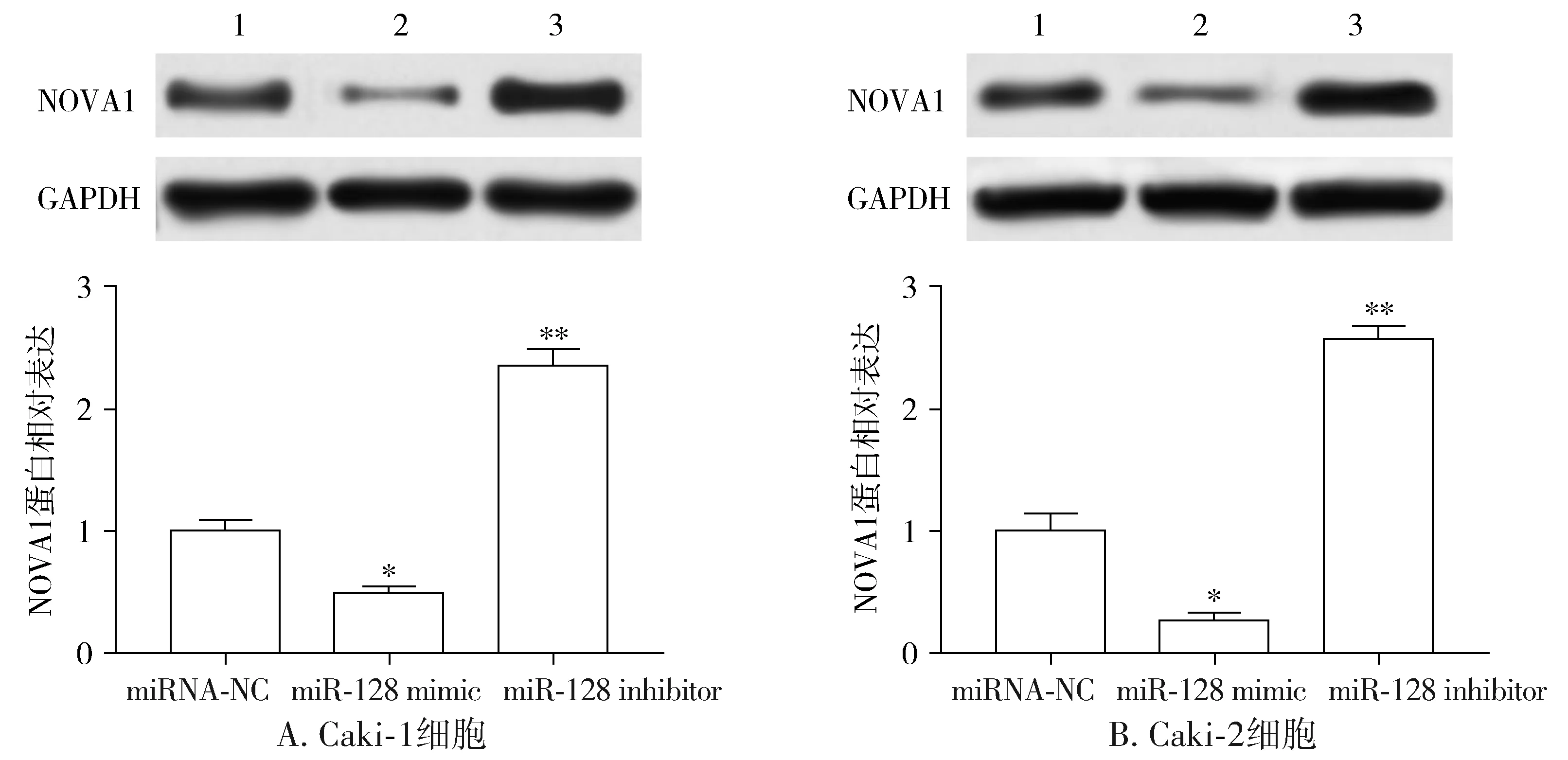
1.miRNA-NC;2.miR-128 mimic;3.miR-128 inhibitor;与miRNA-NC组相比,*P<0.05,**P<0.01图8 miR-128抑制NOVA1蛋白表达Figure 8 The miR-128 inhibited the protein expression of NOVA1
2.6 NOVA1对ccRCC细胞增殖和侵袭的影响
因miRNAs常通过调控功能基因的表达影响细胞的生命过程,上述的研究显示,NOVA1受miR-128表达调控,为了研究miR-128调控NOVA1对肾透明细胞癌的影响,随后研究了NOVA1对细胞增殖和侵袭的影响。采用pc-DNA3.1空载体(control)、pc-DNA3.1/NOVA1(NOVA1)、control siRNA或siNOVA1分别转染Caki-1和Caki-2细胞。首先检测NOVA1的表达水平,结果显示,与control转染组相比,pc-DNA3.1/NOVA1转染组Caki-1和Caki-2细胞中NOVA1表达水平都显著上升(P<0.01);与control siRNA转染组相比,siNOVA1转染组,Caki-1和Caki-2细胞中NOVA1表达水平都显著下降(P<0.05,见图9)。利用MTT实验检测NOVA1对细胞增殖的影响,结果显示,与control转染组相比,pc-DNA3.1/NOVA1转染组Caki-1和Caki-2细胞增殖率都显著上升(P<0.05);与control siRNA转染组相比,siNOVA1转染组Caki-1和Caki-2细胞增殖率都显著下降(P<0.05,见图10A)。利用Transwell实验检测NOVA1对细胞侵袭的影响,结果显示,与control转染组相比,pc-DNA3.1/NOVA1转染组Caki-1和Caki-2细胞侵袭能力都显著上升(P<0.05);与control siRNA转染组相比,siNOVA1转染Caki-1和Caki-2组细胞侵袭能力都显著下降(P<0.05,见图10B、C)。
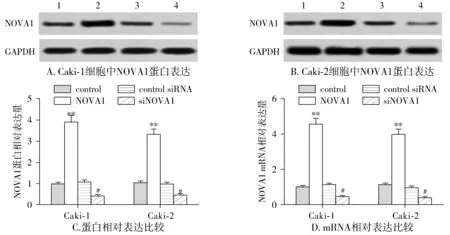
1.control;2.NOVA1;3.control siRNA;4.siNOVA1;与control组相比,**P<0.02;与control siRNA组相比,#P<0.05图9 NOVA1在ccRCC细胞中的表达Figure 9 The expression of NOVA1 in ccRCC cells
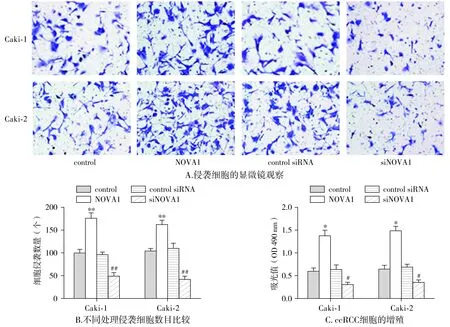
与control组相比,*P<0.05,**P<0.01;与control siRNA组相比,#P<0.05,##P<0.01图10 NOVA1调控ccRCC细胞增殖及侵袭Figure 10 NOVA1 regulated the proliferation and invasion of ccRCC cells
2.7 NOVA1对ccRCC细胞凋亡的影响
随后研究分析了NOVA1在ccRCC细胞凋亡过程中的作用,结果显示,与control转染组相比,pc-DNA3.1/NOVA1转染组NOVA1过表达时,Caki-1和Caki-2细胞系的凋亡率都显著下降(P<0.05);与control siRNA转染组相比,siNOVA1转染组NOVA1表达沉默时,Caki-1和Caki-2细胞系的凋亡率都显著上升(P<0.01,见图11)。
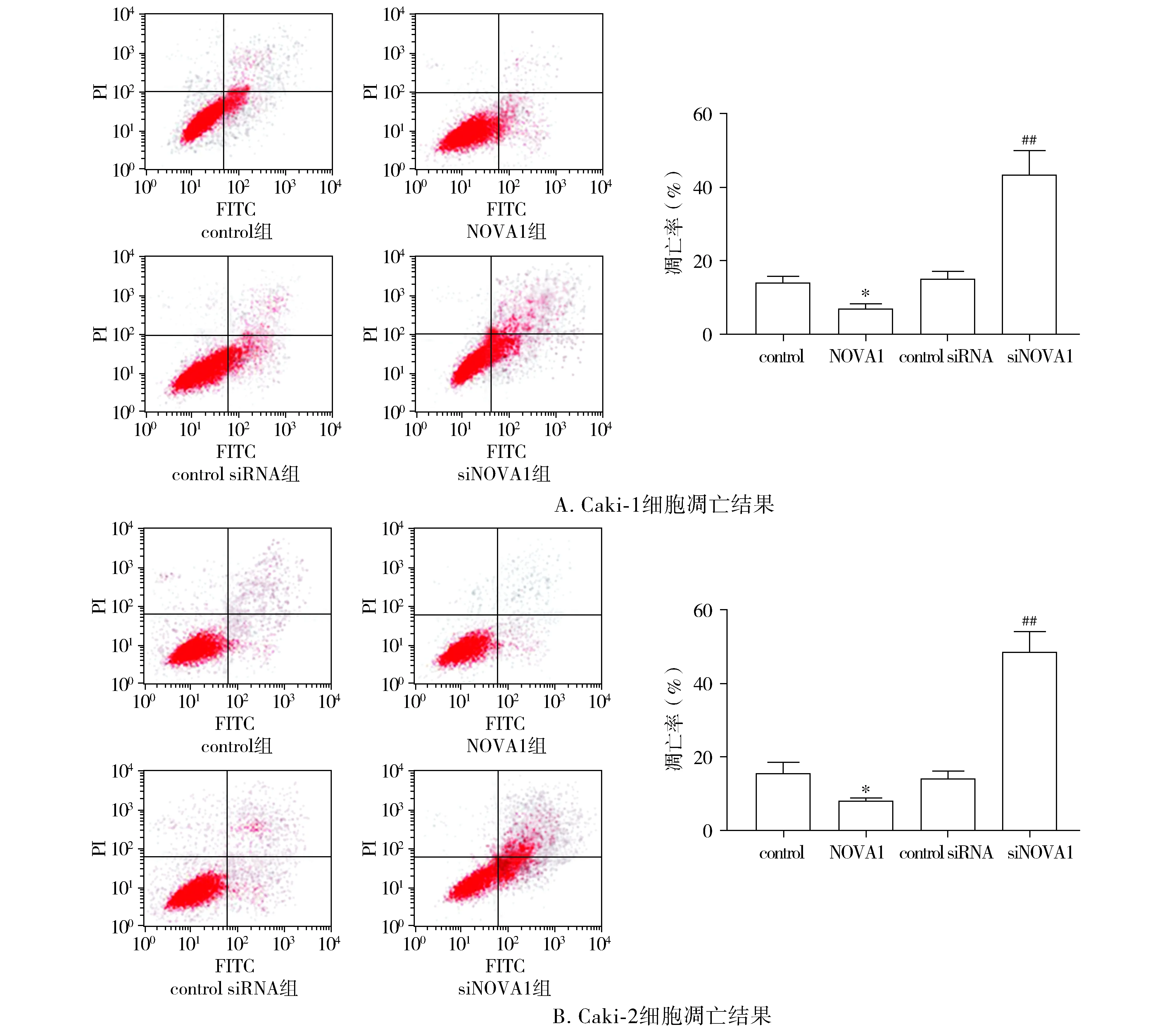
与control组相比,*P<0.05;与control siRNA组相比,##P<0.01图11 NOVA1调控ccRCC细胞凋亡Figure 11 NOVA1 regulated the apoptosis of ccRCC cells
3 讨论
在人类细胞中,miRNAs的种类非常多,在miRNAs序列5′末端含有特殊的核苷酸序列,约含6-8个核苷酸,其可与靶向调控基因mRNA的3′末端非编码区发生特异结合,对靶基因的表达进行调控。而miRNAs的合成过程可受某些功能基因的表达调控,并且在不同组织和细胞中,miRNAs序列高度保守,并且miRNAs表达具有组织特异性,成熟的miRNAs可调控与多种生命活动相关的信号途径[8],同时可能参与包括肿瘤在内的多种疾病的调控,影响肿瘤的发生发展过程,主要包括肿瘤细胞的增殖、迁移、侵袭和凋亡等[9-12]。近年来越来越多的研究显示,不同的miRNAs可调控同一种肿瘤的发生发展,相同的miRNA可能调控不同肿瘤的进程[13]。例如在膀胱癌细胞中,miR-221、miR-223和miR-26等表达水平显著上调[14];miR-345在结直肠癌[15]、肝癌[16]、乳腺癌[17]以及前列腺癌[18]等肿瘤细胞中表达异常,并调控上述肿瘤的发生发展。本研究显示miR-128在ccRCC细胞中显著下调,而目前尚未有miR-128影响ccRCC发生发展的报道。
目前已有研究显示,miR-128在其他多种肿瘤发生发展过程中发挥重要调控作用。Li等[19]报道显示miR-128在卵巢癌细胞中表达显著下调,并且可引起癌细胞顺铂耐药性明显增强,当miR-128在卵巢癌细胞系中过表达时,可增加细胞对顺铂药物的敏感性,表明调控卵巢癌细胞中miR-128的表达水平可能为治疗该疾病的潜在靶点。Sun等[20]研究显示miR-128在前列腺癌细胞系中的表达水平显著下调,并引起肿瘤细胞对顺铂药物的耐受性上升,当miR-128在上述细胞系中过表达时可增强肿瘤细胞对顺铂药物的敏感性,同时肿瘤细胞的侵袭能力也明显被抑制;在前列腺癌细胞系中miR-128可靶向抑制ZEB1的表达,当ZEB1表达沉默时可弱化miR-128表达下调引起的前列腺癌细胞对顺铂药物的耐受性及侵袭能力的上升。Zhao等[21]研究显示miR-128-3p在食管鳞状细胞癌组织和细胞中的表达显著下调,并与患者较差的预后相关,其研究显示miR-128-3p可抑制癌细胞的迁移和侵袭,根据双荧光素酶报告实验发现miR-128-3p可靶向抑制ZEB1的表达,并且通过调控ZEB1抑制上皮细胞间质转型和代谢。Koh等[22]报道显示在肺癌干细胞中miR-128表达水平显著下调,而BMI-1和MUC1-C表达水平异常上调;当miR-128在肺癌干细胞系中过表达时BMI-1和MUC1-C表达水平显著下调,双荧光素酶报告实验显示miR-128可抑制MUC1荧光素酶活性,miR-128过表达可显著抑制癌细胞的增殖、新陈代谢活性、自我更新、迁移、侵袭和集落形成,并且可明显促进癌细胞的凋亡。本研究显示miR-128在ccRCC细胞中的表达水平异常下调,当ccRCC细胞中miR-128过表达时可抑制细胞的增殖和侵袭,并促进细胞凋亡;而ccRCC细胞中miR-128表达沉默时细胞增殖和侵袭能力显著上升,细胞凋亡率明显下降。
在细胞中,miRNAs一般通过调控功能基因的表达影响细胞的生命活动。在肿瘤细胞中,miRNAs通常调控与肿瘤发生发展相关基因的表达促进肿瘤进程。如miR-150通过调控MYB表达影响乳腺癌或结直肠癌的进程[23],miR-339-5p通过靶向调控MDM2表达影响肾癌和结直肠癌的发生发展[24]。本研究中,生物信息学分析和双荧光素酶报告实验显示,miR-128与NOVA1 3′-UTR具有特异性结合位点,miR-128可抑制NOVA1活性,通过RT-qPCR和Western blot验证显示,miR-128可抑制ccRCC细胞中NOVA1的表达水平。
NOVA1为一种具有特异性序列的RNA结合蛋白,该蛋白有3个KH型结构域可与RNA结合,NOVA1与RNA结合的特殊位点中含有YCAY(Y为嘧啶)重复序列。近年来多项研究显示NOVA1参与调控肿瘤的发生发展过程,而尚未有报道NOVA1在ccRCC发生发展中的作用。Zhang等[25]研究显示NOVA1在原发性肝癌中发挥致癌作用,当NOVA1表达上调时可促进裸鼠原发性癌进程,免疫共沉淀实验显示NOVA1与GABAARγ2相互作用。Yoon等[26]研究显示NOVA1在胃癌组织中表达显著下调,低表达水平的NOVA1与胃癌患者预后较差有密切联系,并且在胃癌细胞系中NOVA1的表达水平也显著下调,其表达受miR-146b-5p靶向调控。Shen等[27]报道显示miR-339在人胃癌细胞中调控NOVA1表达影响胃癌进程,miR-339可抑制胃癌的增殖和侵袭,而NOVA1表达上调时可逆转miR-339过表达对胃癌细胞增殖和侵袭的抑制作用。Zhi等[28]研究显示NOVA1在星形细胞瘤中受miR-181b-5p表达调控,在该肿瘤细胞中NOVA1表达水平显著上升,并促进细胞增殖和侵袭,抑制细胞凋亡;当miR-181b-5p在星形细胞瘤中过表达时NOVA1表达显著下调,细胞增殖和侵袭受抑制,细胞凋亡率明显上升。而本研究显示NOVA1在ccRCC细胞系中过表达时,细胞增殖和侵袭能力显著上升,细胞凋亡率显著下降;而NOVA1在ccRCC细胞系中表达沉默时,细胞增殖和侵袭能力被抑制,并且肿瘤细胞凋亡率明显上升。此外,本研究显示miR-128与NOVA1具有靶向结合位点,通过双荧光素酶报告分析表明miR-128可靶向调控NOVA1在肾透明细胞癌中的表达,miR-128过表达可显著抑制NOVA1表达,miR-128表达水平下降时,NOVA1在上述细胞中的表达水平显著上升,NOVA1表达水平的变化可显著调控肾透明细胞癌的增殖、侵袭和细胞凋亡。
综上,miR-128可通过靶向调控NOVA1的表达抑制ccRCC细胞的增殖和侵袭,并促进肿瘤细胞的凋亡。本研究显示,miR-128表达下调时可解除对NOVA1表达的抑制作用,从而促进ccRCC细胞的增殖和侵袭,并抑制细胞的凋亡。本文研究结果为ccRCC的分子机制研究提供理论基础,也为ccRCC的治疗研究提供潜在治疗靶点。
