利用CRISPR-Cas9基因编辑技术制备牛MSTN基因编辑胚胎
2019-03-06,,,,,,,,,
,,,,,,,,,
(1.河南省农业科学院 畜牧兽医研究所/河南省畜禽繁育与营养调控重点实验室,河南 郑州 450002; 2.河南农业大学 牧医工程学院,河南 郑州 450002; 3.郑州外国语学校,河南 郑州 450001)
双肌性状是指由于肌肉中肌纤维增多、全身肌肉总量显著增加而形成的一种表型。动物的双肌性状最先在牛中被发现。牛双肌性状的最显著特征是肌纤维的普遍肥大,可引起牛的肌肉质量平均增加25%。除此之外,牛双肌性状的优良性还表现在肌内脂肪下降约50%,肌肉的结缔组织成分下降20%~30%,并且饲料消耗比下降约9%。由于双肌性状具有显著的肉用优势,所以一直是优质肉用家畜培育的一个研究热点[1]。相关研究表明,肌肉生长抑制素(Myostatin,MSTN)的基因功能异常是导致动物具有双肌性状的遗传基础[2-3]。MSTN是骨骼肌有效的负调控因子,研究表明,MSTN基因敲除小鼠具有由肌纤维增生和肥大引起的肌肉质量显著增加的双肌效应,而MSTN基因过表达小鼠则表现为极度消瘦[2,4]。目前,在牛的MSTN基因上共发现6个自然发生的功能缺陷型突变,其中nt821(del11)是在MSTN基因的编码区缺失了第818—828位核苷酸,从而引起了MSTN蛋白失活,这是比利时蓝牛的双肌遗传基础;p.C313Y是在MSTN基因编码区第938位核苷酸发生了G到A的突变,从而引起了第313位氨基酸由半胱氨酸(C)转变为酪氨酸(Y),最终导致蛋白质失活,这是皮埃蒙特牛的双肌遗传基础[2,5]。
基因编辑技术是近年来发展起来的可以对基因组实现精确修饰的生物技术,用于在基因组水平对基因进行定点突变、插入、删除等工作。其中CRISPR-Cas9基因编辑技术仅需要合成1条gRNA就可以实现对基因组靶位点的识别,进而实现对基因组的定点编辑。由于其简洁高效的特性,CRISPR-Cas9技术也被称为“基因魔剪”[6-7]。目前,包括小鼠、猪、羊等在内的多种动物,均已通过CRISPR-Cas9技术获得了基因编辑个体,进一步证明了该技术在制备基因编辑动物上的普适性和高效性[8-11]。为了利用基因编辑技术的优势特性以及基因工程的手段来创造新的双肌性状肉用家畜品种,本研究利用CRISPR-Cas9基因编辑技术制备牛MSTN基因编辑胚胎,旨在为未来肉牛育种提供新的遗传素材。
1 材料和方法
1.1 试验材料与试剂
1.1.1 供试牛卵巢样品及胚胎培养主要试剂 供试牛卵巢共86对,均采集自郑州市弓马庄牛屠宰车间。TCM-199培养液、添加氨基酸的合成输卵管液(SOFaa)、牛体外培养(Bo-IVC)液、体外成熟(IVM)基础液、IVM液、体外受精(IVF)洗精液、IVF液配制参照文献[11-13]。
1.1.2 阳性囊胚鉴定主要试剂 PCR试剂盒(生工生物,上海)、PCR产物纯化试剂盒(天根,北京)、T7EI内切酶(NEB,北京)等。
1.2 试验仪器
1.2.1 牛胚胎培养主要仪器 二氧化碳培养箱(Thermo,H240i)、台式低速离心机(北京医学仪器厂,800型)、体视镜(Nikon,C-DS)、倒置显微镜(ZEISS,AXIOI)等。
1.2.2 显微注射主要仪器 拉针仪(WPI,PUL-1)、断针仪(NARISHIGE,MF-900)、显微注射系统(Eppendorf,TransferMan NK 2)等。
1.3 牛卵母细胞的体外受精与受精卵的体外培养
1.3.1 牛卵母细胞的收集 共开展4次有效的牛胚胎体外培养试验,将收集到的牛卵巢放入37 ℃、含有青链霉素的生理盐水中,于4~6 h内带回进行后续试验。首先,用预热的生理盐水将收集的牛卵巢冲洗3次,去除杂质和血水,并用剪刀剔除卵巢表面的脂肪块、结缔组织和输卵管等,再用生理盐水将修剪后的卵巢清洗1次,将处理后的牛卵巢放于加入生理盐水(含双抗)的烧杯中,置于37 ℃恒温台上备用。然后,用10 mL注射器(带有8号针头)对卵巢表面直径2~8 mm大小的卵泡内容物进行抽吸,将卵泡液移至60 mm培养皿中,体视显微镜下用口吸管收集卵丘-卵母细胞复合体(Cumulus oocyte complex,COC)。
1.3.2 牛卵母细胞的体外成熟 将挑选出来的COC在IVM基础液(预先平衡2 h)中清洗3遍,在IVM液中清洗2遍,将洗净的COC移入IVM液微滴并置于成熟盘中。然后将成熟盘置于38.5 ℃、5%CO2、100%湿度的CO2培养箱中培养22~24 h,观察牛卵母细胞成熟情况。
1.3.3 牛卵母细胞的体外受精 从液氮罐中取出冻精,放入38 ℃温水中解冻5 s。将解冻后的精液于1 500 r/min离心5 min后,洗涤2次,弃除上清,向离心管中加入1.5 mL受精液,调整精子密度为5×106个/mL。将成熟后的卵母细胞和精子放入IVF液中,精卵共孵育8 h后完成体外受精。
1.3.4 牛受精卵在Bo-IVC液中的体外培养 精卵共孵育8 h后,用Bo-IVC液清洗3次,洗净受精卵外围精子及杂质后移入Bo-IVC液中,统计24 h卵裂率、144 h桑胚率及168 h囊胚率。
1.4 靶向牛MSTN基因gRNA的设计
1.4.1 靶向牛MSTN基因gRNA序列的设计 根据NCBI上牛的MSTN基因序列(登录号:NM_001001525),利用在线软件(http://crispr.mit.edu/)共设计了4条gRNA(表1)。

表1 靶向牛MSTN基因的gRNA序列
注:表中划线部分为gRNA的前间隔序列邻近基序(PAM)。
Note:The underlined part of the table is the protospacer adjacent motif (PAM) of the gRNAs.
1.4.2 gRNA的体外合成与体外切割活性验证 将设计好的gRNA委托北京唯尚立德生物科技有限公司(http://www.v-solid.com/)进行体外合成及体外切割活性验证。
1.5 显微注射
将Cas9 mRNA和验证后体外切割活性最高的gRNA进行稀释后混合,使混合液中Cas9 mRNA最终的质量浓度为50 ng/μL,gRNA最终的质量浓度为25 ng/μL。将混合液装入注射针中后,使用显微注射系统,对受精卵进行逐个注射,受精卵膨胀至原来的1.25倍时立即停止注射,注射后的受精卵置于Bo-IVC液中继续培养168 h,然后统计囊胚率。
1.6 囊胚样品中MSTN基因编辑效率的检测
1.6.1 囊胚收获 将显微注射后的受精卵置于CO2培养箱中继续培养,待受精卵发育至囊胚时,将囊胚置于酸性台式液中去除透明带,然后将去除透明带的囊胚在TCM-199培养液中反复清洗3次,以去除酸性台式液。
1.6.2 体外切割活性最高gRNA切割靶位点的巢式PCR扩增 首先根据巢式PCR试剂盒操作说明准备外侧扩增体系,最后将去除透明带的囊胚直接加入PCR扩增体系中作为扩增模板进行扩增。引物序列为MSTNg5BT-osF:5′-ACCCAAATGTTGCTTCTTT-3′,MSTNg5BT-osR:5′-TCCTTCTTCTCCTGGTTCT-3′,预期扩增产物长度为343 bp。外侧扩增结束后,以外侧扩增产物为模板,进行内测扩增,引物序列为MSTNg5BT-isF:5′-AAAGGCCCAACTGTGGATA-3′,MSTNg5BT-isR:5′-CAATGCTCTGCCAAATACC-3′,预期最终扩增产物长度为164 bp。
1.6.3 T7EI核酸内切酶检测 使用PCR产物纯化试剂盒纯化扩增产物,然后将纯化后的PCR产物两两混合,得到用于T7EI核酸内切酶检测的样品,将混合好的样品进行退火后,使用T7E1核酸内切酶来鉴定样品中发生突变的情况。酶切体系为15.0 μL:退火后的产物10.0 μL,10×Buffer2 1.5 μL,T7EI核酸内切酶1.0 μL,用超纯水补至15.0 μL。将其置于37 ℃温育1 h,然后利用琼脂糖凝胶电泳检测酶切产物。若PCR样品中发生了基因编辑,则相邻的2个混合样品都会出现酶切条带。
1.6.4 测序验证 将T7EI核酸内切酶检测鉴定为阳性的PCR扩增纯化产物,再次进行PCR扩增后,送至生工生物工程有限公司(上海)进行测序验证。
2 结果与分析
2.1 牛胚胎的体外培养
如表2所示,成熟的卵母细胞在体外受精后,平均卵裂率为61.18%;进一步在体外培养受精卵,统计得其平均桑胚率为24.91%,平均囊胚率为21.28%。如图1所示,体外培养的牛COC胞质均匀且外围颗粒细胞包裹均匀紧密,获得的囊胚内细胞团和滋养层界限清晰,囊胚腔明显,细胞团体积充满透明带内腔,表明成功实现了牛卵母细胞体外受精和体外培养。

表2 牛胚胎体外培养情况
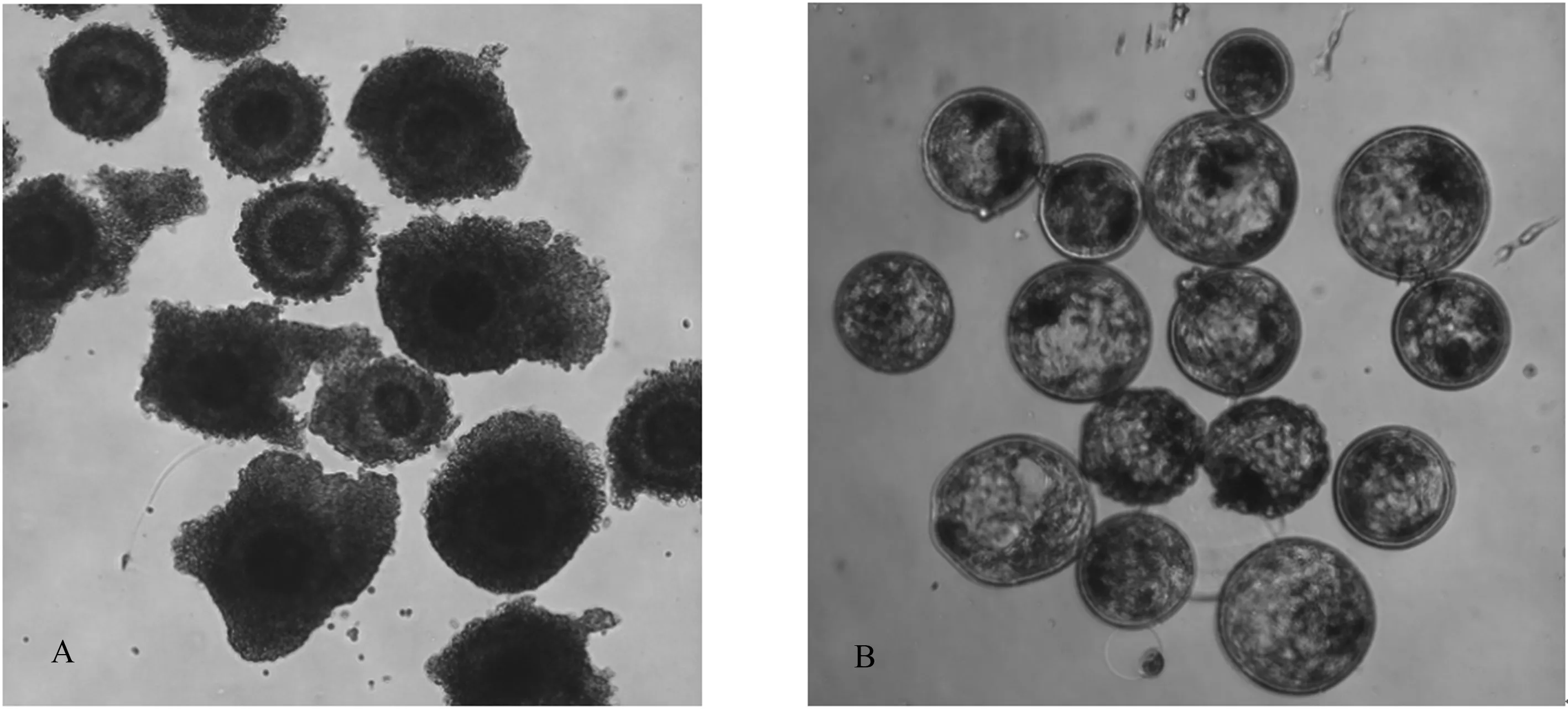
A:体外培养的牛COC;B:体外培养168 h后获得的牛囊胚
2.2 牛MSTN基因的gRNA序列与切割活性验证结果
由图2所示,对设计的4条牛MSTN基因gRNA进行切割活性验证,结果表明,gRNA5、gRNA6、gRNA7、gRNA9的体外切割活性分别为96.00%、60.00%、93.00%、90.00%,其中,gRNA5的活性最高,可以用于进一步的胚胎验证。
2.3 囊胚样品中MSTN基因的编辑效率检测结果
将获得的330枚形态质量较好的受精卵进行显微注射,共注射成功282枚,在体外培养中共有163枚发生卵裂,最终获得40枚囊胚。在最终获得的40枚囊胚中,随机选取13枚用于MSTN基因编辑效率的检测。由图3所示,利用巢式PCR扩增MSTN基因gRNA5切割靶位点的DNA片段,经琼脂糖凝胶电泳检测,结果表明,扩增产物长度为164 bp,与预期相符合。将所得13枚囊胚样品的PCR扩增产物两两混合进行T7EI内切酶检测,结果表明,13个混合样品中,有3个相邻的样品能够检测到酶切条带,说明有2个PCR产物发生了基因编辑,基因编辑阳性率为15.40%(图4)。将T7EI酶切检测出的发生了基因编辑的PCR产物进行测序验证,结果表明,在gRNA5靶点的下游出现了双峰,说明在gRNA5靶点位置存在片段缺失从而造成了移码突变(图5)。结果表明,成功获得了牛MSTN基因编辑胚胎。

1—4:靶向牛MSTN基因的gRNA5、gRNA6、gRNA7、gRNA9处理;5:标准阳性对照1(代表30%的切割活性);6:标准阳性对照2(代表90%的切割活性);7:标准阴性对照1(不添加gRNA);8:标准阴性对照2(不添加gRNA和Cas9);M:DL2000 DNA Marker
1—4:Treating by gRNA5,gRNA6,gRNA7,gRNA9 targeting bovineMSTNgene;5:The positive control 1 (represents 30% of cleavage activity);6:The positive control 2 (represents 90% cleavage activity);7:The negative control 1 (without gRNA);8:The negative control 2 (without gRNA and Cas9);M:DL2000 DNA Marker
图24条靶向牛MSTN基因的gRNA的体外切割活性验证
Fig.2Cleavageactivitydetectionof4gRNAstargetingbovineMSTNgene
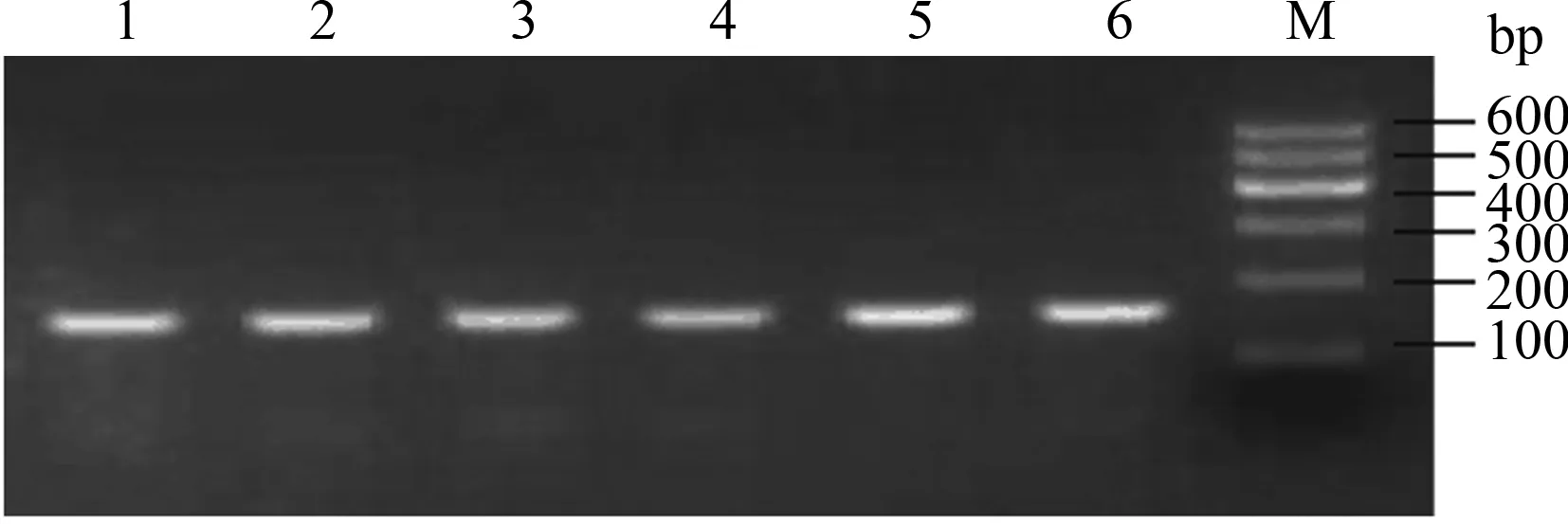
1—6:抽检的6个巢式PCR扩增产物;M:DL600 DNA Marker1—6:6 nested PCR amplification products sampled;M:DL600 DNA Marker图3 gRNA5切割靶位点的巢式PCR扩增结果Fig.3 Nest PCR amplification results for the gRNA5 targeting site

图4 13枚囊胚样品中MSTN基因编辑效率的T7EI酶切检测结果
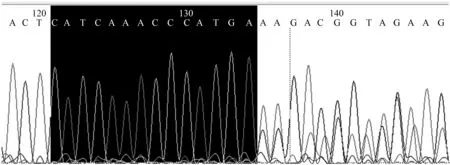
图5 gRNA5在牛MSTN基因上识别靶点的测序验证
3 结论与讨论
目前,牛胚胎体外生产技术的成功率已经大幅度提高,平均的囊胚率可达30%左右,但仍然存在着总体效率低、体系不稳定等问题。本研究中,牛胚胎体外培养的平均卵裂率为61.18%,平均桑胚率为24.91%,平均囊胚率为21.28%,低于国内目前的平均水平。分析原因可能是试验次数较少,许多试验环节还需要进一步的优化。王艳萍等[14]研究表明,添加10%的牛卵泡液对于牛卵母细胞的成熟具有显著的提高作用,而本研究前期分析了牛卵泡液对颗粒细胞培养的影响发现,添加10%的牛卵泡液能够显著改善颗粒细胞的生长速度和生长状态(未展示的结果)。除此之外,在牛胚胎体外培养过程中,胚胎细胞内容易形成活性氧基团,活性氧可以损害胚胎的体外发育。有研究表明,低氧环境组(5% O2)的囊胚发育率显著高于高氧环境组(20% O2)[15]。由于本研究受试条件的限制,尚未尝试使用低氧环境来培养胚胎。鉴于氧化应激对胚胎培养的损伤作用,添加适量的抗氧化应激物质,例如谷胱甘肽、吡格列酮和褪黑激素等[16-18],也被证明能显著提高牛胚胎体外培养的效果。因此,在未来的研究中,考虑组合添加营养物质和抗氧化应激物质,配合改善氧气浓度,以期能够进一步提高胚胎的体外发育效率。
CRISPR-Cas9系统被认为是目前最高效的基因编辑技术,但筛选1条能够在体内高效切割靶位点的gRNA是提高基因编辑效率的关键[19]。在不同的研究中,针对不同的基因和不同的位点,所获得的切割效率也各不相同。例如,利用CRISPR-Cas9系统定点突变猪MSTN基因的研究中,获得的突变效率为38%,在人类293T细胞中突变AAVS1的效率为10%~25%[20]。虽然本研究中gRNA5在体外切割验证时活性很高,可达到96.00%,但在牛胚胎中的基因编辑阳性率仅为15.40%,低于在猪上的类似研究。分析原因可能是RNA在注射时部分降解、显微注射的RNA质量浓度或注射量需要进一步优化、供试动物体内外环境存在差异。在未来的研究中将优化试验各步条件,以进一步提高gRNA在胚胎中的切割效率,从而提高MSTN基因编辑的效率。
胚胎移植是指将体内、体外生产的哺乳动物早期胚胎移植到同种生理状态相同的雌性动物体内,使之继续发育成正常个体的生物技术。胚胎移植技术在提高优秀母畜的繁殖力、加快遗传进展、增加双胎率、克服母畜不孕症、降低引种费用以及减少疾病传播等方面均具有重要价值。我国牛的胚胎移植技术目前比较成熟,冻胚的移植妊娠率为40%~50%。将本研究所得的MSTN基因编辑胚胎27枚进行冻存储备,按照所得15.40%的阳性率,其中约包含4枚MSTN基因编辑胚胎,在未来有开展胚胎移植的合适条件下,预期能够生产1~2头MSTN基因编辑的“双肌臀”牛。
本研究开展了牛卵母细胞体外受精和体外培养,结果表明,牛胚胎体外培养的平均卵裂率为61.18%,平均桑胚率为24.91%,平均囊胚率为21.28%。同时,本研究获得多条能够在体外高效编辑牛MSTN基因的gRNA序列,其中gRNA5的体外切割活性为96.00%。使用Cas9 mRNA和gRNA5显微注射330枚牛受精卵后获得40枚囊胚,检测其中的13枚囊胚发现,有2枚中存在突变,基因编辑阳性率为15.40%。将阳性个体进行测序验证表明,发生突变的阳性样品在gRNA5靶位点存在片段缺失,从而造成了移码突变。综上,说明本研究利用CRISPR-Cas9基因编辑技术成功获得了牛MSTN基因编辑胚胎,为我国未来的肉牛种质创新提供了素材,对我国的肉牛产业发展具有重要的意义。
