3种常用杀虫剂对不同植物上南方小花蝽的毒力测定
2019-03-06,,,,,2
,, ,,,2
(1.云南农业大学 植物保护学院/云南生物资源保护与利用国家重点实验室,云南 昆明 650201; 2.农业部华南作物有害生物综合治理重点实验室,广东 广州 510642)
南方小花蝽(Oriussimilis)是隶属于半翅目(Hemiptera)花蝽科(Anthocoridae)小花蝽属(Orius)的捕食性天敌昆虫,广泛分布于我国的中南部省区,是农田中小型害虫的重要天敌昆虫[1-2]。南方小花蝽发生时间久,取食时活动能力强,在防治小型害虫上具有很重要的控制作用[3]。蓟马是缨翅目(Tysanoptera)昆虫的统称,在世界范围内已统计的蓟马种类有6 000多种[4]。体型小,通常隐藏在植物花朵、心叶等部位,繁殖能力强,雌成虫可进行孤雌生殖,所以世代重叠严重,其能直接危害各种经济作物并且间接传播病毒,造成严重的经济损失[5]。其中,西花蓟马(Frankliniellaoccidentalis)是缨翅目(Thysanoptera)锯尾亚目(Terebrantia)蓟马科(Thripidae)花蓟马属(Frankliniella)的重要入侵害虫,目前为止在云南、浙江、北京等10多个省市区造成严重危害[6-7]。
国内对南方小花蝽的研究晚于国外,从2000年后西花蓟马传入我国才开始有关于小花蝽防治蓟马方面的研究[8],但主要集中在东亚小花蝽和南方小花蝽对西花蓟马的捕食功能和控害能力方面[9-10]。国外很早已经将南方小花蝽商品化,而且利用南方小花蝽良好地控制了蓟马危害并建立了相对成熟的技术体系,但由于技术保护等原因未得到广泛推广[11-12]。
通过调查发现,南方小花蝽是世界范围内蓟马类害虫的重要天敌之一,而西花蓟马是云南地区蓟马类害虫的优势种[8,13],南方小花蝽对西花蓟马等重要入侵蓟马种类具有较强的捕食能力和潜在的利用价值[14-15]。由于杀虫剂的广泛使用以及西花蓟马繁殖快、世代更迭迅速等特点,西花蓟马对多种类型的杀虫剂产生了不同程度的抗药性,这在一定程度上加快了西花蓟马在世界上的扩散速度[16],并且使环境遭到了严重的污染[17-18]。南方小花蝽作为西花蓟马等蓟马类重要的捕食性天敌,在生物防治方面具有重要的意义。SCHUSTER等[19]发现,猎物比天敌抗药性更强,杀虫剂的作用下天敌的死亡率显著高于猎物,所以在高浓度杀虫剂使用环境下,南方小花蝽对蓟马的生物防治效果受到很大影响。为了探明杀虫剂对南方小花蝽的影响,并明确其对西花蓟马等蓟马类重要寄主植物上南方小花蝽的毒力变化情况,选取了防治蓟马类害虫常用的3种杀虫剂——吡虫啉、阿维菌素和高效氟氯氰菊酯,测定其对3种植物上南方小花蝽的毒力,明确南方小花蝽对3种常见杀虫剂的抗性,以及这3种杀虫剂对南方小花蝽的相对安全浓度区间,为杀虫剂大量使用背景下南方小花蝽的保护和利用提供参考。
1 材料和方法
1.1 供试昆虫
南方小花蝽和西花蓟马均采自云南省昆明市云南农业大学后山农场的木香(Rosabanksiae)、辣椒(Capsicumannuum)以及锦绣杜鹃(Rhododendronpulchrum)植株。
1.2 供试药剂
包括70%吡虫啉水分散粒剂(江苏克胜集团股份有限公司)、5%阿维菌素乳油(深圳市诚兴利科技有限公司)、10%高效氟氯氰菊酯乳油(江苏邦盛生物科技有限公司)。
1.3 杀虫剂对南方小花蝽的毒力测定方法
采用触杀方式测定杀虫剂对南方小花蝽的毒力。将3种杀虫剂稀释为20 mg/L,对南方小花蝽进行预试验,得到的结果作为设置浓度梯度的依据。根据预试验所得结果,以30 mg/L为杀虫剂最高质量浓度,梯度稀释6~8个不同的质量浓度,以清水作为试验对照,每个质量浓度均设置3个重复。试验装置分为2个容器,第一容器顶部和底部有开口,顶部开口有带纱网的盖子,底部开口有纱网;第二容器为仅上部开口的器皿,可以完全容纳第一容器。将配制好的不同质量浓度梯度的杀虫剂分别倒入第二容器内,可以使第一容器完全被淹没;将南方小花蝽以每次10~20头数量接入第一容器内并盖好盖子;将第一容器完全浸泡在含不同质量浓度杀虫剂的第二容器内5 s,控干药液,并用吸水纸吸取残留药液;将装有南方小花蝽的第一容器放在人工气候箱中饲养。人工气候箱(上海三腾仪器公司)条件设置如下:温度为(25±1)℃,相对湿度为(70±5)%,光周期为L∶D = 16∶8。在24 h后观察记录各个质量浓度杀虫剂处理下的南方小花蝽成虫、若虫存活情况,观察时用细毛笔轻触碰虫体,2次不动则记录为南方小花蝽死亡[16,20]。
1.4 数据处理
采用SPSS 22.0进行数据处理分析,获得毒力回归方程和致死中质量浓度(LC50)。
2 结果与分析
2.1 3种植物上南方小花蝽不同虫态对吡虫啉的敏感度
从表1可见,对于南方小花蝽成虫而言,木香上种群对吡虫啉敏感度最高,24 h LC50值为8.024 mg/L;其次为锦绣杜鹃种群,24 h LC50值为8.900 mg/L,其对吡虫啉的抗性倍数是木香种群的1.109倍;辣椒上种群对吡虫啉敏感度最低,24 h LC50值为20.183 mg/L,其对吡虫啉的抗性倍数是木香种群的2.515倍。
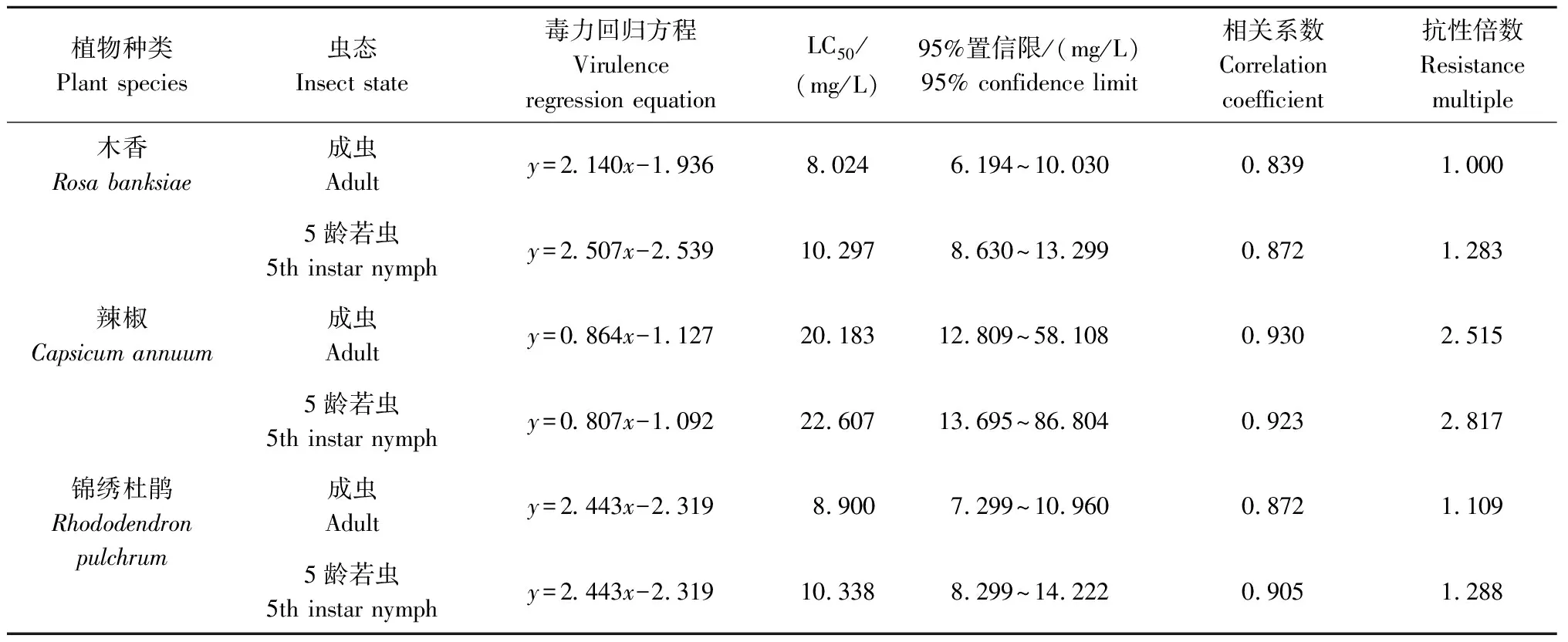
表1 3种植物上不同虫态的南方小花蝽对吡虫啉的敏感度Tab.1 Sensitivity of Orius similis in different insect states to imidacloprid on three plants
对于南方小花蝽5龄若虫而言,木香上种群对吡虫啉敏感度最高,24 h LC50值为10.297 mg/L;其次为锦绣杜鹃种群,24 h LC50值为10.338 mg/L,其对吡虫啉的抗性倍数是木香种群的1.004倍;辣椒上种群对吡虫啉的敏感度最低,24 h LC50值为22.607 mg/L,其对吡虫啉的抗性倍数是木香种群的2.196倍。
南方小花蝽成虫和5龄若虫相比较,若虫对吡虫啉的敏感度均低于成虫。木香上5龄若虫的抗性倍数是成虫的1.283倍,锦绣杜鹃上5龄若虫的抗性倍数是成虫的1.162倍,辣椒上5龄若虫的抗性倍数是成虫的1.120倍。
2.2 3种植物上南方小花蝽不同虫态对高效氟氯氰菊酯的敏感度
从表2可见,对于南方小花蝽成虫而言,木香上种群对高效氟氯氰菊酯的敏感度最高,24 h LC50值为0.577 mg/L;其次为锦绣杜鹃种群,24 h LC50值为0.610 mg/L,其对高效氟氯氰菊酯的抗性倍数是木香种群的1.057倍;辣椒上种群对高效氟氯氰菊酯的敏感度最低,24 h LC50值为0.659 mg/L,其对高效氟氯氰菊酯的抗性倍数是木香种群的1.142倍。
对于南方小花蝽5龄若虫而言,木香上种群对高效氟氯氰菊酯的敏感度最高,24 h LC50值为1.855 mg/L;其次为锦绣杜鹃种群,24 h LC50值为2.089 mg/L,抗性倍数是木香种群的1.126倍;辣椒上种群对高效氟氯氰菊酯的敏感度低,24 h LC50值为3.385 mg/L,抗性倍数是木香种群的1.825倍。
南方小花蝽成虫和5龄若虫相比较,若虫对高效氟氯氰菊酯的敏感度均低于成虫。木香上5龄若虫的抗性倍数是成虫的3.215倍,锦绣杜鹃上5龄若虫的抗性倍数是成虫的3.425倍,辣椒上5龄若虫的抗性倍数是成虫的5.137倍。
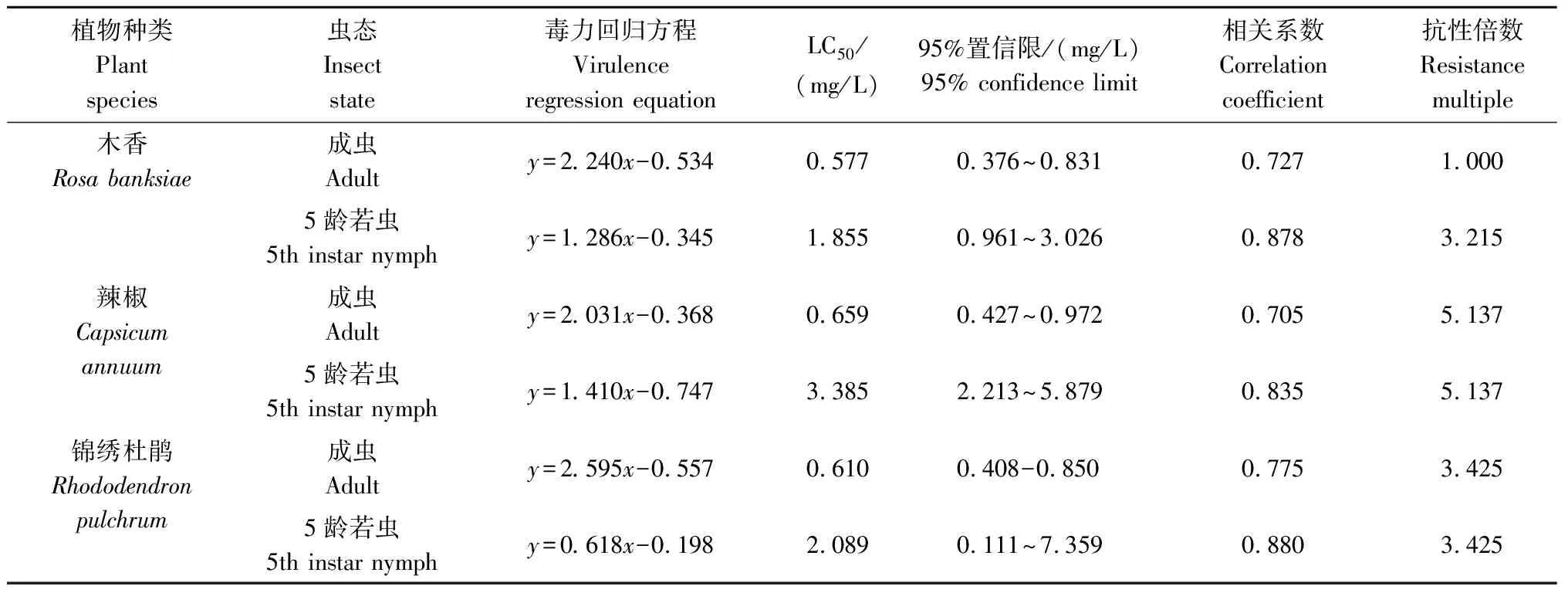
表2 3种植物上不同虫态的南方小花蝽对高效氯氟氰菊酯的敏感度Tab.2 Sensitivity of Orius similis in different insect states to beta-cypermethrin on three plants
2.3 3种植物上南方小花蝽不同虫态对阿维菌素的敏感度
从表3可见,对于南方小花蝽成虫而言,木香上种群对阿维菌素的敏感度最高,24 h LC50值为2.047 mg/L;其次为锦绣杜鹃种群,24 h LC50值为2.366 mg/L,其对阿维菌素的抗性倍数是木香种群的1.156倍;辣椒上种群对阿维菌素的敏感度最低,成虫24 h LC50值为3.046 mg/L,其对阿维菌素的抗性倍数是木香种群的1.488倍。
对于南方小花蝽5龄若虫而言,木香上种群对阿维菌素的敏感度最高,24 h LC50值为3.601 mg/L;其次为锦绣杜鹃种群,24 h LC50值为5.078 mg/L,其对阿维菌素的抗性倍数是木香种群的1.410倍;辣椒上种群对阿维菌素的敏感度最低,24 h LC50值为5.938 mg/L,其对阿维菌素的抗性倍数是木香种群的1.649倍。
南方小花蝽成虫和5龄若虫相比较,若虫对阿维菌素的敏感度均低于成虫。木香上5龄若虫的抗性倍数是成虫的1.759倍,锦绣杜鹃上5龄若虫的抗性倍数是成虫的2.146倍,辣椒上5龄若虫的抗性倍数是成虫的1.949倍。
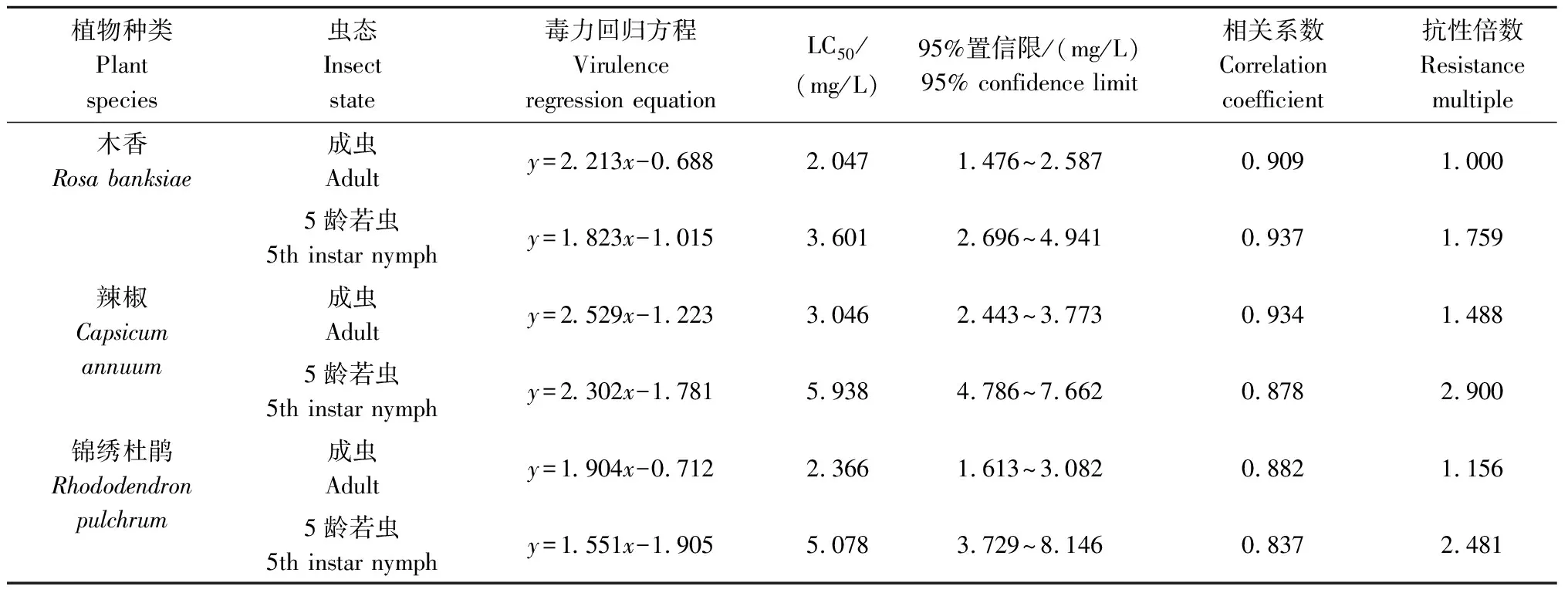
表3 3种植物上不同虫态的南方小花蝽对阿维菌素的敏感度Tab.3 Sensitivity of Orius similis in different insect states to avermectin on three plants
2.4 3种植物上南方小花蝽不同虫态对3种杀虫剂的敏感度比较
3种杀虫剂对不同植物上南方小花蝽的毒力各不相同。3种植物上南方小花蝽成虫和5龄若虫均对高效氟氯氰菊酯的敏感度最高,成虫和5龄若虫24 h LC50值分别为0.577 ~0.659 mg/L和1.855~3.385 mg/L(表2),说明高效氟氯氰菊酯对试验区域内的南方小花蝽成虫和5龄若虫的毒杀效果最强;其次是阿维菌素,成虫和5龄若虫24 h LC50值分别为2.047~3.046 mg/L和3.601~5.938 mg/L(表3);3种植物上南方小花蝽成虫和5龄若虫均对吡虫啉的敏感度最低,成虫和5龄若虫24 h LC50值分别为8.024~20.183 mg/L和10.297~22.607 mg/L(表1)。
而相对同一种杀虫剂来说,不同植物上南方小花蝽对杀虫剂的敏感度从高到低依次为木香、锦绣杜鹃、辣椒,说明试验区域木香上南方小花蝽对杀虫剂的抗性最低。木香上南方小花蝽成虫对高效氟氯氰菊酯的敏感度最高,24 h LC50值为0.577 mg/L,木香上南方小花蝽5龄若虫的24 h LC50值为1.855 mg/L,是木香上成虫的3.215倍;锦绣杜鹃上成虫的24 h LC50值为0.610 mg/L,是木香上成虫的1.057倍,5龄若虫的24 h LC50值为2.089 mg/L,是木香上成虫的3.620倍;辣椒上成虫的24 h LC50值为0.659 mg/L,是木香上成虫的1.142倍,5龄若虫的24 h LC50值为3.385 mg/L,是木香上成虫的5.867倍(表2)。阿维菌素和吡虫啉对不同植物上南方小花蝽的毒力情况与高效氟氯氰菊酯相似(表1、表3)。
不同虫态对杀虫剂的敏感度有很大不同,所用杀虫剂中,成虫对杀虫剂的敏感度较高,说明若虫的抗性高于成虫。木香上南方小花蝽5龄若虫对高效氟氯氰菊酯的抗性倍数是成虫的3.215倍;锦绣杜鹃上南方小花蝽5龄若虫对高效氟氯氰菊酯的抗性倍数是成虫的3.425倍;辣椒上南方小花蝽5龄若虫对高效氟氯氰菊酯的抗性倍数是成虫的5.137倍(表2)。阿维菌素和吡虫啉对南方小花蝽不同虫态的毒力情况与高效氟氯氰菊酯相似(表1、表3)。
3 结论与讨论
3种杀虫剂对同种植物上南方小花蝽的室内毒力测定结果表明,3种植物上的南方小花蝽对不同杀虫剂的敏感度有差异,所有植物上的南方小花蝽均对高效氟氯氰菊酯的敏感度最高,其中木香上南方小花蝽成虫的24 h LC50值为0.577 mg/L,若虫为1.855 mg/L;辣椒上南方小花蝽成虫的24 h LC50值为0.659 mg/L,若虫为3.385 mg/L;锦绣杜鹃上南方小花蝽成虫的24 h LC50值为0.610 mg/L,若虫为2.089 mg/L。其次为阿维菌素,其对木香上南方小花蝽成虫的24 h LC50值为2.047 mg/L,若虫为3.601 mg/L;辣椒上南方小花蝽成虫的24 h LC50值为3.046 mg/L,若虫为5.938 mg/L;锦绣杜鹃上南方小花蝽成虫的24 h LC50值为2.366 mg/L,若虫为5.078 mg/L。3种植物上的南方小花蝽均对吡虫啉的敏感度最低,其中木香上南方小花蝽成虫的24 h LC50值为8.024 mg/L,若虫为10.297 mg/L;辣椒上南方小花蝽成虫的24 h LC50值为20.183 mg/L,若虫为22.607 mg/L;锦绣杜鹃上南方小花蝽成虫的24 h LC50值为8.900 mg/L,若虫为10.338 mg/L。造成南方小花蝽对3种杀虫剂敏感度不同的原因可能是杀虫剂对昆虫的毒杀作用不一致,在所用的3种杀虫剂中,吡虫啉作用于乙酰胆碱受体,高效氯氟氰菊酯作用于神经突触末端,阿维菌素作用于神经元突触或者神经肌肉突触的GABA系统,阻断神经传导,作用机制的不同可能是导致3种杀虫剂对南方小花蝽的LC50值有显著差异的主要原因[21-25]。本研究所得的敏感度规律与曾广等[26]测得的南方小花蝽对高效氯氟氰菊酯、阿维菌素和吡虫啉的敏感度规律一致,但是本研究结果中的LC50值均高于曾广等[26]测得的高效氟氯氰菊酯、阿维菌素和吡虫啉对南方小花蝽的LC50值,主要原因在于其研究中供试的南方小花蝽种群在人工气候室中连续培养了多个世代,导致南方小花蝽对杀虫剂的敏感度增加,从而LC50值低于本试验所得结果,也有可能是生态环境和测定方法差异所致。本研究结果与邵凡旭等[27]测定的阿维菌素对南方小花蝽的LC50值相比更低,主要可能是测定方法差异所致,邵凡旭等[27]所用的是浸叶法,即将叶片浸入药液中,让叶片附有一层药膜并晾干,而后进行试验,本研究为了符合田间喷洒杀虫剂的真实情况,使用的是直接触杀方法,将南方小花蝽接触药液,所以研究结果差异明显。
同一种杀虫剂对3种不同植物上南方小花蝽的毒力测定结果表明,木香上的南方小花蝽2个虫态对3种杀虫剂均最敏感。造成同种杀虫剂对不同植物上南方小花蝽毒杀效果不一样的原因可能是,植物的差异导致其上面的南方小花蝽对同一种杀虫剂有不同的抗性,西花蓟马主要趋向于植物的花朵部分活动和危害,从花朵的结构来看,木香花为重瓣花,具有可供捕食性天敌南方小花蝽躲藏的空间,相反的,辣椒花以及锦绣杜鹃花花朵结构为单瓣,供南方小花蝽躲藏的地方很少,所以当喷洒杀虫剂防治这些植物上的蓟马时,辣椒花和锦绣杜鹃花上的西花蓟马和小花蝽接触到的杀虫剂药量远大于木香上的昆虫,更容易对杀虫剂产生抗性。冯国蕾等[28]研究了不同寄主植物与棉蚜酯酶活性的关系,发现不同寄主植物上棉蚜体内非特异性酯酶活性不同,从而使棉蚜对有机磷杀虫剂抗性不同。姚洪渭等[29]也发现,害虫取食不同寄主植物后,其自身的抗性会得到改变。本研究中不同植物上的蓟马可能抗性不同,南方小花蝽取食了这些抗性不同的蓟马,因为生物富集作用,从而导致南方小花蝽的抗性不同。
朱福兴等[30]的研究发现,杀虫剂施用量较大地区的龟纹瓢虫对三氟氯氰菊酯产生了抗药性,且抗药性是无杀虫剂施用地区龟纹瓢虫的30.6倍,说明了天敌虽然对杀虫剂比害虫敏感,但持续大量地使用杀虫剂也能使天敌昆虫产生抗性。VASS[31]的研究结果表明,猎物与天敌之间存在着相互适应的协同进化关系,说明天敌的抗药性会随着猎物抗药性的增加而增加。除此之外,使寄生蜂寄生硫丹处理过的米蛾卵,选育341代,最终得到15.2倍抗药性,说明由于生物富集作用,天敌在捕食带毒猎物的同时产生了抗药性,并且在一代又一代中得到了积累[32-33]。张晓明等[16]测定了6种杀虫剂对西花蓟马和花蓟马的室内毒力,发现昆明地区的优势种西花蓟马和花蓟马对阿维菌素、乙基多杀菌素等6种药剂均产生不同程度的抗药性,且蓟马对阿维菌素和吡虫啉等杀虫剂的敏感度与本研究中南方小花蝽对这几种杀虫剂的敏感度测定结果相似,说明在昆明地区南方小花蝽捕食带毒的西花蓟马,产生了相似的抗药性。胡昌雄等[20]和张晓明等[18]研究了吡虫啉在室内条件下对蓟马种群的影响,发现吡虫啉胁迫会导致蓟马雌雄比例上升且种间竞争加剧,从而蓟马抗性得到提升,南方小花蝽捕食具有抗性的蓟马后,通过食物链的富集作用,该抗性有可能转移至南方小花蝽体内。张晓明等[34]的田间研究结果表明,温室内持续单一地使用杀虫剂吡虫啉,致使西花蓟马对吡虫啉的抗性迅速上升,而蓟马的天敌几乎被杀死,说明害虫西花蓟马对杀虫剂的抗性高于天敌昆虫的抗性。郑少雄等[35]发现,杀虫剂会使昆虫产生趋避现象,天敌只会在觅食时进入有杀虫剂的区域,而其余时间则处于无杀虫剂的区域内活动,由此可得知南方小花蝽的活动能力强,活动范围广,其对杀虫剂也有一定的趋避现象,接触很少的杀虫剂,因而抗药性形成速度很慢;反之,西花蓟马隐藏于心叶以及花器上,活动范围相对于南方小花蝽小,长期处于有杀虫剂的范围内取食和危害,使其更易于产生抗药性,所以南方小花蝽对杀虫剂的敏感度普遍高于蓟马。这一结果与SCHUSTER等[19]得出的天敌抗药性显著低于猎物的结果相一致。
姜勇等[36]和郅军锐等[8]研究了无毒猎物和有毒猎物对南方小花蝽捕食功能的影响,若虫龄期由低到高阶段中对无毒猎物的捕食量和瞬时捕食率均逐渐增高,于5龄若虫时达到最大值且高于成虫,虽然有毒猎物抑制了南方小花蝽的捕食量和瞬时捕食率,成虫和各龄若虫捕食量和瞬时捕食率与无毒猎物处理相比都有下降,但在5龄若虫时下降的幅度低于成虫,则说明南方小花蝽在5龄若虫时捕食量大于成虫,因捕食有毒猎物使得其对杀虫剂的抗性增加,从而抗性大于成虫。对于本研究中的南方小花蝽2种虫态来说,5龄若虫对3种杀虫剂的敏感度均低于成虫,若虫抗性高于成虫的原因可能也是,南方小花蝽从低龄若虫到高龄若虫的阶段,捕食量增大,更多地累积了对杀虫剂的抗性。
南方小花蝽对3种杀虫剂产生了不同程度的抗药性,其抗药性的产生与生活的环境以及捕食的猎物息息相关,接触杀虫剂以及捕食带毒的猎物是南方小花蝽产生抗药性的主要原因。南方小花蝽抗药性的产生,有利于对蓟马、蚜虫等小型害虫的生物防治,缓解害虫化学防治和生物防治之间的矛盾,一定程度上解决农药残留和环境污染等问题。由于生物的富集作用,通常处于食物链高级的生物体内毒素含量很高,如果是这样,则南方小花蝽的抗药性应该高于猎物的抗药性或者与其猎物的抗药性相差不多,但事实上天敌的抗性比猎物的抗性低得多,所以南方小花蝽体内的抗性变化规律和解毒机制还需要进一步研究和探索。
