肾缺血再灌注损伤与线粒体自噬SIRT1-FOXO3-PINK1-Parkin 调节轴的研究进展
2019-03-06王锁刚王光策
王锁刚 王光策
河南中医药大学第一附属医院泌尿外科,河南郑州 450003
缺血再灌注损伤(IRI)是器官或组织缺血、缺氧损伤后重获血流灌注或氧供应,对器官或组织产生二次损伤的后果。IRI 广泛存在于多种临床疾病及治疗过程中,包括心肌梗死、脑卒中、间室综合征、血管重建、主动脉成形术、创伤后复苏、急性缺血性肾衰竭、再植术、肾肿瘤部分切除术和实体器官移植等[1]。肾脏是最易发生IRI 的重要脏器之一。肾IRI 不仅会造成急性肾损伤、全身炎症反应综合征和多器官功能综合征,在肾移植中还可引起急性排斥反应、移植肾功能延迟恢复和慢性移植肾肾病等,严重阻碍了肾移植受者和移植肾的长期存活[2]。近年来,随着我国公民逝世后器官捐献事业的全面开展,当前我国肾移植例数已经跃居世界第二,而边缘性供肾越来越多应用于临床,肾IRI 作为影响肾移植受者近期及远期预后的重要因素而备受关注。因此,深入认识肾IRI 的发生、发展机制,探索有效的防治策略有着非常重要的现实意义。
1 肾IRI 的分子和细胞机制
肾IRI 的相关分子和细胞机制仍是肾移植界的研究热点,国内外众多专家学者做了一些基础研究,并取得了重要进展。肾IRI 是以肾实质细胞为主的缺血、缺氧损伤及多种细胞和细胞因子参与的、连锁反应性的病理生理过程,众多因素参与其中[3-4]。肾IRI分为肾缺血和再灌注两个阶段。其中,缺血是随着血流量下降而导致肾组织处于缺血缺氧状态;再灌注则是缺血的肾组织恢复血流的过程,往往会加重缺血性肾损伤。在体情况下,缺血的机制主要是由于机械性或其他原因导致肾血管腔变窄或血流中断;再灌注损伤的机制涉及多个方面,主要包括氧自由基损伤、炎性因子及递质释放、细胞凋亡、细胞内Ca2+超载和无复流现象等[1]。肾脏微血管不仅是炎症、代谢等损害因素的承受者,也是肾脏损伤的参与者,肾脏损伤是导致肾脏微血管功能障碍后造成肾功能恶化的重要决定因素。目前认为,炎性反应、氧化应激反应、补体通路介导细胞损伤、内质网应激、线粒体自噬和微血管功能障碍等在肾IRI 中发挥着非常重要的作用[5],且与相关信号转导通路激活、NO 含量变化及免疫学因素等共同参与引起的肾脏组织结构紊乱与功能代谢异常密切相关[6],同时肾IRI 诱导了内质网应激反应,加重肾IRI。肾小管上皮细胞缺氧/复氧可触发内质网系统,激活Caspase-12,从而诱导细胞凋亡[7]。总之,肾IRI 是一个多因素、多途径、复杂的病理过程,肾IRI涉及多种分子和细胞机制[8](图1)。目前尚无一种系统的理论能完全解释肾IRI 的发生机制和效应机制,有待进一步深入研究。
2 肾IRI 与线粒体自噬
线粒体是细胞内氧化磷酸化的主要场所,为细胞的生命活动提供能量,在细胞生存和死亡过程中扮演着重要角色。一旦线粒体功能紊乱,可导致质子泵功能障碍,线粒体内膜通透性升高,致使膜电位迅速耗散,活性氧(ROS)增加、细胞器损伤,最终诱导细胞凋亡或坏死。肾IRI 始于能量代谢障碍及线粒体受损[8]。自噬在肾IRI 中的作用越来越受到关注,尤其线粒体自噬是肾IRI 的主要机制之一,而自噬信号通路在肾IRI 中起关键的调控作用[9]。肾缺血时适度增加自噬可在一定程度上减轻肾损伤,而再灌注阶段的过度自噬则会加重肾损伤[10]。然而,在肾IRI 发生的过程中,调控线粒体自噬的上游信号分子对肾IRI 的作用尚未完全明确。
肾小管上皮细胞富含线粒体,线粒体损伤与肾损伤有着密切的关系。线粒体作为肾小管上皮细胞总含量最丰富的细胞器,对肾小管上皮细胞维持正常功能非常重要[11]。线粒体自噬是一种特异性自噬,可选择性地清除已受损或出现功能障碍的线粒体,使其被包裹到自噬体中并与溶酶体融合进行线粒体裂解,是一个防御性的过程,从而维持细胞内环境稳态[12]。在肾IRI 的进程中线粒体功能损伤起着重要作用,肾IRI 使线粒体功能出现障碍,进而引起肾脏ATP 生成减少、氧自由基生成增多和促凋亡蛋白的大量释放,最终导致细胞死亡[13]。同时,新生成的氧自由基更加剧了线粒体的损伤,形成恶性循环[14]。氧自由基增加、线粒体膜电位下降、线粒体通透性转换孔开放都会诱发自噬,而适度自噬可清除损伤的细胞器,挽救濒死肾小管上皮细胞[15];如自噬过度激活,又会引起细胞自噬性死亡[16]。多种基因信号通路在低氧条件下通过线粒体自噬共同参与肾IRI 的调节[17](图2)。
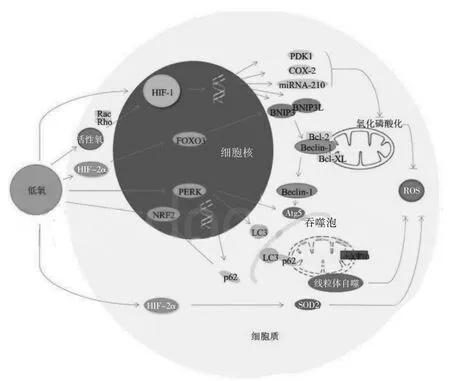
图2 低氧条件下通过线粒体自噬对肾缺血再灌注的调节
3 SIRT1-FOXO3-PINK1-Parkin 调节轴介导线粒体自噬
近年来,肾小管上皮细胞内线粒体功能异常已成为肾IRI 研究的焦点之一。因此,及时有效地清除受损或功能障碍的线粒体对减轻肾IRI 具有重要的意义。SIRT1-FOXO3-PINK1-Parkin 信号通路在线粒体自噬中的作用和地位已被认可,但SIRT1-FOXO3-PINK1-Parkin 作为目标调节轴是如何在线粒体自噬中具体发挥作用?目前有以下几种观点[18-19]:①SIRT1是依赖于烟酰胺腺嘌呤二核苷酸辅酶的去乙酰化酶家族成员之一,参与调节多种与线粒体增殖和自噬相关转录因子的表达及活性,对线粒体数量和质量的调节起着主要作用;②FOXO3 位于细胞质中,是FOX 家族中FOXO 亚家族的重要成员蛋白,为SIRT1 的下游分子,通过翻译、修饰改变后从细胞质定位到细胞核,在组织细胞应激损伤的过程中,通过调控相关基因的表达而起作用,包括抗氧化应激反应、参与细胞代谢、转录翻译、DNA 修复、细胞凋亡和减少ROS 的过度释放,以及调节线粒体自噬等方面具有重要作用;③PINK1/Parkin 信号通路是哺乳动物细胞的特有线粒体自噬通路[20],其中重要的调节因子有PINK1 和Parkin。Parkin可感受线粒体膜电位的变化,当受损线粒体膜电位下降,在PINK1 的参与下,Parkin 迅速募集于线粒体外膜,快速泛素化线粒体膜蛋白,启动线粒体自噬。研究表明,PINK1/Parkin 募到膜电位受损线粒体上通过自噬体而清除之,PINK1/Parkin 介导的线粒体自噬是清除线粒体的经典模式[21]。Pink1/Parkin 介导线粒体自噬过程如下[22]:①生理状态下,PINK1 和Parkin 蛋白均低水平定位于线粒体的外膜和胞质中;②当应激原刺激机体时,线粒体发生去极化,ROS 生成增加,从而诱发器官或组织发生氧化应激损伤;③PINK1 迅速识别损伤的线粒体,并稳定聚集于外膜的表面,继而招募并充分磷酸化而激活Parkin,使其转位至受损的线粒体外膜;④Parkin 构建多聚泛素链,泛素化线粒体的成分蛋白;⑤P62、NDP52、OPTN 等自噬受体蛋白通过UBDs 识别泛素化的线粒体,并通过LIR 锚定于自噬囊泡膜上,从而形成线粒体自噬体;⑥线粒体自噬体融合溶酶体形成了线粒体-自噬溶酶体,最终在溶酶体中被水解酶降解。线粒体自噬时,增加了对自噬和溶酶体蛋白的需求,SIRT1-FOXO3-PINK1-Parkin 调节轴参与了线粒体自噬的调控[23-24]。
4 肾IRI 与线粒体自噬SIRT1-FOXO3-PINK1-Parkin调节轴
当线粒体在进行能量转化和氧化呼吸的过程中释放ROS,在肾IRI 过程中起着重要作用。线粒体自噬是一把“双刃剑”,在肾IRI 中起到双重调控作用,决定着细胞生存和凋亡,而SIRT1-FOXO3-PINK1-Parkin 调节轴如何通过线粒体自噬介导肾IRI?其中,SIRT 是一种烟酰胺腺嘌呤二核苷酸依赖蛋白通过去乙酰化生成,通过调节下游FOX 发挥抗衰老、抑制凋亡等生物功能;FOXO 是自噬调控的关键因子,起显著作用的有FOXO1、FOXO3、FOXO4。SIRT1 通过调节FOXO 乙酰化水平调控细胞的自噬活性,进而影响细胞增殖、存活、代谢等过程[25];SIRT1 能使FOXO3去乙酰化,激活FOXO3 的转录活性,在脂质代谢中起重要作用。研究证明,活性FOXO3 存在于细胞核中,当受SIRT1 的脱乙酰化酶作用后向细胞质转移[26]。PINK1 是一种必需的促生存因子,由氧化应激诱导产生。FOXO 在经受生长因子剥夺的小鼠和人细胞中控制PINK1 转录,并且该调节通过进化上保守的FOXO 结合元件发挥作用,FOXO 诱导的PINK1 等生存因子可能可以保护细胞,因其容易将缺血再灌注介导的氧化环境改变为还原环境并增加还原性谷胱甘肽水平[27]。事实上,PINK1 的缺失会导致线粒体功能缺陷和对氧化应激的敏感性增加[28]。线粒体动力学由涉及PINK1-PARKIN 的共同途径调节[29]。最近有研究表明,PINK1-PARKIN 通路通过促进线粒体自噬在线粒体质量控制中发挥作用。PINK1 在受损的线粒体上稳定,然后将其导入线粒体外膜,导致通过线粒体自噬去除受损的线粒体。有研究揭示,PINK1-PARKIN 与线粒体融合-裂变通路之间的功能关系,暗示有缺陷的线粒体动力学[30]。PINK1/Parkin 通路可以通过调节线粒体自噬参与肾小管上皮细胞内受损线粒体的选择性清除,对维持由缺氧引起肾小管上皮细胞稳态失衡以及改善肾功能是十分有益的。可见,线粒体自噬SIRT1-FOXO3-PINK1-Parkin 调节轴通过介导缺血、缺氧引起肾IRI。
5 调控线粒体自噬在肾小管细胞中的保护作用
自噬诱导肾损伤作用已被证实。自噬抑制剂增强了急性肾损伤,而自噬的激活剂显示了保护作用,表明自噬在一定的条件下具有保护肾IRI 的作用。此外,通过自噬缺陷小鼠模型的试验,进一步证实线粒体自噬在肾小管细胞中有保护作用[31]。尽管进行了一些相关的研究,但线粒体自噬如何保护肾小管细胞的机制尚不十分清楚。有丝分裂是一种选择性的自噬,线粒体的启动是一个决定性的事件,因为它标记特定的线粒体进行自噬识别和降解。在肾脏病理生理过程中,有关线粒体启动有丝分裂的信息很少。BNIP3 参与线粒体启动在体外氧化应激诱导的肾小管细胞有丝分裂中的作用,但其在体内肾小管细胞有丝分裂中的作用尚未被研究证实。上述文献研究结果强烈提示,调节线粒体增殖和自噬对肾IRI 的保护作用已得到证实,通过有效措施调控SIRT1-FOXO3-PINK1-Parkin线粒体自噬调节轴可能有助于肾IRI 后肾小管上皮细胞损伤的修复。因此,研究通过调控线粒体自噬保护肾小管上皮细胞的作用,适当调控机体的自噬,特别是选择性地调控线粒体自噬对维持细胞正常功能,防治肾IRI 具有非常重要的意义。
6 调控线粒体自噬SIRT1-FOXO3-PINK1-Parkin调节轴修复肾IRI 的展望
近年来,在肾IRI 防治方面的研究取得了一些进展,其中以启动肾脏内源性保护机制(如预处理和预适应)尤为重要。此外,用药物激活或抑制某些机体因子而保护肾组织的研究,对肾移植术后肾功能恢复及移植肾的长期存活有着重要的意义。然而,目前针对肾IRI 的治疗多是初步的研究,而且多停留在实验阶段或尝试性用药,不能全面揭示其作用机制,同时也缺乏系统化的整理和总结,迄今为止尚无真正有效的防治药物。因此,探索有效的肾IRI 治疗策略以及药物的作用靶点和机制迫在眉睫。今后可致力于研究参与线粒体自噬的肾IRI 相关基因编码的蛋白之间的相互联系,形成完整的肾IRI 相关信号通路之间的调控联系,为寻找肾IRI 相关分子标志物和药物的作用靶点提供理论依据。
综上所述,深入探讨SIRT1-FOXO3-PINK1-Parkin依赖线粒体自噬调节轴与肾IRI 的关系,研究促进肾IRI 后肾小管上皮细胞损伤愈合的新机制,有望通过调控线粒体增殖和自噬途径探索减轻肾IRI 的有效措施,以期为临床应用提供充分的理论和实验依据,并最终为探寻价廉、高效、低毒的肾IRI 预处理药物提供新思路。
