叶面喷施外源多胺对干旱胁迫下红椿叶片解剖结构的修复效果
2019-03-06吴际友杨硕知梁文斌李志辉
刘 球 ,吴际友 ,杨硕知 ,梁文斌 ,李志辉 ,程 勇
(1.湖南省林业科学院,湖南 长沙 410004;2.中南林业科技大学,湖南 长沙 410004)
在全球气候大背景下,植物正面临着各种各样的生存挑战。在植物遭受的环境胁迫中,干旱胁迫属于比较常见的一种。在整个生命周期中,植物经常会遭遇水分亏缺[1]。
叶片被视为高等植物光合作用的活动中心,也是植物在环境中暴露面积最大的器官。植物在遭遇干旱胁迫时,叶片的表型、解剖结构、生理等性状均能及时响应[2-3]。叶片各具体响应,与该植物的抗旱能力直接相关[4]。杨小玉[5]在研究5种灌木叶片解剖结构时发现,杨柴、沙柳和蒙古莸的角质层和表皮细胞壁均在干旱环境下有明显加厚。潘存娥等[6]对5种杨树无性系的干旱胁迫响应进行研究发现各无性系叶片上表皮细胞排列紧密,厚度在11.03~ 17.44 µm,下表皮厚度在7.75~12.79 µm。王顺才等[7]观测发现不同苹果叶片角质层对水分亏缺的响应差异明显,这也是不同苹果属植物拥有不同抗旱能力的原因之一。一般在处于水分亏缺状态时,树木叶片栅栏组织发达、细胞层数增加且体积减小,但海绵组织相对减少、细胞间隙也减小[8]。随着水分亏缺的严重,栅/海比值会逐渐增大,叶片紧密程度不断提高,表示植株抗旱能力在增强[9]。李鸿雁等[10]对6种牧草叶片进行观测比较得出,各参试材料的栅栏组织和海绵组织种间差异极显著,且栅/海比值均大于1。吴建慧等[11]发现,随着干旱胁迫程度加重,绢毛委陵菜叶片栅栏组织、海绵组织均变薄,栅/海比值大于对照。翟晓巧等[12]对8种落叶乔木的叶片解剖结构研究,得知各树种叶片都具有角质膜,但厚度差别很大。潘学军等[13]对喀斯特山区野生葡萄的叶片解剖结构与抗旱性的关系进行了研究发现,4种野生葡萄叶片厚度存在明显差异。王丹等[14]发现,在水分胁迫下,亮叶忍冬和蔓生紫薇叶片厚度均极显著变薄。郭改改等[15]对不同区域长柄扁桃叶片解剖结构分析发现,榆阳区长柄扁桃抗旱性最强,其叶片维管组织发达,含较多贮水细胞。马小芬等[16]对文冠果叶片进行解剖发现其具有明显的旱生植物特点,叶片表皮有较厚的角质层和细胞壁,输导组织发达。刘红茹等[17]对延安5种木犀科园林植物进行叶片解剖结构观察发现,中脉均比较发达,厚度分布在560.9~978.5 µm,其中以白蜡的中脉最厚。在干旱条件下,植物叶片气孔密度越大,越有利于植物短时间内充分利用有效水分进行光合作用[18]。许多旱生植物在干旱时为了节约体内水分,会使叶表皮气孔下陷、加大密度或缩小孔径,以此对干旱环境做出快速响应[19]。韩永芬等[20]研究表明,下表皮气孔长度和密度以及上表皮气孔长度是评价菊苣抗旱性的敏感指标。张诚诚等[21]发现,油茶容器苗的气孔面积、密度、大小及开度随着基质含水量的减少有显著变化,基质含水量为81%~90%时,气孔面积和密度都较大,而气孔开度和大小均较小。
红椿Toona ciliata,是我国优先重点发展的乡土珍贵树种之一,作为优良的家居装饰用材树种,市场前景非常广阔。本研究团队对红椿的水分生理以及外源调节方面做了多年的工作,在红椿抗旱[22-25]特性、红椿抗水淹[26]特性、外源调节抗旱能力[27]等方面展开了深入系统的研究,掌握了红椿的水分生理特性以及相关的有效抗旱调节措施。本文是从植株叶片解剖结构的角度入手,探讨叶面喷施外源多胺对干旱胁迫下红椿幼苗叶片的解剖结构损伤的修复效果,为红椿苗圃抗旱实践提供科学依据和技术指导,为完善外源多胺调节红椿抗旱能力的系统研究提供有力支撑。
1 材料与方法
1.1 试验地概况
试验地设在湖南省林业科学院苗圃,海拔为110 m,地理坐标为 112°59′E、28°05′N,年平均气温16.8 ℃,年降水量1 400~1 900 mm,平均日照时数1 496~1 850 h,无霜期达264 d,属于中亚热带季风湿润气候区,雨量丰沛,光照充足;土壤为红壤,土层厚达60 cm以上,肥力中等,pH值为6.2[22]。
1.2 材料与方法
本试验材料为2年生红椿家系盆栽苗。2012年3月,课题组开展田间育苗。2014年3月,选择苗高1.0 m、胸径1.8 cm的长势均匀、无病虫害的健康红椿幼苗装盆,盆钵口径25 cm、深20 cm,每盆装土5 kg,比例为黄心土∶泥炭土=2∶1,统一配盆垫,进行正常浇水管护。2014年6—7月,在入盆植株中筛选出长势均匀的红椿幼苗进行干旱胁迫及外源多胺修复试验[22]。
1.3 试验设计
本试验为“干旱胁迫+多胺修复处理”试验,采用完全随机设计,包括对照(无干旱胁迫、不喷施多胺)、干旱胁迫(1种)和多胺修复处理(3种)。植株干旱胁迫设置1种梯度,即持续干旱21 d (土壤相对含水率20%~25%);喷施多胺修复处理有3种,即外源腐胺(Putrescine,简称Put)、外源亚精胺(Spermidine,简称Spd)、外源精胺(Spermine,简称Spm),先对参试植株进行重度干旱胁迫,然后再对其进行多胺修复处理并采样分析。多胺修复处理,即干旱结束日起,每天傍晚18:00对干旱胁迫对象喷施浓度为1 mmol·L-1的外源Put、Spd和Spm水溶液,贴近植株叶片正反面进行雾状喷施,喷施量以叶片正反面水珠凝结滴落为限,连续喷施3 d。对照植株并未参与干旱胁迫以及多胺修复处理,试验过程中需对其进行日常管护。每种多胺处理5株,重复3次,共4个多胺修复处理(含对照),一共处理60株。
1.4 指标测定方法
分别在干旱前、干旱后和多胺修复处理后第2天9:00前对叶片进行采样时,统一选择第三轮或第四轮成熟叶片。叶片解剖结构观测参照李正理等[28]的常规石蜡切片法。取出采集的叶片,用锋利的刀片切去叶片的上下各三分之一,然后将剩余中部三分之一叶片沿着主脉横切成大小约为1.0 cm×0.5 cm的小方块,在完成抽气后,将方块放进福尔马林、醋酸和酒精配置的FAA固定液中进行固定。制作切片的厚度为8~10 µm,用番红-固绿进行双重染色,然后用中性树胶完成封片。切片的解剖结构特征是采用Motic BA410显微镜进行观测,随后进行拍照,记录图片信息,并用显微测微尺测定叶片主脉直径、上表皮厚度、下表皮厚度、叶肉厚度、栅栏组织厚度和海绵组织厚度,每个指标数值均由25个观测视野计算平均值。
1.5 数据分析与处理
数据采用Excel 2003 进行处理,用SPSS 17.0进行方差分析和多重比较。
2 结果与分析
2.1 外源多胺对干旱胁迫下红椿叶片主脉直径的修复效果
2.1.1 干旱修复处理后的红椿叶片主脉直径
在对照、干旱胁迫和外源多胺(Put、Spd和Spm)修复调节处理之间,红椿叶片主脉直径均在α=0.01水平差异显著(图1)。干旱胁迫后,红椿叶片主脉直径……;在遭受干旱胁迫并喷施外源Put修复调节后,叶片主脉直径恢复并超出干旱胁迫状态下指标值的55.63%;在遭受干旱胁迫并喷施外源Spm修复调节后,叶片主脉直径恢复并超出干旱胁迫状态的95.67%;但在遭受干旱胁迫后,如果喷施外源Spd修复调节,则主脉厚度反而变薄,变薄幅度为干旱胁迫状态的53.26%。
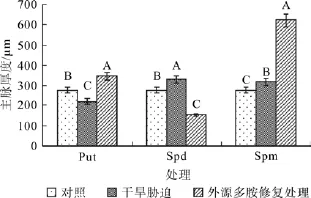
图1 红椿干旱胁迫及外源多胺修复处理后的叶片主脉直径Fig.1 Effects of drought stress and exogenous polyamine treatments on main vein diameter of of T.ciliate seedling leaves
2.1.2 不同外源多胺对红椿干旱胁迫下主脉厚度的修复效果比较
叶片主脉的大小跟水分在植物体内的运输效率直接相关。主脉越粗,植株叶片水分运输效率则越高,抵御干旱失水伤害的能力也就越强。因此,主脉厚度变化值(主脉厚度变化值=试剂调节后主脉厚度-干旱胁迫处理下主脉厚度)越大,表示外源多胺的修复调节效果越好。结果显示,3种多胺溶液对红椿叶片主脉直径的修复调节效果在α=0.01水平差异显著。外源Put和外源Spm对主脉厚度的修复调节起到的是正向作用,而外源Spd则起到的是负向作用,说明对植株的水分运输能力的修复效果来讲,以Spm效果最佳。
2.2 叶面喷施外源多胺对干旱胁迫下红椿叶片厚度的修复效果
2.2.1 叶面喷施外源多胺对干旱胁迫下红椿叶片上表皮厚度的修复效果
2.2.1.1 干旱修复处理后的红椿叶片上表皮厚度
在对照、干旱胁迫和外源多胺(Put、Spd和Spm)修复调节处理之间,红椿叶片上表皮厚度均在α=0.05水平差异显著。如图2所示,喷施外源Put对叶片上表皮厚度的增厚效果不显著;但喷施外源Spd修复调节后叶片上表皮厚度显著增加,增加幅度为干旱胁迫状态的13.14%;喷施外源Spm对上表皮厚度增厚效果也未达到显著性水平。
2.2.1.2 不同外源多胺对红椿干旱胁迫下上表皮厚度的修复效果比较分析
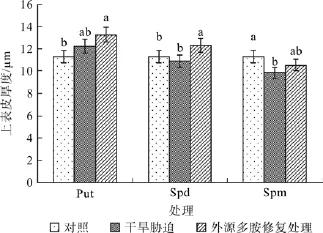
图2 外源多胺对干旱胁迫下红椿叶片上表皮厚度的修复调节Fig.2 Effects of drought stress and exogenous polyamine treatments on upper epidermis thickness of T.ciliate seedling leaves
植物叶片上表皮厚度是植物叶片厚度的一个重要指标。植物叶片越厚,储水能力就越强。如果外源多胺的修复调节能够增加叶片上表皮厚度,则表示有助于提高叶片的储水能力,从而提高其抵抗干旱胁迫的潜力。因此,上表皮厚度变化值(上表皮厚度变化值=试剂调节后上表皮厚度-干旱胁迫处理下上表皮厚度)越大,表示外源多胺对叶片储水能力起到了修复效果越大。统计结果显示,3种多胺溶液均能对红椿叶片上表皮厚度起到调节效果,但三者之间差异不明显。然而,各种外源多胺对干旱胁迫下上表皮厚度调节效果以Spd效果最佳。
2.2.2 叶面喷施外源多胺对干旱胁迫下红椿叶片下表皮厚度的修复效果
2.2.2.1 干旱修复处理后的红椿叶片下表皮厚度
在对照、干旱胁迫和外源多胺(Put、Spd和Spm)修复调节处理之间,红椿叶片下表皮厚度均在α=0.01水平差异显著(图3)。下表皮厚度在遭受干旱胁迫后显著变小,喷施外源Put修复调节后,下表皮厚度在干旱胁迫基础变化并不显著;但喷施外源Spd对下表皮厚度的修复调节效果很显著,增加幅度为干旱胁迫状态的9.60%;喷施外源Spm对下表皮厚度的修复调节效果也非常显著,增厚幅度为干旱胁迫状态的29.09%。
2.2.2.2 不同外源多胺对红椿干旱胁迫下下表皮厚度的修复效果比较
同上表皮厚度一样,植物叶片下表皮厚度也是植物叶片厚度的一个重要指标。如果外源多胺的修复调节能够增加叶片下表皮厚度,则表示调节有助于提高叶片的储水能力,从而提高其抵抗干旱胁迫的潜力。因此,下表皮厚度变化值(下表皮厚度变化值=试剂调节后下表皮厚度-干旱胁迫处理下下表皮厚度)越大,表示外源多胺对叶片储水能力起到修复效果越大。从图3中可看出,外源Spd和Spm对下表皮厚度的修复调节起到了不同程度的正向作用,其中Spm效果更佳。2.2.3 叶面喷施外源多胺对干旱胁迫下红椿叶片叶肉厚度的修复效果
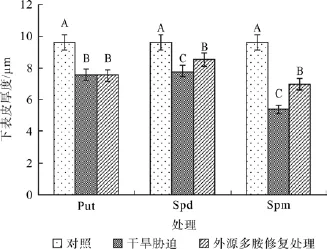
图3 外源多胺对干旱胁迫下红椿叶片下表皮厚度的修复调节Fig.3 Effects of drought stress and exogenous polyamine treatments on lower epidermis thickness of T.ciliate seedling leaves
在对照、干旱胁迫和外源多胺(Put、Spd和Spm)修复调节处理之间,红椿叶片叶肉组织厚度均在α=0.01水平差异显著(图4)。喷施外源Put对叶肉组织厚度的修复效果不明显;但喷施外源Spd对叶肉组织厚度的修复调节效果非常明显,厚度比干旱胁迫下明显回升21.78%;叶肉组织厚度在遭受干旱胁迫后显著变小,然而喷施外源Spm起到了负向作用,厚度继续明显减小,减小幅度为干旱胁迫下数值的9.01%。
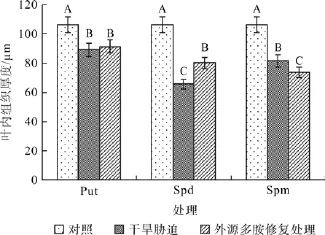
图4 外源多胺对干旱胁迫下红椿叶片叶肉组织厚度的修复调节Fig.4 Effects of drought stress and exogenous polyamine treatments on mesophyll tissue thickness of T.ciliate seedling leaves
叶肉厚度是植物叶片厚度的重要组成部分,叶肉厚度越大,则植物储水保水能力越强,抵抗干旱失水的时间越持久。如果外源多胺的修复调节能够增加叶片叶肉厚度,则表示调节有助于提高叶片的储水能力。因此,叶肉厚度变化值(叶肉组织厚度变化值=试剂调节后叶肉组织厚度-干旱胁迫处理下叶肉组织厚度)越大,表示外源多胺对叶片储水能力起到了修复效果越大。结果显示,3种外源多胺溶液均能对红椿叶片叶肉厚度修复调节效果在α=0.01水平差异显著。从图中可看出,外源Spd、Put对叶片叶肉厚度的调节起到了不同程度的正向作用,而且Spd效果最佳。
结合叶片上表皮厚度、下表皮厚度和叶肉组织厚度3个指标响应的综合情况来看,3种外源多胺对红椿叶片干旱胁迫后的持水保水能力有不同程度的修复作用,而且可以得知,以外源Spd对红椿叶片干旱胁迫后的持水保水能力的修复效果最强。
2.3 叶面喷施外源多胺对干旱胁迫下红椿叶片栅/海比值的修复效果
2.3.1 干旱修复处理后的红椿叶片栅/海比值
在对照、干旱胁迫和外源多胺(Put、Spd和Spm)修复调节处理之间,红椿叶片栅/海比值均在α=0.01水平差异显著。叶片栅/海比值在遭受干旱胁迫后显著提高,喷施外源Put后,比值在干旱胁迫基础继续明显提高,提高幅度为干旱胁迫基础上的16.99%;栅/海比值在遭受干旱胁迫后显著提高,但喷施外源Spd修复调节后比值明显减小25.17%,然而仍未回到对照水平;栅/海比值在遭受干旱胁迫后显著提升,喷施外源Spm后比值继续明显提高,在干旱胁迫基础上提高幅度为24.26%。
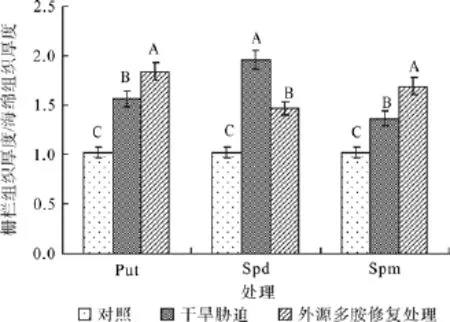
图5 外源多胺对干旱胁迫下红椿叶片栅栏组织厚度/海绵组织厚度的修复调节Fig.5 Effects of drought stress and exogenous polyamine treatments on ratio of palisade tissue thickness to spongy tissue thickness of T.ciliate seedling leaves
2.3.2 不同外源多胺对红椿干旱胁迫下栅/海比值的修复效果比较
许多研究发现,随着植株遭受干旱胁迫程度的加剧,栅/海比值会有所升高,叶片紧密度也会有所提高,原因是在干旱胁迫下,植株的栅栏组织和海绵组织会分化成适应胁迫状态、保证光合作用的形式,一般是栅栏组织变厚,海绵组织变少。然而,在干旱胁迫得到修复的情况下,由于植株的胁迫威胁得到减轻或解除,植株的干旱适应响应情况也会有所改变,植株的栅/海比值也将会有所下降。如果外源多胺能够改善植株的干旱胁迫受害情况,那么栅/海比值也会比胁迫状态时有所下降。因此,栅/海比值变化值(栅/海变化值=试剂调节后栅/海比值-干旱胁迫处理下栅/海比值)越小,表明外源多胺对其的修复调节效果越好。本实验中,3种多胺溶液均能对红椿叶片栅/海比值的修复调节效果在α=0.01水平差异显著。从图5中可看出,仅外源Spd调节后对该比值变化值为负,也就是说外源Spd对植株胁迫状态的缓解调节起到了明显的积极作用。
3 讨 论
3.1 外源多胺对干旱胁迫下红椿叶片水分运输能力的修复作用
植物叶脉对干旱胁迫主要有两个方面的适应表现,一是具有比较密集的维管束,维管组织发达,以增强植物的水分疏导能力和支撑能力;另一方面是增加叶片主脉直径、导管直径及密度,提高水分疏导能力,从而提高植物对干旱的适应和抵御能力[29]。叶片主脉的大小跟植物体内的水分运输效率直接相关。越粗的主脉具有越强的水分控制能力,可在高温及干旱条件下加快蒸腾,降低叶面温度,避免植物体受高温干旱伤害。另外,主脉中的含晶细胞和维管束鞘也可降低植物蒸腾[30]。本实验中,不同外源多胺对干旱胁迫下红椿叶片主脉直径的修复效果是不同的,外源Spm对主脉厚度的修复调节作用最佳,其次是外源Put。说明外源Spm和外源Put调节处理后,红椿叶片主脉直径因干旱胁迫所受损伤在一定程度上得到了缓解和修复,进而恢复水分疏导能力,舒缓胁迫症状。
3.2 外源多胺对干旱胁迫下红椿叶片水分储存能力的修复作用
表皮毛、表皮、表皮覆盖物及气孔属于植物的保护组织,其主要作用和功能是减少蒸腾、防止水分流失,是植物储水能力的体现[31]。植物角质层是在植物表面覆盖的、由脂肪酸及其衍生物构成的疏水性物质,主要由角质和蜡质组成。角质层的蜡质沉积或嵌入角质基质中,可限制植物表面水分的非气孔性散失,并保护植物内部组织免受紫外线辐射及病菌浸染[32]。本实验中测定了叶片的上表皮厚度、下表皮厚度以及叶肉组织厚度,3个指标值相加表示植物叶片的厚度。植物叶片越厚,其储水能力就越强,越有利于防止水分过分蒸腾[33]。因此,叶片厚度通常被视为衡量植物抗旱能力的一个重要指标[34]。综合3个指标对3种外源多胺的响应情况,3种外源多胺对干旱胁迫后红椿叶片的储水能力均有不同程度的修复作用,以外源Spd效果最佳,说明外源Spd可通过修复红椿叶片的储水能力进而提高植株的抗旱性能,降低缺水对植株产生的伤害。
3.3 外源多胺对干旱胁迫下红椿叶片栅栏组织、海绵组织的比例结构的修复作用
植物栅栏组织和海绵组织的分化情况可间接体现环境中的水分状态。一般处于水分亏缺状态时,树木叶片栅栏组织发达、细胞层数增加并且体积减小,但海绵组织却相对减少、细胞间隙也减小[35]。树木叶片栅栏组织越发达表示其抗旱能力越高[36]。栅栏组织高度发达,可避免植物叶肉细胞受强光灼伤的同时,充分利用衍射光进行光合作用[37]。即栅栏组织越厚,细胞越小,排列越紧密,植物的光能利用率越高。随着水分含量减少,栅/海比值会逐渐增大,叶片的紧密程度会不断提高。然而,在干旱胁迫得到修复的情况下,植株的栅/海比值会有所下降。本实验中,外源多胺对红椿的干旱胁迫损伤起到了类似的修复效果,其中外源Spd对红椿叶片干旱胁迫状态的缓解起到了明显的积极作用。
4 结 论
本研究采用了“对照-干旱-多胺修复”纵向分析的角度,运用精确的指标变化值,对不同多胺修复处理之于干旱胁迫的影响差异进行分析和比较,试验结果具有很高的可行性和可靠性。在外源Put、Spd和Spm3种不同的多胺修复处理下,我们可以得知,外源Spd和Spm对红椿植株干旱修复起到了不同方面的积极响应,但外源Put修复效果不显著。对植株的水分运输能力而言,以外源Spm溶液的修复效果最佳;对植株持水保水能力而言,以外源Spd修复效果最强;而在红椿叶片栅栏组织、海绵组织比例结构的缓解调节方面,仅外源Spd溶液起到了明显的积极作用。
综上所述可知,在红椿苗期干旱修复措施方面,叶面喷施1 mmol/L的外源Spd或Spm溶液均能起到有效的调节效果,可在严密观测初试效果后,结合生产成本等多方面因素,酌情考虑是否可以用于苗圃实践。
