负载CuO的Ti3+/TiO2催化剂制备及其光催化甲苯降解性能
2019-03-06,,,,
, , , ,
(河北工业大学 能源与环境工程学院, 天津 300401)
挥发性有机物(VOCs)是喷涂、家装、印染、石油化工行业中广泛存在的污染物[1]。其中,甲苯作为喷漆中含量较高的成分,是严重危害健康的致癌物质[2],且在流态实验中脱除效率较低。
TiO2光催化降解气相甲苯作为一种低成本、节能、有效的处理方法,受到广泛关注[3]。但因其较大的禁带宽度(3.2 eV),使波长在400 nm以上的光能无法被利用,成为限制TiO2光催化应用的重要障碍。Tan等[4]提出一种自掺杂改性方法,使材料形成大量氧缺陷,在可见光范围内具备较强的响应性。另外,TiO2负载金属也是一种有效的改性方法。特别是CuO相对于其他金属氧化物,具备低廉、易制备和对可见光响应能力强的特点。但是通常的催化剂制备方法在高温煅烧过程中,CuO分子团聚现象明显,严重影响催化活性,如浸渍法、沉积沉淀法、气相沉积法等。
金属有机结构MOF材料具有高度有序的柔性拓扑结构,比表面积大,吸附特性强,因此,被广泛应用在吸附剂材料中[5]。Liu等[6]提出一种破坏MOF结构以提高分散度的方法,解决金属氧化物团聚现象严重的问题。
为提高TiO2在可见光波段(>400 nm)的光催化性能,改善CuO团聚严重的现象,本研究提出以Ti3+/TiO2为载体,高温破坏前驱体表面负载的MOF结构(Cu-BTC),从而制备一种改良催化剂Cu-TiMB,用于甲苯的光催化分解。
1 实验部分
1.1 主要原料
Cu(CHOOCH)2·H2O,98.9%;Cu(NO3)2·3H2O,99.9%;H3BTC,99.0%,百灵威科技有限公司;无水乙醇,99.7%;TiO2, 99.0%,天津风船化学试剂科技有限公司。
1.2 催化剂的制备
1.2.1改良方法制备催化剂Cu-TiMB
以锐钛矿TiO2为载体,称取1 g至水热反应釜中,加入3.3 g 均苯三甲酸(H3BTC,BTC= 1, 3, 5-苯甲酸)、20 mL去离子水和5 mL无水乙醇,于100 ℃下加热24 h;冷却后分别水洗、无水乙醇冲洗,80 ℃下烘干4 h,将烘干后的样品粉末于氮气氛围中275 ℃加热1 h,制得表面黏连羧基的TiO2样品粉末。称取1 g该粉末,加入到5 mmol/L的 Cu(CH3COO)2·H2O乙醇溶液中,经搅拌、离心和洗涤后;再浸渍于25 mmol /L 的H3BTC乙醇溶液,搅拌、分离、洗涤和干燥后制得表面负载Cu-BTC的CuBTC-TiO2复合物,记为CuBTC-Ti。在N2氛围下,将CuBTC-TiO2于400 ℃下煅烧2 h,升温速率1 ℃/min,冷却得到中间产物Cu-TiM。取1 g Cu-TiM与0.375 g NaBH4球磨混合30 min,在氮气氛围下10 ℃/min升至350 ℃保持1 h,冷却后依次用蒸馏水和无水乙醇洗涤并干燥,制得黑色最终产物CuO-Ti3+/TiO2,记为Cu-TiMB。
1.2.2浸渍法制备催化剂Cu-TiD
取1 g TiO2和0.3 g Cu(NO3)2·3H2O于烧杯中加入10 mL去离子水,经搅拌、过滤、洗涤后于80 ℃干燥4 h。在马弗炉中,以1 ℃/min的速率升至400 ℃保持2 h,冷却至室温,浸渍法制得催化剂,记作CuO-TiD。
1.3 表征手段
扫描电子显微镜分析(Scanning electron microscope, SEM);全自动微孔物理吸附-脱附分析(Brunauer Emmett Teller, BET);紫外可见漫反射谱分析(UV-vis diffuse reflection spectroscopy, DRS);荧光光谱仪(Photoluminescence spectroscopy, PL);X射线光电子能谱分析(X-ray photoelectron spectroscopy, XPS);差热分析(Differential thermal analysis, DTA);差示扫描量热分析(Differential scanning calorimeter, DSC);电子自旋共振分析(Electron spin-resonance spectroscopy, ESR)。
1.4 可见光脱除甲苯测试
实验气体流量400 mL/min;甲苯初始体积分数8×10-5;可见光条件;300W Xe灯, 滤波片滤掉小于420 nm光线; 固定床流动反应装置示意图见图1。

图 1 固定床流动反应装置示意图
如图1所示,在固定床连续流动反应器中放置100 mg样品,甲苯以40 μL/min的流量经由注射泵注入恒温60 ℃的甲苯蒸气发生装置,并与N2、O2、H2O混合后进入内径6 mm的光照反应器。反应产物由气相色谱(日本岛津公司,GC 2010 Plus)检测分析。色谱条件为:载气N2(99.999%),FID检测器,SH-Rtx-5W/Integra-Guard (30 m, 0.25 mm, 0.25 mm)毛细管柱,柱压166.0 kPa,总流量139.1 mL/min,气化室温度250 ℃,柱温60 ℃,检测器温度200 ℃;升温程序:60 ℃保持1 min,20 ℃/min升到80 ℃,保持2 min;分流比50∶1,氢气流量45 mL/min,空气流量400 mL/min。脱除效率(η)计算如式(1):

(1)
式中,n1为甲苯蒸气的初始浓度,n2为反应后甲苯的浓度。
2 结果与讨论
2.1 XRD分析
图2为样品的XRD谱图。

图 2 样品的XRD谱图
由图2可分析出催化剂合成过程中的晶体变化情况。各样品在25.3°、 37.8°和 48.1°峰位均存在归属于锐钛矿TiO2的峰(JCPDS:010-089-4921)[7],与纯TiO2对比发现,负载Cu后的Cu-TiD在37.8°和 48.1°峰型变缓,说明载体TiO2的结晶度降低而出现无定形态[8]。另外,在35.5°、36.8°和38.6°峰位, Cu-TiD的峰谱上表现出CuO的衍射峰(JCPDS:010-080-1916)[9],而在Cu-TiM样品中未检测到CuO峰,这归因于CuO 在TiO2表面均匀分散[6]。CuBTC-Ti在10°-20°上的一系列峰归属于Cu-BTC[10],说明Cu-BTC成功负载。在Cu-TiMB中出现一些新峰,这些峰归属于Ti0.78O0.937(JCPDS:01-089-3077)[4],同时说明样品中存在Ti不同价态氧化物的异质结构。
2.2 DTG和DSC分析
图3为样品的DTG和DSC谱图。由图3可知催化剂合成过程的成分变化情况。图3(a)中,200 ℃以下的峰归属于催化剂表面吸附的H2O分解。在700-900 ℃,TiO2的DTG曲线上没有明显的峰,因此,其他样品在此温度段的峰是由Cu的负载引起[11]。对比TiO2,其他样品在926 ℃存在微弱的峰,对应于DSC曲线上的吸热峰,如图3(b),是由TiO2在高温下向金红石转变引起[12],这种现象在Cu-TiM中更为明显。结合XRD分析,Cu的负载使TiO2出现无定形状态,在高温下无定形的TiO2向金红石转变[13]。另外发现,随着氧缺陷的增多,Ti3+形式的氧化物热稳定性降低,Cu-TiM的峰位置向温度低的方向偏移。升温过程中,DTA和DSC曲线在281和361 ℃出现的峰属于Cu-BTC结构断裂[14],证明合成过程中,MOF结构存负载到CuBTC-Ti。

图 3 样品的DTG (a)和DSC(b)谱图
2.3 SEM、TEM 和BET分析
SEM照片所示Cu-TiD呈现为粒径较大的球状,如图4(a),TiO2表面堆积大量小颗粒。相反在图4(b),Cu-TiMB中的TiO2颗粒由团聚的球状转变为多孔结构,颗粒体积明显减小。SEM测得样品的颗粒粒径见表1,Cu-TiMB在合成过程中的粒径先增大后减小,说明破坏MOF前驱体是减小粒径的关键步骤。另外,通过SEM测量所得结果,CuO-TiM的颗粒粒径大于Cu-TiMB,说明TiO2失氧过程对晶粒粒径也存在影响。大量的CuO颗粒发生严重的团聚使Cu-TiD的粒径(1.71 μm)明显大于Cu-TiMB的粒径(0.45 μm)。SEM测得粒径是由多个晶粒形成的颗粒,其测量结果可能显著大于实际晶粒粒径。进一步对Cu-TiMB进行TEM测试,具体见图4(c)。观察到照片中Cu-TiMB样品颗粒表面光滑,TiO2表面未形成较大颗粒的CuO。

图 4 Cu-TiD (a), Cu-TiMB (b) 扫描电镜照片和Cu-TiMB (c) 的透射电镜照片

表 1 样品的比表面积、孔容、孔径及SEM平均颗粒粒径
由表1可知,CuO-TiD的比表面积较小,这是由于表面孔隙被团聚的CuO颗粒覆盖。显然,负载MOF结构使比表面积增大;同时颗粒粒径也增大。与浸渍法相比,Cu-TiMB的比表面积增大,说明CuO颗粒未堵塞TiO2表面孔隙,分散度提高。Cu-TiMB比Cu-TiM具有更大的比表面积,这种改变不仅是由CuO分散度的提高引起的,同时与晶格氧损失导致大量氧缺陷的出现有关[15]。
2.4 DRS测试
应用紫外-可见漫反射光谱测试探讨催化剂的间隙宽度和光响应性能,具体见图5。由图5 可知,在300-400 nm,TiO2在该处的吸收峰均弱于其他样品,因此,纯TiO2是一种低光敏度的材料[16]。负载CuO后,材料的DRS曲线均高于TiO2,说明Cu的添加促进紫外光的吸收,并且引起可见光波段的响应。另外发现,可见光下CuBTC-Ti的响应强度低于Cu-TiD,说明Cu-BTC上的Cu元素在可见光下的活性要低于Cu-TiD。同时,Cu-TiM所对应峰强于Cu-TiD,可见光响应程度提高,说明提高分散度有利于光与更多的CuO接触,因此,提高有效活性组分数量。
富含Ti3+的Cu-TiMB对可见光表现出极强的响应能力,根据Eg= 1240 /λg公式计算所得材料禁带宽度(λg为波长),Cu-TiMB禁带宽度为1.36 eV,相比Cu-TiD(2.95 eV)显著减小,因此,改良后的催化剂很好地解决了TiO2宽禁带的问题。
2.5 PL分析
利用荧光光谱PL能够反映Ti、Cu半导体中电荷转移、e--h+寿命以及结构缺陷情况,具体见图6。由图6可知,PL荧光峰主要出现在400和450-500 nm峰位,是由TiO2产生电子到导带引起催化剂表面的e--h+复合[17],但由于TiO2中Ti3+造成的结构缺陷和催化剂中CuO、Cu2O和Ti3+/TiO2构成异质结构形成的势阱可以捕获电子,所以峰强度明显减弱。在TiO2负载Cu后,所有样品的PL强度均低于纯TiO2。材料的荧光强度与e--h+复合速率成正比,电子从价带激发到CuO,然后转移到TiO2的导带,因此,CuO可以有效地抑制TiO2中的e--h+复合。另外CuBTC-Ti相对于纯TiO2的峰强度并没有明显的减弱,说明CuBTC在抑制电子空穴复合方面没有直接贡献,CuBTC上的Cu对催化剂的改善弱于CuO。结合DRS分析,CuBTC对催化剂光性能的改善低于CuO。

图 5 样品的紫外-可见分光光谱谱图

图 6 样品的荧光光谱谱图
2.6 光催化性能测试
在黑暗环境下对样品进行脱除实验,具体见图7。TiO2在无光照环境下对甲苯没有脱除效果,对比CuBTC-Ti在暗环境下的脱除效率(2.72%),结果表明,样品CuBTC-Ti上的MOF多孔结构对甲苯有吸附作用,但由于Cu-BTC的负载量较低,吸附效果有限。

图 7 样品暗实验的脱除效率
图8为各样品对甲苯脱除效率的影响。由图8可知,在20%的O2浓度时,TiO2在可见光下对甲苯脱除能力较弱,其他样品的催化效果均优于TiO2。CuBTC-Ti对甲苯脱除效率与暗环境下结果相近。DRS与PL测试中MOF结构上的金属节点Cu光性能较差,均是造成CuBTC-Ti光催化效果不高的原因。对比团聚严重的Cu-TiD,Cu-TiM的光催化效率由11.31%提高到14.43%,说明提高CuO分散度增加了有效活性位点数量,比表面积的增大为甲苯分子提供更多的反应场所。同时证明了破坏MOF结构而非直接利用这种结构的必要性。可见光照射下,Cu-TiMB催化剂的脱除率是Cu-TiD的2.68倍,显著提高了可见光催化性能。

图 8 样品对甲苯脱除效率的影响
为探究改良催化剂的稳定性,对Cu-TiD和Cu-TiMB分别进行循环实验,结果见图9。经过八次循环后,Cu-TiD和Cu-TiMB的对甲苯的脱除效率均没有明显下降,改良催化剂具有较高的稳定性。

图 9 Cu-TiD和Cu-TiMB的稳定性实验
实验前期,随着O2浓度的增加,甲苯的脱除效率也提高。对于Cu-TiMB,在O2浓度为40%时,甲苯的脱除效率最佳,具体见图10。
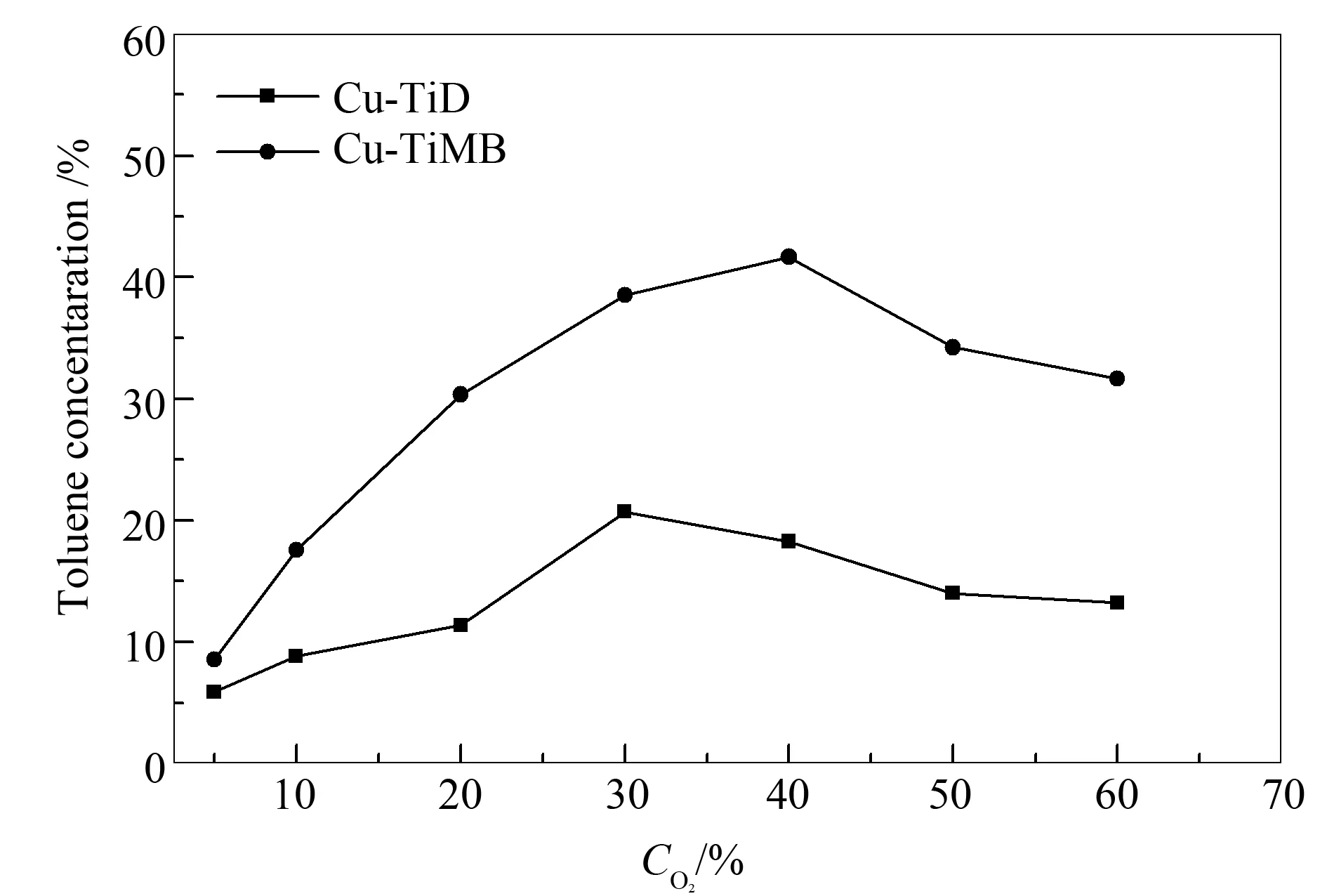
图 10 O2浓度对催化效率的影响
但是,过量的氧不能继续促进光催化反应的进行,由于材料的吸附位数量有限,O2与甲苯气体在催化剂表面也会形成吸附竞争,抑制了催化剂与甲苯接触,从而降低催化效果。Cu-TiD的最佳效率所对应的O2浓度低于Cu-TiMB,是由于Cu-TiD比表面积较小,更加容易达到吸附饱和。
2.7 反应机理讨论
利用电子自旋共振分析可以观测到金属的价态情况,具体见图11。对Cu-TiMB中的Ti进行 ESR表征发现,在g=1.96表现出一个归属于Ti3+的峰[18],空穴位置上的氧捕获电子会在g=2.02表现出信号峰,说明Ti3+存在于催化剂中[19]。

图 11 电子自旋共振谱图
由XPS谱图分析可得样品中金属含成分的价态,具体见图12。由图12可知,Cu 2p3/2拟合所得峰分别归属于Cu2O(931.9和954.3 eV)和CuO(934和953.6 eV)[20]。Cu+所对应的特征峰强于Cu2+,说明 Cu-TiM与NaBH4反应中Cu2+被还原为Cu+。在Cu-TiMB中,Ti 2p3/2在458.4、457.9和457.1 eV处形成三个峰[21],可知样品中Ti4+(458.4 eV)被还原为Ti3+(458.1 eV)[22],而457.1 eV位置的峰可能是其他更低价态的Ti,例如Ti2+[4]。

图 12 反应前后Cu-TiMB的XPS谱图
对比各样品参与光催化甲苯反应前后的价态变化情况可知,反应后的吸附氧(533.2 eV)含量变化显著[23],说明参与光催化反应的主要成分是吸附氧。甲苯在样品表面被催化时,消耗吸附氧Oa而留下更多氧缺位,因此,531.8 eV位置的空穴氧Ov数量[24]增加。反应后离子含量如表2所示,Cu+/Cu2+、Ti3+/Ti4+和Ti2+/Ti3+比值均增加,表明反应中,Cu2+被光照释放电子生成Cu+,Tim转变为Tim-1,金属元素价态的改变使晶格氧OL(529.9 eV) 的含量减少,空穴数量增加,由此得到反应式(2)-(4)。
Tim+/Cu2++e-→Tim-1/Cu+
(2)

(3)

(4)
结果表明,Cu2+和Ti3+在反应中发挥显著的作用。由Cu2+/Cu+与Ti4+/Ti3+的比例变化可知,催化剂中存在多种金属氧化物存在相互转换,可以形成异质结构。


表 2 Cu-TiMB反应前后元素的含量比
3 结 论
改良方法制备催化剂Cu-TiMB具备良好的形貌特征,CuO颗粒分散度提高,比表面积和孔径均优于浸渍法所得催化剂。在紫外光波段的响应得到加强,禁带宽度由2.95 eV缩短到1.36 eV,可见光响应非常强烈;材料的荧光强度显著降低,合成过程中,催化剂表面部分Cu2+被还原为Cu+,与Ti3+结合形成更多的异质结构,Ti3+富含的氧缺陷与异质结构对抑制e--h+复合作用明显。可见光照射Cu-TiMB对甲苯的脱除率是Cu-TiD的2.68倍;O2浓度影响实验表明,过量的O2会抑制光催化反应,脱除效率最佳O2浓度为40%。研究发现甲苯光催化反应机理:氧缺陷增强捕获吸附氧能力,通过金属氧化物价态变化提高化学吸附能力,增强光化学性能。
