PD-1通路在咪喹莫特诱导的银屑病小鼠免疫细胞中的作用
2019-03-06薛潇春胡晋红
薛潇春,刘 芳,胡晋红*
(1.海军军医大学长海医院药学部,上海 200433;2.解放军第四五五医院药剂科,上海200052)
程序性死亡受体1(programmed death 1,PD-1)是主要表达在淋巴细胞上的共抑制受体[1]。活化的T细胞通过PD-1与两个特异性的配体——程序性死亡配体1(programmed death ligand 1,PD-L1)及PD-L2结合,从而使T细胞失去活性、耗竭或凋亡[2]。银屑病是活化的免疫细胞浸润到皮肤后,引起表皮增生的慢性炎症性疾病。研究发现,咪喹莫特(imiquimod,IMQ)诱导小鼠产生银屑病时,PD-1抗体组较未加阻断的小鼠皮损症状加重,而PD-1敲除小鼠的皮损程度也较野生型小鼠严重[3]。重组 PD-L1蛋白可减轻银屑病样小鼠皮损及炎症情况[4]。这些研究都表明PD-1/PD-L1通路在银屑病的发生发展中起着重要作用。
目前仅知银屑病病人表皮角质形成细胞表达的PD-L1下调[5],外周血单核细胞表达的PD-1上调[6],其他免疫细胞中PD-L1和PD-1的表达未知。本研究用IMQ诱导银屑病小鼠模型,研究PD-1/PD-L1信号通路在银屑病免疫细胞中的作用,探讨该通路作为药物靶点治疗银屑病的可行性。
1 材 料
1.1 仪器和试药 流式细胞仪(美国Beckman Coulter公司)。IMQ乳膏(12.5 mg∶250 mg,新加坡INOVA 制药有限公司);pH 7.4磷酸盐缓冲液(PBS,上海博光生物科技有限公司);红细胞裂解液(上海碧云天生物技术有限公司);40 μm细胞滤网(美国Corning公司); APC-anti-rat IgG2a kappa isotype control、FITC-anti-Armenian hamster IgG isotype control、FITC-anti-mouse CD11c、FITC-anti-mouse CD3、APC-anti-mouse B220 (美国BioLegend公司);PE-anti-rat IgG2b kappa isotype control、PE-anti-mouse PD-L1、APC-anti-mouse CD4、PE-anti-mouse PD-1 (美国eBioscience公司)。
1.2 动物 8周龄BALB/c小鼠,雌雄各半,购自昭衍(苏州)新药研究中心有限公司,实验动物许可证号:SCXK(苏)2018-0006。实验前,小鼠饲养于SPF级动物房内1周,使其适应环境。动物饲养期间,提供啮齿类动物标准饮食,室温18~25℃,湿度40%~70%,并确保12 h明暗周期。本方案遵守动物保护、动物福利及动物伦理的相关规定。
2 方 法
2.1 动物分组及处理 使用脱毛膏彻底清除小鼠背部毛发,再用温水洗净小鼠背部皮肤。16只小鼠采用随机数字表法分为对照组和模型组,每组8只。银屑病小鼠模型的构建:小鼠背部皮肤均匀涂抹62.5 mg IMQ乳膏,轻轻按摩皮肤以促进药物吸收,每天给药一次,连续6 d,第7 天造模完成[7]。对照组将IMQ乳膏换成凡士林,采用同样的处理方法。小鼠于第7天取外周血,并处死取脾脏备用。
2.2 小鼠外周血免疫细胞的制备与处理 取EDTA抗凝的小鼠血400 μl,加入4 ml红细胞裂解液,轻轻吹打混匀。再次加入4 ml红细胞裂解液重复以上操作后,将所得细胞重悬,经40 μm细胞滤网过滤。取滤液于4 ℃下500×g离心5 min,弃去上清,将细胞重悬于 100 μl PBS中。依次加入流式抗体0.5 μl FITC-anti-mouse CD11C, 1.25 μl APC-anti-mouse B220, 0.5 μl PE-anti-mouse PD-L1或2 μl FITC-anti-mouse CD3, 1 μl APC-anti-mouse CD4, 2.5 μl PE-anti-mouse PD-1进行混合染色。同型对照组中加入相应的同型对照抗体用于流式检测时的电压调节。暗处放置30 min,加入PBS洗涤两次后,用流式细胞仪检测。
2.3 小鼠脾脏细胞的制备与处理 取小鼠新鲜脾脏,研磨过40 μm细胞滤网,所得细胞中加入5倍体积的红细胞裂解液。裂解2 min后,加入2倍体积的PBS稀释,4 ℃下500×g离心5 min。弃去上清,将所得的细胞重悬于PBS中,通过40 μm细胞滤网过滤两次,确保获取单细胞悬液后进行多色染色,染色方法同2.2项。细胞染色后,用流式细胞仪检测蛋白质表达。
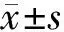
3 结 果
3.1 IMQ诱导的银屑病模型小鼠皮肤及脾脏变化 连续给药6 d后,对照组小鼠皮肤光滑完整,未有异常变化。模型组小鼠背部皮肤出现明显的鳞屑、红斑、增生等银屑病样症状(见图1 A),表明造模成功。同时,模型组小鼠脾脏明显变大(见图1B)。
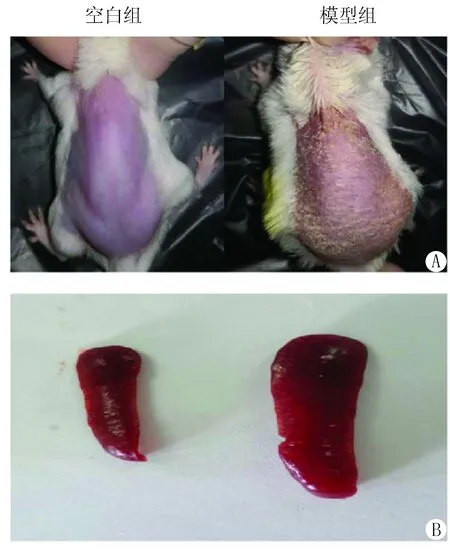
图1 咪喹莫特诱导的银屑病样小鼠模型的特点Figure 1 Characteristics of imiquimod-induced psoriasis-like mouse modelA:皮肤表征;B:脾脏形态
3.2 小鼠脾脏细胞中PD-1的表达 用平均荧光强度表示PD-1在小鼠脾脏细胞中总的表达量。结果模型组中PD-1的表达量较对照组高(见图2A)。由于银屑病是辅助性T细胞分泌IL-17A相关的炎症性疾病,因此进一步研究了CD3+CD4+辅助性T细胞表面PD-1的表达。结果显示,模型组小鼠脾脏辅助性T细胞的比例下调,但其表达的PD-1却显著上调(P<0.01),见图2B、2C。
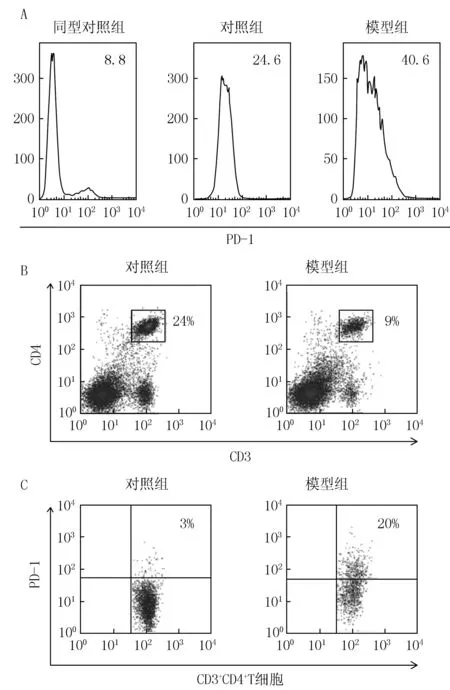
图2 用流式细胞术检测小鼠脾脏辅 助性T细胞表面PD-1的表达结果Figure 2 Dectection results of the expression of PD-1 in T helper cells in the spleen of mice by flow cytometryA:小鼠脾脏细胞中PD-1总的表达量(右上角的数值表示平均荧光强度);B:脾脏中辅助性T细胞的百分比;C:脾脏辅助性T细胞中PD-1的百分比
3.3 小鼠脾脏树突状细胞(DC)中PD-L1的表达 模型组小鼠脾脏中PD-L1的表达显著高于正常组(P<0.01),见表 1。由于银屑病T细胞的活化有赖于DC,特别是浆细胞样树突状细胞(pDC)分泌的炎症因子刺激,因此本研究还检测了脾脏中DC及pDC细胞上PD-L1的表达。结果表明,模型组小鼠不仅DC细胞及pDC细胞比例较对照组高(P<0.01),且PD-L1的比例也上调,具体见表1。
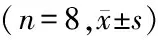
表 1 小鼠脾脏树突状细胞中PD-L1的表达Table 1 Expression of PD-L1 in dendritic cells of the murine spleen

组别细胞含量DC(%)pDC(‰)PD-L1阳性比总的PD-L1(‰)DC中(%)pDC中(%)对照组4±12±111±215±318±6模型组14±1∗ ∗6±1∗ ∗74±4∗ ∗45±2∗ ∗52±7∗ ∗
* *P<0.01,与对照组比较;PD-L1:程序性死亡配体1;DC:树突状细胞;pDC:浆细胞样树突状细胞
3.4 小鼠外周血中PD-1的表达 模型组小鼠外周血总PD-1的表达量高于正常组(见图 3A),这与脾脏细胞测定结果一致。与脾脏细胞测定结果不同的是,模型组小鼠外周血中CD3+CD4+辅助性T细胞的比例及其表达的PD-1较对照组显著下调(P<0.01),具体见图 3B、3C。
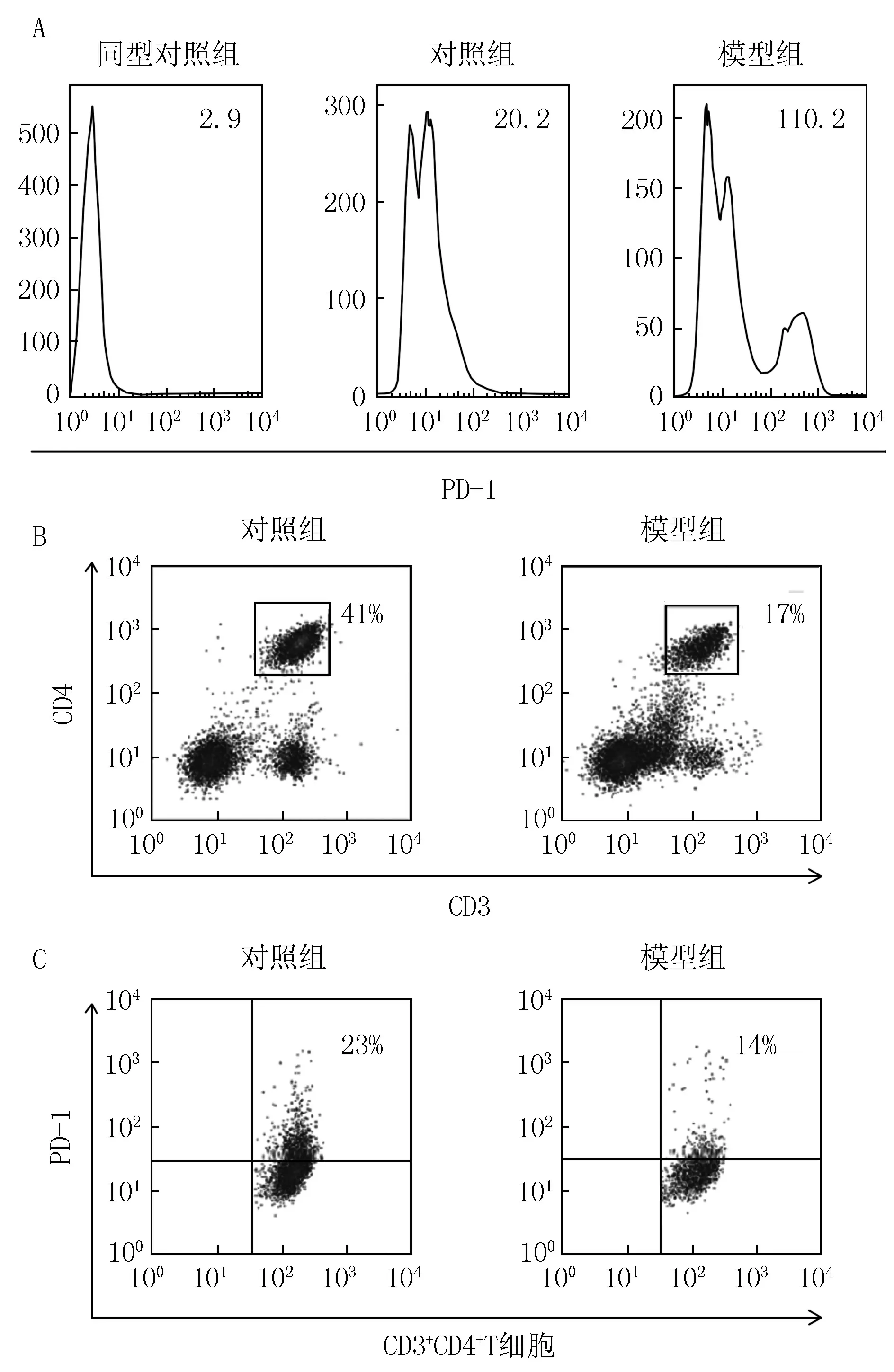
图3 用流式细胞术检测小鼠外周血中PD-1的表达结果Figure 3 Dectection results of the expression of PD-1 in murine peripheral blood by flow cytometryA:外周血细胞中PD-1总的表达量(右上角的数值表示平均荧光强度);B:外周血中辅助性T细胞的百分比;C:外周血中辅助性T细胞中PD-1的百分比
3.5 小鼠外周血中PD-L1的表达 对照组小鼠外周血细胞中PD-L1阳性比为(9±1)%,较脾脏(11±2)‰显著增加(P<0.01)。模型组小鼠外周血PD-L1表达较对照组增加,DC细胞比例上调,DC细胞上PD-L1的表达增加(见表 2),这与脾脏细胞的测定结果一致。不同的是, pDC细胞比例上调,但其表达的PD-L1却降低了(P<0.01)。
4 讨 论
PD-1在组织特异性的免疫疾病中发挥调节作用,PD-1缺陷会引起小鼠发生自身免疫性疾病[8]。慢性炎症性疾病中常见PD-1的高表达,阻断PD-1后,炎症反应会扩大化,相反,当使用其配体PD-L1后,会减轻疾病的炎症程度[9]。PD-1的分布和数量可用来区分Sézary综合征和红皮病型炎症性皮肤病,CD4+T细胞上PD-1的表达>50%,表明病人得的是Sézary综合征[10]。口腔扁平苔藓的角质细胞中PD-L1上调,阻断PD-L1后T细胞的增殖增加[11]。以上研究均表明,PD-1/PD-L1通路在慢性炎症性疾病及自身免疫性疾病中有着重要的作用。
表 2 小鼠外周血树突状细胞中PD-L1的表达Table 2 Expression of PD-L1 in dendritic cells in the peripheral blood of mice
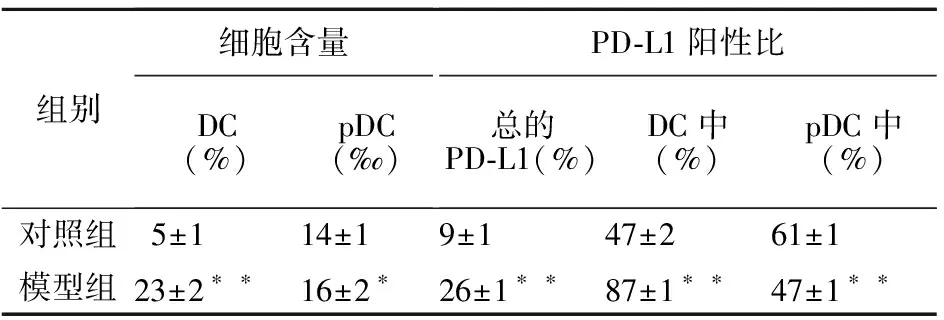
组别细胞含量DC(%)pDC(‰)PD-L1阳性比总的PD-L1(%)DC中(%)pDC中(%)对照组5±114±19±147±261±1模型组23±2∗ ∗16±2∗26±1∗ ∗87±1∗ ∗47±1∗ ∗
*P<0.05,**P<0.01,与对照组比较;PD-L1:程序性死亡配体1;DC:树突状细胞;pDC:浆细胞样树突状细胞
银屑病是免疫介导的慢性炎症性疾病。PD-1/PD-L1通路在银屑病中发挥保护性作用。肿瘤病人经PD-1抗体nivolumab治疗后可诱发银屑病样不良反应[12]。扁桃体间充质干细胞(tonsil-derived mesenchymal stem cells,T-MSCs)缓解小鼠银屑病样症状与PD-L1相关,加入PD-L1抗体后,T-MSCs的治疗作用明显减弱[13]。Kim等[4]通过免疫荧光的方法,发现在银屑病病人皮损的真皮上部广泛表达PD-1,而健康人皮肤上少见。皮损处,70%的T细胞表达PD-1,少量的自然杀伤细胞也表达PD-1。进一步研究发现,超过95%的IL-17A+T细胞表达PD-1,并且IL-17A+PD-1+T细胞为CD4+T细胞和γδ+T细胞。该结果表明,靶向PD-1可抑制IL-17A+PD-1+T细胞,用于治疗银屑病的炎症反应[4]。
本研究通过流式细胞术,检测IMQ诱导的银屑病小鼠和正常小鼠脾脏、血液中PD-L1、PD-1的表达,进一步探讨PD-1/PD-L1通路在银屑病中的作用。结果表明,相对正常小鼠,IMQ诱导的小鼠无论是脾脏还是血液中PD-L1及PD-1的表达都增加。这可能因为T细胞在接受连续或重复性的刺激后,其PD-1的表达增加[9]。而银屑病相关的T细胞,尤其是辅助性T细胞在脾脏与血液中PD-1的表达完全相反。银屑病小鼠血液中辅助性T细胞表达的PD-1下调,使PD-L1与PD-1结合变少,辅助性T细胞失活减少,分泌IL-17A增多,从而引起一系列炎症反应。同时,在总PD-L1上调的趋势下,血液中pDC细胞表达的PD-L1下调,可能对疾病也有影响,因为pDC可通过PD-L1抑制CD4+T细胞的活力[14]。
总之,本研究发现银屑病小鼠外周血pDC细胞中PD-L1表达下调和辅助性T细胞中PD-1下调在银屑病发生过程中可能起重要作用。两者的下调影响了PD-1/PD-L1通路在银屑病中的正常功能。结合银屑病皮损角质形成细胞PD-L1表达下调,重组PD-L1蛋白可缓解银屑病小鼠的炎症症状,提示可以从纠正角质形成细胞、血液pDC细胞中PD-L1的表达,及辅助性T细胞中PD-1的表达出发,选择合适的PD-1通路药物治疗银屑病。
