基于液相色谱-质谱联用技术探索胃癌的糖肽生物分子标志物
2019-03-06范国荣
杨 楠,范国荣
[1.海军军医大学药学院药物分析学教研室,上海市药物(中药)代谢产物研究重点实验室,上海 200433;2.海军青岛特勤疗养中心药剂科,山东青岛 266072;3.同济大学医学院药物代谢和药代动力学研究实验室,上海 200092;4.上海交通大学附属第一人民医院临床药学科,上海 200080]
胃癌是全球致死率最高的恶性肿瘤之一,严重影响人类健康[1]。临床数据显示,对早期胃癌病人进行手术治疗,其5年存活率>85%,而在进展期手术5年生存率仅约40%[2]。因此,采取有效检测手段进行早期诊断对胃癌的治疗尤为重要。研究表明,癌细胞在机体内的迅速增殖、转移与扩散都与癌细胞膜上的糖链形成有关[3,4]。在特定的状态下,糖蛋白量的变化和/或其糖链结构的改变,能够体现特定的生理、病理过程[5,6]。迄今为止,已经有多种癌症被证实与糖基化的异常变化有关,例如肝癌、肺癌、胰腺癌、乳腺癌和卵巢癌等[7,8]。因此应用糖组学技术分析癌症病人糖基化的变化对于深入研究肿瘤发生机制以及临床早期诊断至关重要[9]。Lebrilla教授的课题组基于UPLC-QqQ-MS/MS技术建立了定量测定人血清中免疫球蛋白IgG、IgA和IgM,以及所含N-糖肽的方法[10,11],采用nano-LC-Chip-QTOF对人血清中免疫球蛋白IgG、IgA和IgM,标准品中胰蛋白酶酶解后的肽段和糖肽进行定性分析,从而确定IgG、IgA和IgM中能够用来定量的肽段。选择用于绝对定量的肽段需要具备以下条件:(1)唯一性,用来进行定量研究的肽段不能出现在血清的其他蛋白质中;(2)避免选择包含翻译后修饰的多肽,例如磷酸化和甲基化的多肽,以减少样品间的差异;(3)避免选择包含经过了去氨基或者氧化后的氨基酸,因为这些变化一般不完全,并且会在样品处理中发生变化。借鉴上述研究,本研究仅选择了具有高重复性的多肽用于定量,采用UPLC-QqQ-MS/MS法对胃癌与胃炎病人血清中免疫球蛋白IgG、IgA和IgM,以及所含N-糖肽进行定量测定,通过统计分析,试图找到两者之间具有显著性差异的N-糖肽分子标志物,为胃癌诊断提供参考。
1 材 料
1.1 仪器 1290 Infinity 超高效液相色谱仪、串联6490三重四级杆质谱仪、Agilent Eclipse plus C18色谱柱(美国Agilent公司);高速冷冻离心机(美国Eppendorf公司);恒温培养箱、涡旋混合器(美国Thermo Scientific公司);恒温水浴锅(美国PolyScience公司);微量电子天平(美国Mettler Toledo公司)。
1.2 试剂和药品 人免疫球蛋白IgG标准品、人免疫球蛋白IgM标准品、人混合血清标准品、碘代乙酰胺(IAM)、碳酸氢铵、Sigma血清(美国Sigma-Aldrich公司);人免疫球蛋白IgA标准品(美国Cal Biochem公司);二硫苏糖醇(DTT)、胰蛋白酶(美国Madison公司);乙腈(色谱纯,美国Honeywell公司);甲酸(色谱纯,美国Thermo Fisher公司);去离子水为实验室用Mili-Q系统(美国Millipore公司)自制。
1.3 生物样品 所有血清样品均来自墨西哥城综合医院胃肠病科,对血清样品的使用已获病人的知情同意,该研究在美国加州大学戴维斯分校分析化学实验室完成。
2 方 法
2.1 实验设计 墨西哥城综合医院胃肠病科先后提供了两批胃癌与胃炎病人混合样品,第一批样品共138个,其中胃癌血清样品92个,胃炎血清样品46个,作为第一组;另外一批样品共38个,其中胃癌血清样品12个,胃炎血清样品26个,作为第二组。基于建立的免疫球蛋白及N-糖肽测定方法,同时处理并测定两组血清中免疫球蛋白IgG、IgA和IgM的蛋白质与N-糖肽,通过JMP Pro 11统计软件对第一组数据进行独立样本t检验,找到胃炎与胃癌病人血清中有显著性差异的蛋白质与N-糖肽,作为潜在的胃癌生物标志物。将这些潜在的生物标志物应用于第二组,通过R Language软件进行最小二乘法(partial least squares,PLS)分析,观察潜在的分子标志物对胃炎与胃癌病人的分离情况。
2.2 样品前处理
2.2.1 标准曲线样品前处理 分别吸取20 μl IgG、IgA、IgM标准溶液(即100 μg IgG、20 μg IgA和20 μg IgM),加入50 mmol/L新鲜配制的碳酸氢铵缓冲液18 μl,然后加入4 μl的550 mmol/L的DTT溶液,使蛋白质中二硫键断裂。60 ℃水浴中反应50 min;再加入8 μl的450 mmol/L的IAM溶液,室温下避光反应30 min,使断裂后的巯基甲基化,防止二硫键形成。将20 μg胰蛋白酶溶于200 μl新鲜配制的50 mmol/L碳酸氢铵缓冲液中,摇匀,取20 μl加入蛋白溶液中进行酶解,在37 ℃保温箱中反应18 h,然后将标准品置于-20 ℃冰箱中放置1 h,结束酶解反应,配置成浓度为0.009、0.018、0.09、0.18、0.45、0.9 μg/ml的IgG系列标准曲线工作液,浓度为0.001 8、0.003 6、0.018、0.036、0.09、0.18 μg/ml的IgA系列标准曲线工作液,以及与IgA相同浓度的IgM系列标准曲线工作液,用于进样分析。
2.2.2 实测样品前处理 吸取2 μl血清样品置96孔板中,每10个样品穿插一个Sigma血清。向血清样品中添加92 μl的50 mmol/L碳酸氢铵缓冲液,然后加入2 μl的550 mmol/L DTT,涡旋1 min,60 ℃水浴中反应50 min。向样品中加入4 μl的450 mmol/L IAM,涡旋1 min(速度7档),室温条件下避光放置30 min,调节pH至7.5。向20 μg的胰蛋白酶中加入200 μl的50 mmol/L碳酸氢铵缓冲液,向每个血清样品中加入10 μl的0.1 μg/μl胰蛋白酶,置37 ℃干燥的恒温箱中反应18 h。以相对离心力4.472×102×g离心1 min,然后置-20 ℃冰箱 1 h停止反应,用于进样分析。
2.3 N-糖肽生物分子标志物的定性和定量检测
2.3.1 液相色谱条件 Agilent Eclipse plus C18色谱柱(2.1 mm×100 mm,1.8 μm),柱温35 ℃,流速0.5 ml/min,分析时间10 min,进样量1 μl。流动相组成为A相:乙腈∶甲酸∶水=3∶0.1∶97(V/V/V),B相:乙腈∶甲酸∶水=90∶0.1∶10(V/V/V),采用梯度洗脱。血清中IgG和N-糖肽定量洗脱梯度设置如下:0~2.5 min 2%~5%B,2.5~7.0 min 5%~40%B,7.0~7.1 min 40%~100%B,7.1~8.6 min 100%B,8.6~8.7 min 100%~2%B,8.7~10.0 min 2%B。血清中IgA与IgM及N-糖肽定量洗脱梯度设置如下:0~0.5 min 2%B,0.5~4.0 min 2%~15%B,4.0~8.0 min 15%~44%B,8.0~8.1 min 44%~100%B,8.1~9.5 min 100%B,9.5~9.6 min 100%~2%B,9.6~10.0 min 2%B。
2.3.2 质谱条件 正离子模式;雾化气温度:290 ℃;氮气流量:11 L/min;氮气压力:206.85 kPa(30 Psi);鞘气温度:300 ℃;鞘气流速:12 L/min;毛细管电压:1800 V;电喷雾电压:1500 V。
2.3.3 IgG、IgA与IgM蛋白质定量监测通道 对IgG进行蛋白质定量时,选择DTLMISR肽段建立多反应监测(MRM)方法,其母离子为[M+2H]2+(m/z418.3),m/z506.3与m/z619.4作为定量反应的子离子。对IgG四个亚型在质谱中的裂解规律进行分析,确定IgG亚型的MRM定量方法的离子通道如下。IgG1:[M+2H]2+m/z839.4→m/z968.5与m/z1 067.6;IgG2:[M+3H]3+m/z970.1→m/z1 100.6与m/z839.5;IgG3:[M+3H]3+m/z472.9→m/z697.4与m/z534.3;IgG4:[M+3H]3+m/z635.0→m/z1 217.6与m/z425.2。所有IgG肽段的MRM裂解离子通道、保留时间和裂解电压见表1。对IgA进行蛋白质定量时,离子通道为[M+2H]2+m/z448.7→m/z620.3和[M+2H]2+m/z607.4→m/z914.5。经过对IgA两个亚型在质谱中的裂解规律进行分析,确定IgA亚型的MRM定量方法的离子通道如下。IgA1:[M+2H]2+m/z466.3→m/z415.8与[M+2H]2+770.9→m/z475.3。IgA2:[M+3H]3+m/z756.9→m/z475.3。对IgM进行蛋白质定量时,离子通道为[M+2H]2+m/z639.4→m/z331.2与[M+2H]2+m/z573.0→m/z734.9,J chain蛋白质定量的离子通道为[M+2H]2+m/z695.3→m/z971.5与[M+2H]2+m/z469.8→m/z613.3。所有IgA和IgM肽段的MRM裂解离子通道、保留时间和裂解电压见表2。
2.3.4 IgG、IgA与IgM糖肽定量监测通道 由于糖肽的碎片离子中都包含m/z204.08 和m/z366.14,因此从中选择响应更高的离子作为糖蛋白的子离子。在IgG的四种亚型中,IgG3和IgG4连接N-糖链的肽段是由相同的氨基酸组成(IgG3:EEQYNSTFR,IgG4:EEQFNSTRY),相对分子质量相同,因此IgG3和IgG4上的糖肽区分不开,而IgG1和IgG2连接N-糖链的肽段氨基酸组成不同(IgG1:EEQYNSTYR,IgG2:EEQFNSTFR), 因此可以对IgG1和IgG2上的糖肽分别进行定量。在液相色谱串联四极杆飞行时间质谱分析中,IgA与IgM中的理论N-糖基化位点并未完全被N-糖基化;在IgA1中,N-糖基化现象仅在N144上发现,其定量肽段为LSLHRPALEDLLLGSEANLTCTLTGLR;IgA2的N-糖链位于N131与N205上,其定量肽段分别为LSLHRPALEDLLLGSEANLTCTLTGLR和TPLTANITK。由以上分析结果可知,IgA1上的N144与IgA2上的N131糖肽一致,区分不开,因此对该糖肽进行定量分析时,需要首先对IgA进行归一化,再进行定量比较。IgM的N-糖基化出现在N46、N209和N439上,定量糖肽分别为YKNNSDISSTR、GLTFQQNASSMCVPDQDTAIR和STGKPTLYNVSLVMSDTAGTCY;J链的N71糖基化位点位于肽段ENISDPTSPLR上。
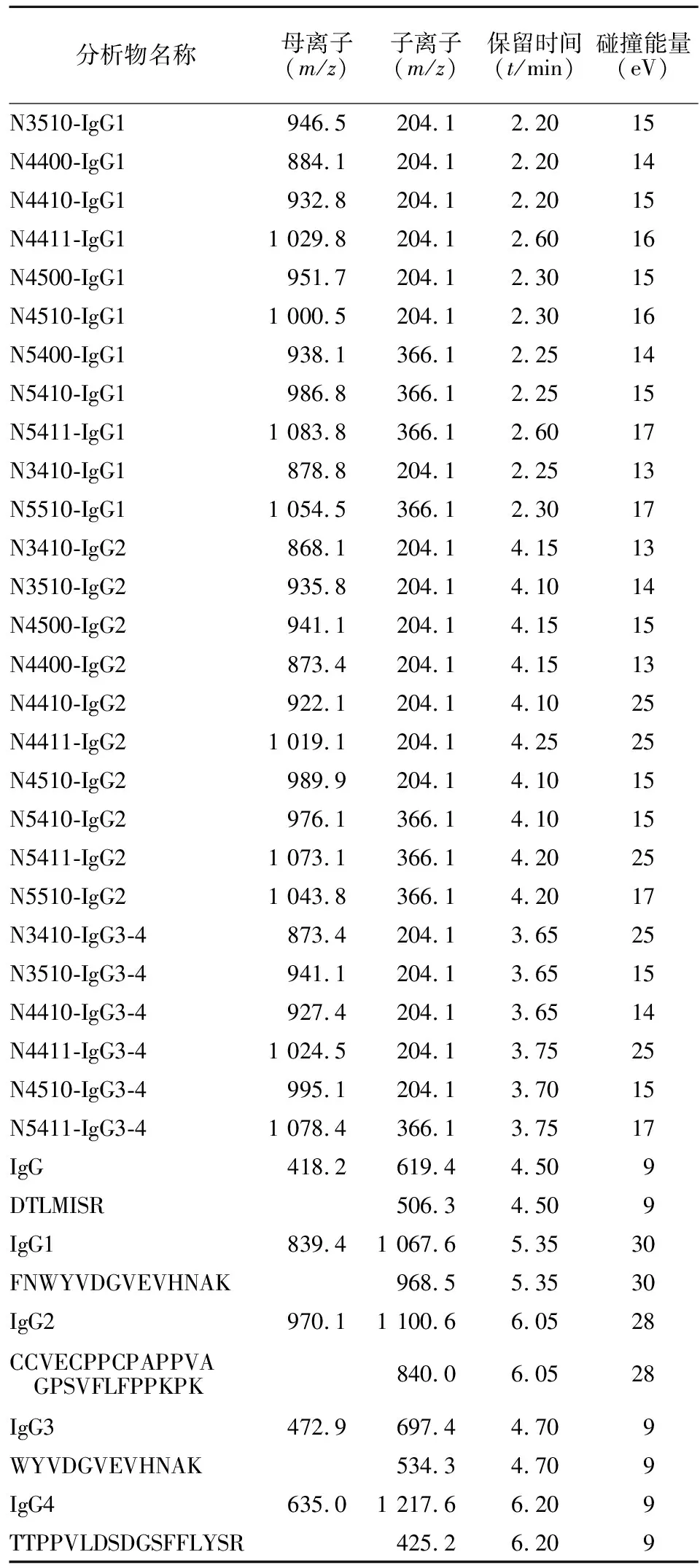
表1 IgG蛋白质及糖肽多反应监测离子通道Table 1 MRM transitions for quantitative analysis of IgG and its N-glycopeptides
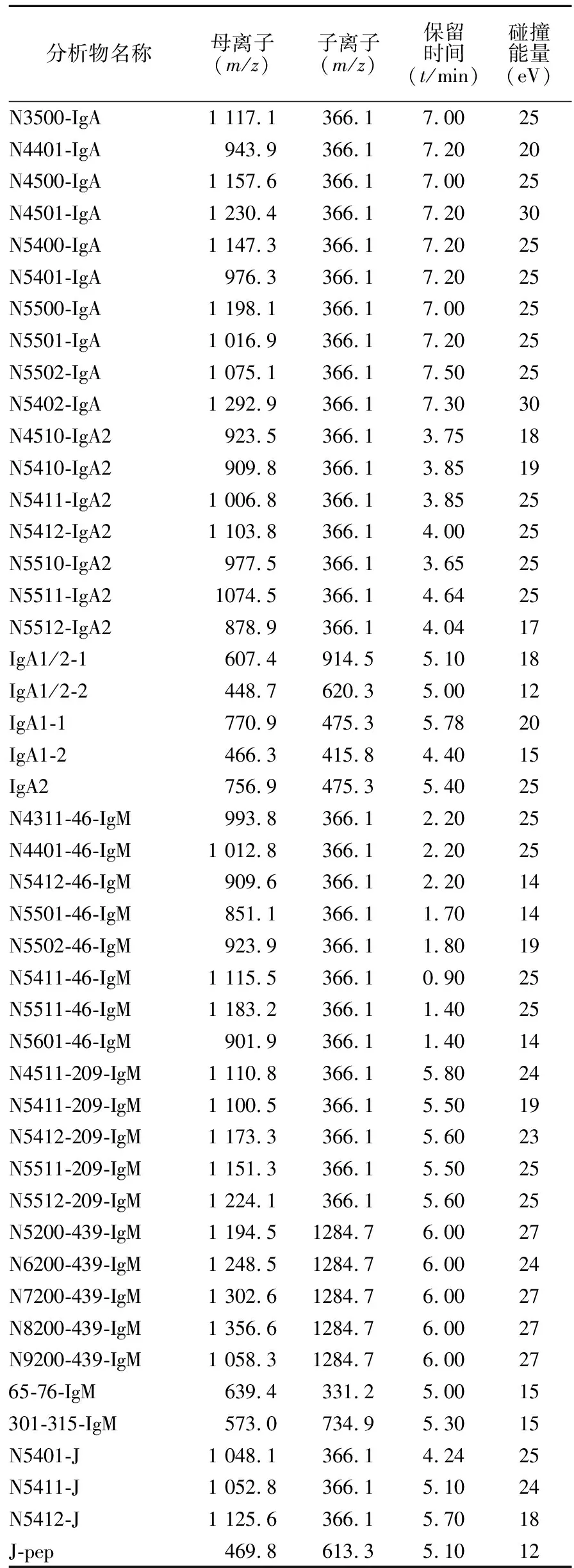
表2 IgA和IgM蛋白质及糖肽多反应监测离子通道Table 2 MRM transitions for quantitative analysis of IgA,IgM and N-glycopeptides
2.4 数据处理 采用Agilent MassHunter Quantitative Analysis B.6.0软件对MRM采集数据进行计算,将计算所得数据用JMP Pro 11和R Language软件进行统计分析。采用Agilent应用软件计算结果时,需要对进行统计分析的N-糖肽进行筛选,若一种N-糖肽测得的色谱图<总量的70%,则不对其进行统计分析。采用JMP Pro 11软件中的独立样本t检验进行统计分析,以P<0.05表示具有显著性差异。
3 结 果
3.1 IgG、IgA与IgM蛋白质测定的随行标准曲线 通过UPLC-QqQ-MS/MS对IgG、IgA与IgM不同浓度的标准溶液工作液进行定量测定,以峰面积(A)对相应浓度(c)进行1/X加权,再做线性回归。得到IgG的随行标准曲线为A=5.599×105c+9.023×103(r=0.995 1),IgA随行标准曲线为A=6.030×105c-2.084×103(r=0.996 9),IgM随行标准曲线为A=7.278×105c-3.657×103(r=0.998 4)。3种免疫球蛋白的标准曲线线性良好。
3.2 定量测定重现性考察 本研究采用的前处理方法重现性良好,RSD<15%(n=21)。对于样品测定过程中仪器稳定性的考察,响应信号重现性良好,RSD<13%(n=20)。
3.3 胃癌潜在生物标志物研究 采用JMP Pro 11软件对第一组数据进行独立样本t检验,试图找到胃癌组与胃炎组之间具有显著性差异的N-糖肽。通过对IgG中5种蛋白质和27种N-糖肽进行统计分析,找到3个具有显著性差异的N-糖肽,这3种N-糖肽都位于IgG1亚型上,而胃癌病人与胃炎病人血清中IgG及4种亚型的含量并无显著性差异。通过对IgA中3种蛋白质和17种N-糖肽进行统计分析,也找到3个具有显著性差异的N-糖肽,这3种N-糖肽都位于N144-IgA1/N131-IgA2亚型,而胃癌病人与胃炎病人血清中IgA及两种亚型的含量并无显著性差异。通过对IgM及其J链中2种蛋白质及17种N-糖肽进行统计分析,仅发现1个具有显著性差异的N-糖肽,这种N-糖肽位于N46-IgM上,胃癌病人与胃炎病人血清中IgM及其J链含量并无显著性差异。
在IgG1中N4400、N5400和N4410具有显著性差异,且胃癌病人血清中这3种N-糖肽的含量较胃炎病人明显降低。在IgA中具有显著性差异的N-糖肽N3500、N5400和N5402含量均为胃癌病人体内较低,这3种N-糖肽并没有明显的分类规律,其中IgG和IgA中的N5400在胃癌和胃炎病人中的含量均表现出显著性差异;在IgM及其J链中,只有N5501的含量在胃癌病人和胃炎病人之间表现出显著性差异,在胃癌病人体内含量降低。根据上述分析结果,得出以下结论:IgG、IgA和IgM蛋白质定量测定在胃癌病人和胃炎病人血清中并无发生显著性变化,而N-糖肽的含量却在疾病变化过程中发生显著性变化,并且变化趋势一致,即在胃癌病人中普遍呈现降低趋势。对于N-糖肽的糖链结构而言,并没有表现出非常明显的类别规律,但是可以看出,含量具有显著性差异的N-糖肽在糖链结构上都含有至少4个N-乙酰葡萄胺(GlcNAc)。由此推断,随着胃癌的发生与发展,胃癌病人体内GlcNAc酶的合成或活性受到了抑制。
3.4 胃癌潜在生物标志物验证 进一步将第一组研究中发现的潜在胃癌N-糖肽标志物应用于第二组血清样本的分析,采用R Language软件中的PLS法进行统计分析,考察本方法中发现的潜在N-糖肽标志物是否能够将胃癌组与胃炎组分离。在分析过程中,将潜在的N-糖肽生物标志物按归属分为以下6组, PLS统计分析结果见图1。 图1中蓝色代表胃炎组,红色代表胃癌组,数字为血清编号。由图1可见,仅采用IgG1或IgA上的潜在的生物标志物进行PLS分析,胃癌病人与胃炎病人并没有显示出较好的分离趋势(见图1A、B);同样,将IgM中的糖肽生物标志物与IgG1或IgA联用进行PLS分析也没有得到良好分离趋势(见图1C、D);而将IgG1与IgA上潜在的生物标志物联用,或者IgG1、IgA与IgM上潜在的生物标志物联用进行PLS分析,则可以发现胃癌病人与胃炎病人已经出现了分离的趋势(见图1E、F)。
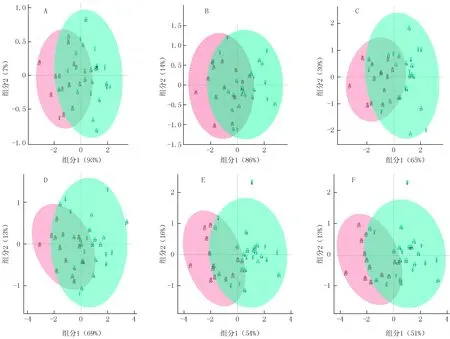
图1 胃癌和胃炎病人血清中N-糖肽生物标志物区分情况的最小二乘法统计分析图Figure 1 Partial least square analysis of the differentiation of N-glycopeptide >biomolecular markers in serum of patients with gastric cancer and gastritisA:N4400-IgG1、N5400-IgG1和N4410-IgG1;B:N3500-IgA、N5400-IgA和N5402-IgA;C:N4400-IgG1、N5400-IgG1、N4410-IgG1和N5501-J;D:N3500-IgA、N5400-IgA、N5402-IgA和N5501-J;E:N4400-IgG1、N5400-IgG1、N4410-IgG1、N3500-IgA、N5400-IgA和N5402-IgA;F:N4400-IgG1、N5400-IgG1、N4410-IgG1、N3500-IgA、N5400-IgA,N5402-IgA和N5501-J;○:胃癌;●:胃炎
综上所述,本研究通过对胃癌与胃炎病人血清中免疫球蛋白IgG、IgA、IgM蛋白质及N-糖肽进行定量分析,寻找胃癌病人血清中潜在的生物标志物。研究结果表明,胃癌病人与胃炎病人血清免疫球蛋白中的确可以找到具有显著性差异的N-糖肽N4400-IgG1、N5400-IgG1、N4410-IgG1、N3500-IgA、N5400-IgA、N5402-IgA和N5501-J,这些糖肽含量在胃癌病人体内较低,所有具有显著性差异的N-糖肽在糖链结构上都含有至少4个GlcNAc。由此可以初步推断,随着胃癌的发生与发展,胃癌病人体内GlcNAc酶的合成或活性受到了抑制。进一步运用潜在的N-糖肽对病人血清样品进行分析,可以看出,采用以上N-糖肽对胃癌病人与胃炎病人血清进行PLS统计分析,虽然没有完全分离,但是表现出一定的分离趋势。该方法为临床疾病生物分子标志物的发现提供了有力的支持,且可能对胃癌的早期诊断具有一定的临床意义。
