人巨细胞病毒活动性感染与自然流产的相关机制研究
2019-03-05赵卫东周荣生
柯 旭,赵卫东,李 静,周荣生
自然流产( spontaneous abortion)为孕妇妊娠不满28周、胎儿体重不足1 kg时自然终止的妊娠[1]。近年来,研究[2-3]显示妊娠早期流产的病因十分复杂,除了遗传因素、感染、内分泌、生殖器官结构异常等病因外,仍有近半数的自然流产无法查出病因。目前,临床中对于自然流产的原因尚不十分清晰。病原体感染是自然流产的重要因素之一,有文献[4-5]报道主要已知的病原体感染如单纯疱疹、人支原体、弓形虫、巨细胞病毒(cytomegalovirus, cMV))等均与流产有关。人巨细胞病毒(human cytomegalovirus, HCMV)是造成宫内感染的主要病毒[6]。越来越多的研究[7]表明,自然流产孕妇的HCMV感染率明显高于正常孕妇。但目前HCMV导致宫内感染及引起自然流产的具体机制和途径尚不清楚。已有研究[8]表明,免疫应答能够激活外周血单核细胞中的HCMV,诱发自身免疫性疾病的发生。该研究通过检测62例自然流产孕妇的外周血,探讨HCMV活动性感染与自然流产关系机制,进一步为临床治疗预防流产提供新的思路。
1 材料与方法
1.1病例资料
1.1.1病例组 根据如下纳入和排除标准收集来合肥市第三人民医院就诊的自然流产孕妇62例作为病例组,所有研究对象符合2004年《妇产科学》的诊断标准[9];病例组年龄为21~34(26.47±7.43)岁,孕周为7~14周,平均孕周(10.65±3.62)周;纳入标准:① 病例组孕妇经临床检查,均符合2004年《妇产科学》的诊断标准[9];② 孕妇生殖器结构正常,无染色体异常和内分泌疾病;③ 孕妇和家属了解本研究内容,签署知情同意书。排除标准:① 因生殖器结构异常、遗传因素、内分泌因素造成的自然流产患者;② 恶性肿瘤患者;③ 孕期曾使用过导致胚胎异常的药物;④ 由于各种原因难以配合研究进行的患者。根据cMV-IgM的检测结果对自然流产孕妇进行分组。其中,cMV-IgM阳性患者为HCMV活动性感染组,cMV-IgM阴性患者为HCMV非活动性感染组。
1.1.2对照组 选择同期体检正常孕妇51例作为对照组。对照组年龄为22~34(26.68±7.32)岁,孕周为7~15周,平均孕周(10.73±3.27)周。研究对象的主要基线指标如年龄、孕周等,经检验两组基本平衡(P>0.05),具有可比性。
1.2方法
1.2.1标本采集 抽取所有孕妇的清晨空腹静脉血4 ml,分为两管,每管2 ml。其中一管加入溶血试剂,待提取全血DNA。另一管,静置5 min后,进行4 ℃离心,2 000 r/min离心15 min,留取上清液保存备用。
1.2.2检测方法
1.2.2.1抽提全血DNA进行HCMV-DNA表达水平检测 采用酚氯仿抽提法提取全血DNA,PCR体外扩增HCMV-DNA,PCR反应采用Tap DNA聚合酶,扩增片段430 bp,操作完全按照实际说明书进行。全血DNA的抽提步骤如下:① 全血1 300 r/min离心15 min;② 将上层白细胞吸到1.5 ml离心管中,加灭菌过的纯水至1.5 ml刻度,4 ℃、4 000 r/min离心15 min;③ 去上层血清,加无菌水1 ml溶血;④ 4 ℃、3 500 r/min离心10 min,重复3次;⑤ 加TES 720 μl,RNAase A 5 μl,室温静置20 min(消化RNA);⑥ 加入蛋白酶K(10 mg/ml)15 μl,56 ℃消化3~4 h,直至没有肉眼可见的悬浮物;⑦ 加入等体积(740 μl)酚,翻转10 min混匀;15 000 r/min离心15 min,吸取上层水相640 μl;⑧ 加入等体积(640 μl)酚,翻转10 min混匀;15 000 r/min离心15 min,吸取上层水相520 μl;⑨ 加入等体积(520 μl)酚-氯仿-异戊醇,翻转10 min混匀;17 000 r/min离心15 min,吸取上层水相400 μl;⑩ 加入3 mol/L 乙酸钠(pH 5.2)40 μl(1/10体积),加入880 μl(两倍体积)的无水乙醇(-20 ℃预冷),翻转20次混匀,出现白色絮状DNA沉淀。4 ℃、15 000 r/min离心10 min,小心倒掉上清液,在吸水纸上扣干残液;加入70% 乙醇1 ml重悬沉淀,4 ℃、15 000 r/min离心5 min,小心倒掉上清液,在吸水纸上扣干残液,用无菌棉签擦拭离心管内壁,勿碰到DNA沉淀;打开管盖,室温静置3 min,加纯水40 μl,用移液枪吹洗5次混匀,室温静置10 min;测定浓度和A260/A280,-20 ℃保存。
1.2.2.2ELISA法检测血清中cMV-IgM、 肿瘤坏死因子α(tumor necrosis factor α, TNF-α)、白介素-1(interleukin-1,IL-1)、IL-6的表达水平 另一管外周血进行血清中cMV-IgM、TNF-α、IL-1、IL-6表达水平检测,采用ELISA法进行检测(试剂盒购自美国Genzyme公司)。ELISA法步骤如下:从4 ℃冰箱中取出人IL-1、IL-6和TNF-α ELISA检测试剂盒,放在室内待其温度与室内温度达到平衡。配置不同浓度的标准品:向试剂盒中冻干标准品的试管加入1 ml的标准品及样品稀释液,室温静置10 min,待标准品冻干粉充分溶解后,轻轻摇匀即可得到浓度为1 000 pg/ml的标准品。将1 000 pg/ml的标准品在严格灭菌且无内毒素的试管进行倍比稀释。稀释成浓度依次为0、15.63、31.25、62.5、125、250、500、1 000 pg/ml。将浓缩洗涤液、生物素化抗体和辣根过氧化物酶结合物稀释成工作液,放置室温中待用,同时将血清样本放置室内平衡至室温。本实验中设置标准孔、待测样本孔、空白孔,待测样本孔中加入样本稀释液100 μl,标准孔和待测样本孔需要添加对应的样品100 μl,而空白孔中需要加对照样品,轻轻摇晃使其混匀。用覆膜将酶标板覆盖,放温箱中37 ℃孵育60 min。温箱取出酶标板,弃去液体,洗板机洗板5次,洗板结束后轻轻拍干使其没有残留的液体。每孔中加入稀释后的酶结合物工作液100 μl,然后加上覆膜,恒温箱37 ℃孵育30 min。温箱取出酶标板,弃去液体,洗板机洗板5次,结束后轻轻拍干使其没有残留的液体。TMB底物溶液按每个孔都要加入100 μl,37 ℃恒温箱显色15 min。最后加入反应终止液每孔50 μl,停止反应,这时由蓝色立即转化成了黄色,每个待测样本重复3孔,在450 nm波长处测量每个样本对应3孔的吸光度(optical density, OD)值,取平均值并保存数据。
1.3病理染色收集组织固定于福尔马林中,再流水冲洗过夜,经过脱水包埋,制成石蜡组织块,再进行组织切片、脱蜡水化、染色,最后进行脱水、透明、封片、拍照。通过HE染色观察组织情况。HE染色步骤如下:① 将已入蒸馏水后的切片放入苏木精水溶液中染色20 min;② 酸水及氨水中分色,10~15 s;③ 流水冲洗1 h后入蒸馏水2 min;④ 入70%和90%酒精中脱水各10 min;⑤ 入酒精伊红染色液染色2~3 min;⑥ 纯酒精脱水,二甲苯透明,树胶封固。

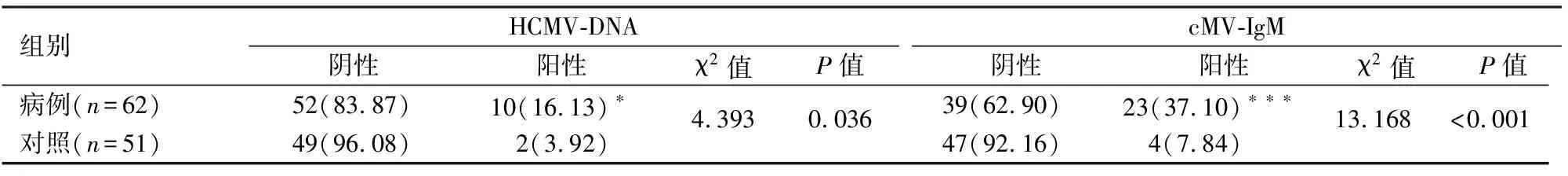
表1 病例组与对照组HCMV-DNA和cMV-IgM水平比较[n(%)]
与对照组比较:*P<0.05,***P<0.001
2 结果
2.1病例组与对照组HCMV-DNA和cMV-IgM水平比较病例组HCMV-DNA的阳性率(16.13%)高于对照组(3.92%),差异有统计学意义(P<0.05);cMV-IgM的阳性率(37.10%)也高于对照组(7.84%),差异有统计学意义(P<0.001)。见表1。
2.2病例组与对照组炎性细胞因子水平比较病例组与对照组炎性细胞因子TNF-α、IL-1、IL-6水平水平进行比较,结果显示:病例组患者的血清TNF-α、IL-1、IL-6水平明显高于对照组,差异有统计学意义(P<0.001)。见表2。

表2 病例组与对照组炎性细胞因子水平比较
与对照组比较:***P<0.001
2.3HCMV活动性感染组与非活动性感染组炎性细胞因子水平比较根据检测结果将流产孕妇分为HCMV活动性感染组与非活动性感染组,比较两组炎性细胞因子TNF-α、IL-1、IL-6水平的差异,结果显示:活动性感染组的血清TNF-α、IL-1、IL-6水平明显高于非活动性感染组,差异有统计学意义(P<0.001)。见表3。
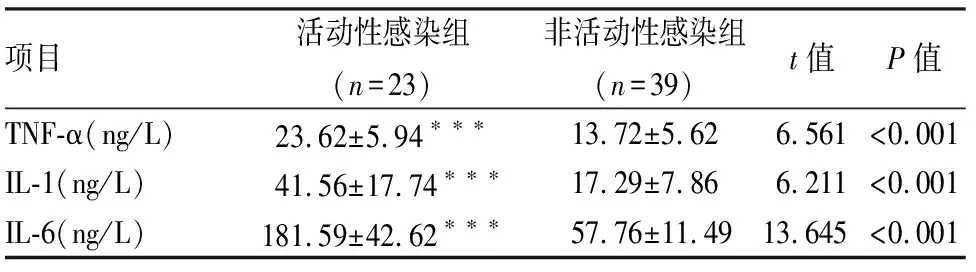
表3 HCMV活动性感染组与非活动性感染组炎性细胞因子水平比较
与HCMV非活动性感染组比较:***P<0.001
2.4血清TNF-α、IL-1、IL-6水平与HCMV感染相关性的Logistic回归分析以两组孕妇资料为样本,以是否有HCMV活动性感染为应变量,并赋值1=有此感染,0=否。建立非条件Logistic回归模型。以血清TNF-α、IL-1、IL-6水平为自变量,并在回归前均行两分类转化(转化及赋值方法:1=≥对应指标的两组总均值,0=<对应指标的两组总均值)。回归过程采用后退法(α退出=0.05),以进行自变量的选择和剔除。回归结果显示:TNF-α、IL-1、IL-6等三指标均被保留入回归方程,其OR值均>1,P<0.05,提示该三指标(升高)均为HCMV活动性感染的危险影响因素。回归结果见表4。
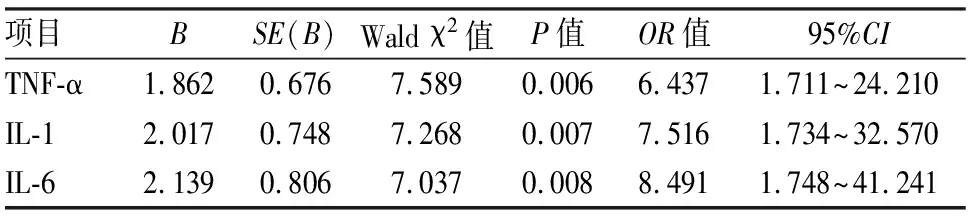
表4 血清TNF-α、IL-1、IL-6水平与HCMV活动性感染的Logistic回归分析
2.5HCMV感染表达阳性病理图示例HCMV感染表达阳性的病理见图1A~1D。图1A组织取自蜕膜,可见组织中大量中性粒细胞浸润,伴微小脓肿形成;图1B组织取自绒毛,间质纤维组织轻度增生,绒毛间隙见出血,周围滋养层细胞萎缩;图1C组织取自蜕膜,可见蜕膜组织退变坏死;图1D组织取自绒毛,呈现间隙明显出血,绒毛体积小,周围滋养层细胞萎缩。HCMV感染表达阴性的病理见图1E、1F。图1E、图1F组织均取自绒毛,镜下可见正常绒毛及滋养层细胞,绒毛间质无水肿及纤维化,间隙无出血及炎细胞浸润。
3 讨论
HCMV属于疱疹病毒科β亚科,广泛存在于人体中并能引起人体的多种疾病[7]。与其他疱疹病毒一样,HCMV感染会在宿主体内的白细胞、唾液腺等处建立持续终身的潜伏感染,然而,该类感染对健康人体并没有危害。但是,HCMV感染对免疫功能低下的个体,如胎儿、婴幼儿、器官移植患者、艾滋病患者、干细胞治疗患者以及使用免疫抑制剂的患者均可造成致死性损伤[5,10]。HCMV是目前已知引起孕妇和胎儿宫内感染的最常见、危害最大的一种病毒[11]。妊娠妇女感染HCMV是导致妊娠不良结局的重要因素之一[4-5]。HCMV可通过胎盘致使胎儿宫内感染,导致胎儿宫内发育迟缓、胎儿智力和听力受损、死胎、流产、早产、畸形、新生儿死亡等。目前,HCMV病毒感染引起流产已然引起了广泛的重视。
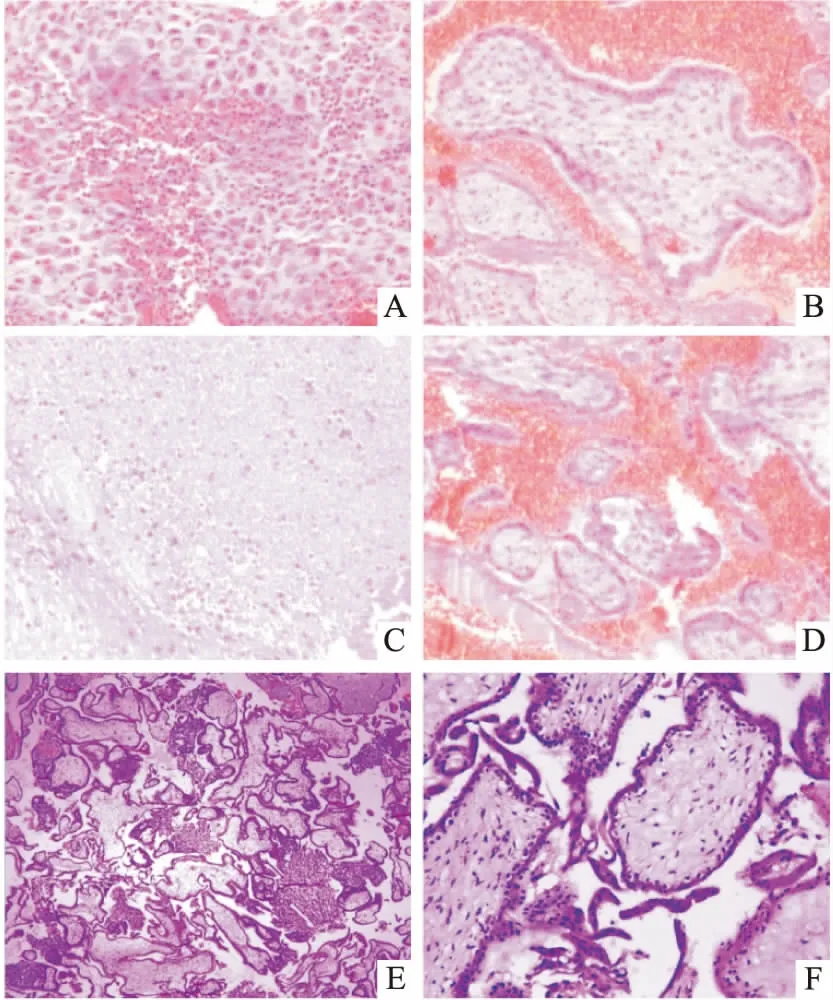
图1 HCMV感染表达阳性病理图及阴性对照示例(HE染色)
然而,关于HCMV活动性感染导致孕妇流产的具体机制尚需不清楚。近年来,cMV感染作为一类全身感染性疾病,已被列为性传播疾病,HCMV的感染可因妊娠免疫力低下而激活[12]。研究[13]表明,正常妊娠期间,母体机体处于免疫抑制状态,辅助型T细胞2型(helper T cell 2, Th2)免疫应答具有优势,而HCMV感染可以调控转录因子GATA-3(GATA结合蛋白3)和T-bet(T- box基因家族转录因子)的表达,使GATA-3上调,T-bet下调,促进Th2型细胞的分化从而进一步抑制免疫功能。TNF-α是HCMV感染的免疫反应中的关键因子,可以激活病毒基因转录,活化HCMV增强子,上调HCMV基因表达,继而促进一系列细胞因子分泌[12]。
本研究通过收集自然流产孕妇和同期体检正常孕妇的外周血并进行相关检测,结果表明:自然流产孕妇的HCMV-DNA和cMV-IgM的阳性率显著高于对照组;自然流产孕妇血清中的炎性细胞因子TNF-α、IL-1、IL-6的表达水平均显著提高,说明自然流产孕妇存在着HCMV活动性感染。研究[14]显示,免疫应答能够激活外周血单核细胞中的HCMV,诱发自身免疫性疾病的发生,感染HCMV的孕妇会出现原因不明的复发性流产,诱发其自身出现免疫性疾病,需要采用免疫治疗的方法进行治疗。在妊娠过程中,细胞因子充当重要的辅助作用,当其含量出现异常时则表现为病理妊娠。IL-1、IL-6、TNF-α均与感染性疾病相关,过量的分泌将导致机体的免疫损伤。本研究对比了自然流产患者中HCMV活动性感染组与非活动性感染组的TNF-α、IL-1、IL-6表达水平差异,结果显示上述炎性细胞因子在HCMV活动性感染组患者的水平明显高于非活动性感染组,证明血清中TNF-α、IL-1、IL-6的表达水平与自然流产存在密切关联,是HCMV活动性/自然流产状态的危险影响因素。
综上所述,HCMV活动性感染会抑制孕妇免疫功能,促使宫内感染,与孕妇自然流产关系密切。本研究将为阐明HCMV感染引起自然流产提供理论依据,同时,为临床治疗预防流产提供新的视角。
