HK2在肝癌中的差异表达及其对肝癌细胞的影响
2019-03-05张宇,蒙轩,王勋
张 宇,蒙 轩,王 勋
肝细胞癌(hepatocellular carcinoma,HCC)是一种临床上高死亡率的原发性肝癌[1-2]。癌细胞的失控生长是癌症高致死率的主要原因,探讨肝癌发生发展分子机制,寻找肝细胞癌恶性增殖的生物标志和干预治疗靶点,已成为近年来肝癌研究的热点[3]。研究[4]表明己糖激酶(hexokinase, HK)是生物糖酵解途径限速酶,己糖激酶2(HK2)与诸多恶性肿瘤发生存在关系。目前HK2与肝癌发生发展的关系少见报道,通过高通量测序发现其可能高表达,但缺乏深入的研究[5]。该研究旨在探讨HK2在肝癌中的表达特点并分析其表达与临床特征参数的关系,检测其对人肝癌高转移细胞株HepG2细胞增殖、周期、凋亡的影响。
1 材料与方法
1.1组织样本及主要试剂
1.1.1病例资料及实验细胞 选取2015年6月~2018年10月中国人民解放军总医院肝胆外科、中国人民解放军第302医院肝胆外科肝细胞肝癌手术患者,共计48例,取肝癌组织(非坏死区肿瘤组织)及癌旁组织(距肿瘤边缘2 cm肝硬化组织,约0.5 cm×0.5 cm×0.5 cm)。所有新鲜组织获取后立即转入液氮固定。人肝癌高转移细胞株HepG2细胞购自北京协和基础研究所细胞中心 。
1.1.2主要试剂 蛋白提取RIPA裂解液、BCA蛋白浓度测定试剂盒、SDS-PAGE凝胶配制试剂、细胞周期检测碘化丙啶染色试剂购自江苏碧云天公司;细胞转染试剂Lipo 3000购自美国Invitrogen公司;Annexin V-FITC/PI双染细胞凋亡检测试剂盒购自江苏凯基生物公司;HK2抗体、GAPDH抗体购自英国abcam公司。
1.2方法
1.2.1免疫组化检测肝癌组织HK2表达量 所有组织标本(48例肝癌组织,48例癌旁组织)常规甲醛固定及石蜡包埋,将蜡块切成5 um厚的组织切片,覆盖于预先经过防脱处理的载玻片上,经过烤片、水化、抗原修复,分别滴加一抗和二抗,DAB显色,中性树胶封片。光学显微镜拍照,采用IPP软件对图片进行积分光密度(integrated option density,IOD)值。
1.2.2HK2 shRNA载体构建 设计并合成4对小发卡RNA(short hairpin RNA, shRNA)序列,分别命名为shRNA_1、shRNA_2、shRNA_3、shRNA_4,其序列见表1。克隆连接实验室改造的pLKO.1-GFP质粒。测序验证后,转染至HepG2细胞。

表1 4对候选HK2 shRNA序列
1.2.3Western blot检测HK2表达 收集人正常肝细胞L-02、人肝癌细胞HepG2;以及control RNA、shRNA_1、shRNA_2、shRNA_3、shRNA_4组HepG2细胞,RIPA细胞蛋白裂解液提取蛋白,BCA法用于蛋白定量。SDS-PAGE凝胶电泳后NC膜恒流湿法进行转膜。转膜成功的NC膜转移到5%脱脂奶粉-TBST封闭液于室温封闭l h。再将NC膜分别加入稀释的HK2和GADPH一抗,4 ℃轻摇过夜;随后加入相应的二抗(1 ∶100稀释),37 ℃恒温摇床孵育1 h。蛋白的相对表达量用待测蛋白与GADPH的灰度值比值计算。
1.2.4MTT法检测细胞增殖 将空白组(正常培养、未转染质粒)、control shRNA组(转染control shRNA)、HK2 shRNA组(转染shRNA_3)HepG2细胞稳定培养后传代于96孔板,完全培养基培养,分别于第0、24、36、72小时进行MTT检测。每组4个复孔。96孔板每孔加入20 μl MTT(5 mg/ml PBS溶解),孵育4 h然后弃除上清液。每孔里面再加入150 μl Formazan溶解液,振荡10 min,充分溶解结晶物。酶标仪(570 nm)测定吸光度(optical density, OD)值。
1.2.5流式细胞仪检测细胞周期 各组细胞完全培养基培养,用胰酶消化收集细胞,加入1 ml 75%预冷乙醇中,吹打均匀,4 ℃固定12 h以上,再加入PBS洗涤,1 000 r/min离心5 min,清洗2次。重悬细胞用0.5 ml PBS,每孔加入PI和 RNaseA至终浓度50 μg/ml,37 ℃温浴30 min。流式细胞仪检测细胞周期。
1.2.6Annexin V-FITC/PI双标记法检测细胞凋亡 收集各组细胞,置于100目铜网上轻搓,生理盐水冲洗,2 500 r/min离心弃去上清液及细胞碎片,收集细胞悬液。参照Annexin V-FITC/PI双染细胞凋亡检测试剂盒说明,通过流式细胞仪进行分析。

2 结果
2.1HK2在肝癌中差异表达免疫组化结果显示:相对于癌旁组织,HK2在肝癌组织中表达显著升高;IOD值量化结果表明肝癌组织中HK2相对表达值为(643.00±79.17),癌旁组织中HK2相对表达值为(441.80±31.32),差异有统计学意义(P<0.05),见图1A。Western blot结果显示:相对于人正常肝细胞L-02,HK2在人肝癌细胞HepG2中表达显著升高;灰度值量化结果表明L-02细胞HK2相对表达值为(1.08±0.14),HepG2中HK2相对表达值为(1.46±0.18),差异有统计学意义(P<0.05),见图1B。
2.2HK2表达与肝癌临床病理特征关系48例肝组织中HK2表达与患者性别、年龄、血清甲胎蛋白(alpha-feto protein, AFP)含量、乙肝表面抗原(Hepatitis B surface antigen, HBsAg)感染差异无统计学意义(P>0.05),与肿瘤直径、TNM分期、组织病理分级差异有统计学意义(P<0.05),见表2。
2.3HepG2细胞中HK2沉默表达与效率评价Western blot检测HK2 shRNA_1、shRNA_2、shRNA_3、shRNA_4转染HepG2细胞后HK2蛋白表达情况:HK2 shRNA_3沉默效率最佳,其HK2蛋白表达均显著低于control shRNA组。建立稳定转染的细胞株HK2 shRNA、control shRNA,荧光显微镜检测转染效率,用于后面实验检测。见图2。
2.4沉默HK2表达对肝癌HepG2细胞增殖的影响MTT法检测各组细胞增殖活性:48 h起,HK2 shRNA组细胞增殖活性明显低于control shRNA组和空白组,72 h时差异有统计学意义(F=55.6,P<0.01),空白组HepG2细胞和control shRNA组细胞增殖活性差异无统计学意义(P>0.05),见图3。表明HK2表达的降低可显著降低HepG2细胞增殖活性。
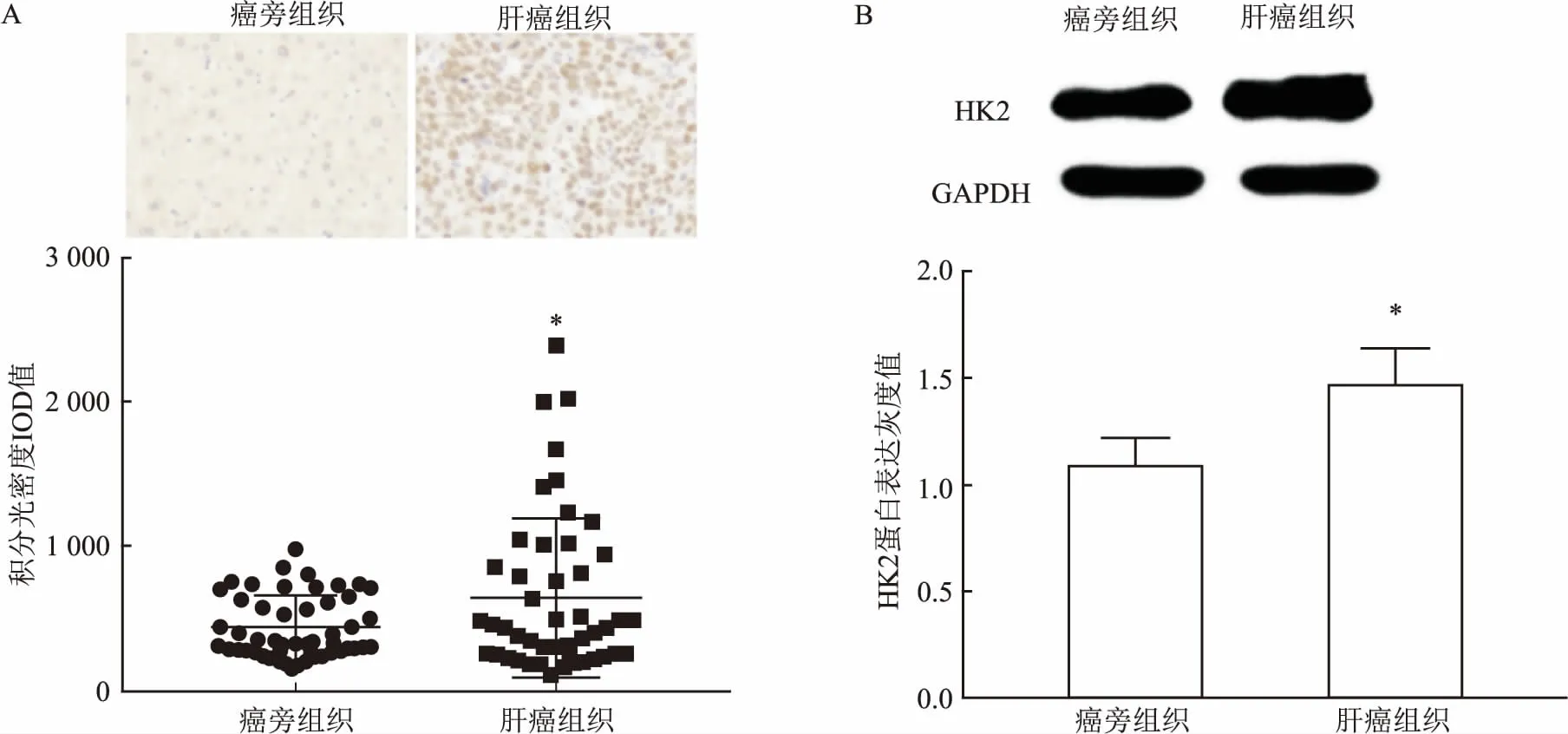
图1 HK2在肝癌中差异表达
2.5沉默HK2表达对肝癌HepG2细胞周期的影响流式细胞仪检测各组细胞周期:HK2 shRNA组、control shRNA组、空白组S期细胞百分比分别为(24.48%±4.25%)、(32.32%±3.98%)、(38.68%±5.17%),经单因素方差分析,组间差异有统计学意义(F=7.51,P<0.05)。表明HK2 shRNA组细胞更少停滞在S期,细胞周期发生明显转变,见图4。
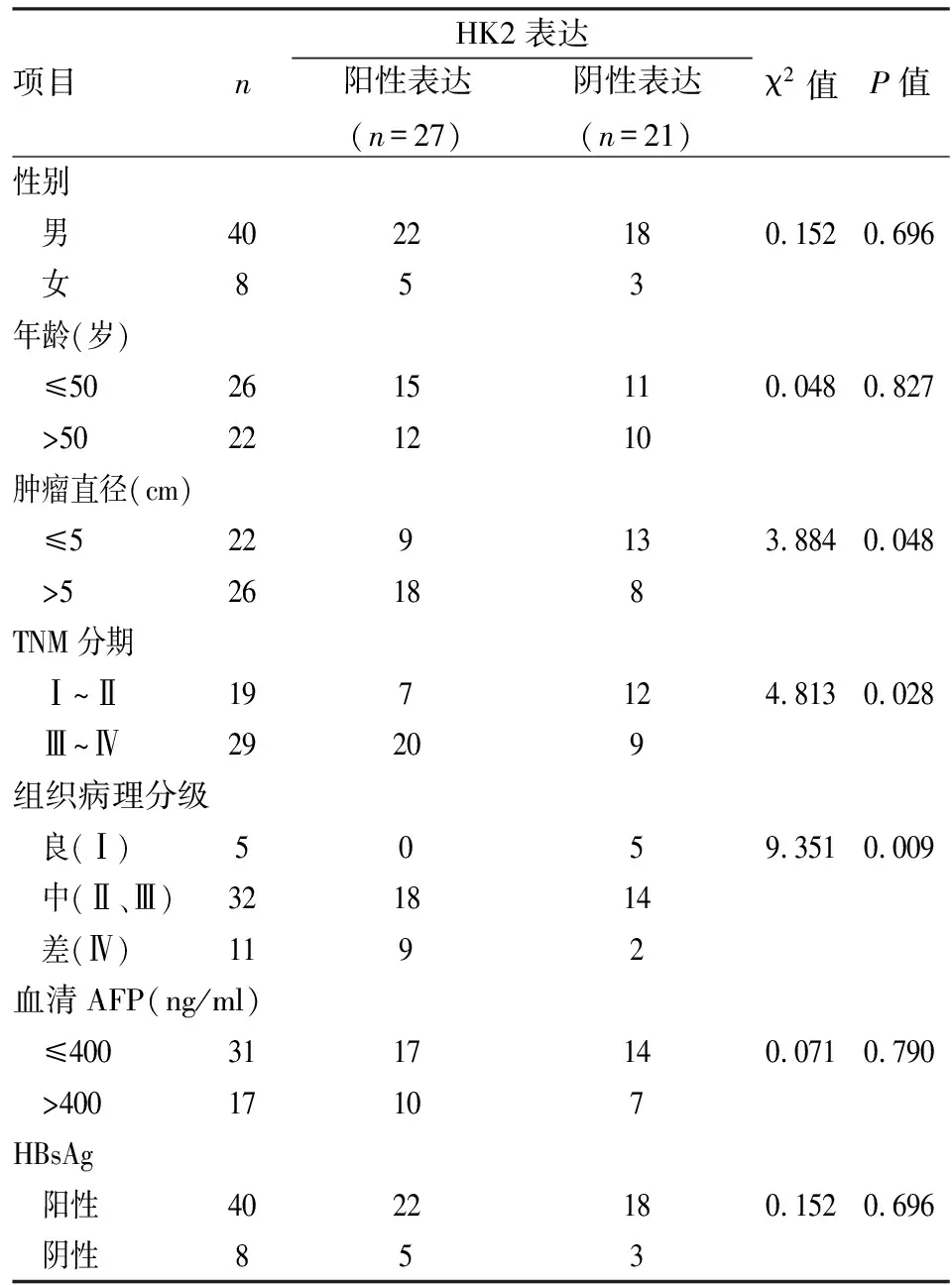
表2 HK2表达与肝癌临床病理特征关系(n)
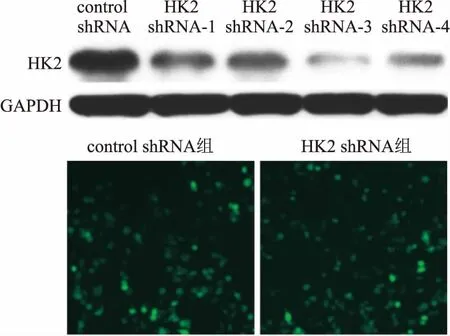
图2 HepG2细胞中HK2沉默表达与效率评价
2.6沉默HK2表达对肝癌HepG2细胞凋亡的影响Annexin V-FITC/PI双标记法检测各组细胞凋亡:HK2 shRNA组、control shRNA组、空白组的细胞总凋亡率分别为分别为(17.74±2.67)%、(8.97±1.02)%、(6.83±0.95)%,经单因素方差分析,组间差异具有统计学意义(F=33.16,P<0.01)。HK2表达的降低可显著升高HepG2细胞凋亡率,且与control shRNA组相比差异有统计学意义(P<0.01),空白组HepG2细胞和control shRNA组细凋亡率差异无统计学意义(P>0.05),见图5。提示HK2可能通过抑制凋亡促进肿瘤生长。
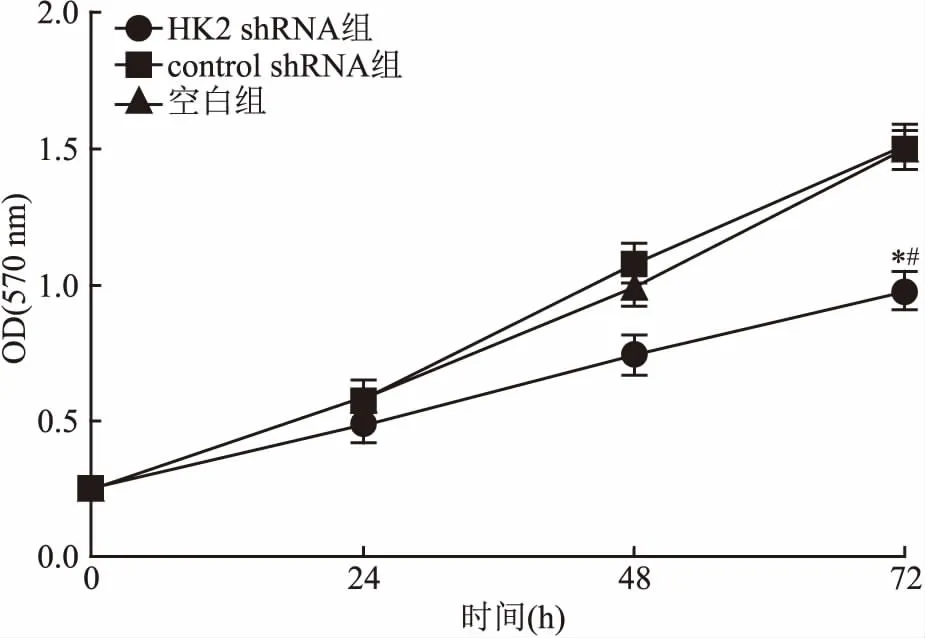
图3 沉默HK2表达对肝癌HepG2细胞增殖的影响
与空白组比较:*P<0.05;与control shRNA组比较:#P<0.05
3 讨论
HK2作为机体糖酵解途径的第一个关键限速酶,其与线粒体外膜电压依赖性阴离子通道蛋白相结合促进糖酵解的发生和肿瘤细胞的形成[6],HK2在肿瘤发生进展中的作用及如何抑制HK2成为了当前研究的热点。研究[7]表明HK2的表达与喉鳞癌肿瘤部位、临床分期有关,在声门上型喉鳞癌标本中HK2多呈高表达,而在声门型喉鳞癌中多呈中到低度表达,HK2表达随肿瘤分期的升高而增加。此外,多项研究[8-9]表明应用HK2抑制剂如3-溴丙酮酸(3-Bromopyruvic acid, 3BrPA)、2-脱氧-D-葡萄糖,在肿瘤细胞和动物模型中有效干预了肿瘤的进程。研究[10]表明3-BrPA可以削弱HepG2细胞有氧糖酵解相关基因及关键酶的表达,抑制葡萄糖下游步骤和谷氨酰胺代谢,发挥抗肿瘤作用。
随着分子生物学技术的迅猛发展,一些新手段用于靶向干预HK2,如shRNA技术。shRNA由于其髙度的序列专一性,可以实现特异性沉默特定基因的表达,已被广泛用于探索基因功能及恶性肿瘤基因治疗领域[11-12]。有学者[13]针对己糖激酶基因(HK1、HK2、HK3)在结直肠癌(HT-29、SW 480、HCT-15、RKO、HCT 116)和黑色素瘤(MDA-MB-435S和SK-MEL-28)细胞系中使用shRNA病毒载体沉默,分别转染或共转染后结果显示HK2沉默失活与结直肠癌细胞系中HK1的表达增加有关,HK1和HK2同时表达衰减导致细胞活力下降,共转染HK1、HK2和HK3 shRNA可导致细胞迅速凋亡,提示HK1和HK2同时失活足以减少黑色素瘤和结直肠癌细胞的增殖和存活,其可作为癌症潜在治疗靶点。张丹 等[14]观察shRNA沉默HK2对乳腺癌细胞MDA-MB231放疗敏感性的影响,结果表明给予不同剂量的X线照射后,细胞存活率呈剂量依赖性递减的趋势,且shRNA处理组的存活率较对照组明显下降,细胞凋亡率明显高于对照组,表明沉默乳腺癌细胞HK2基因可增加其对放疗的敏感性。

图4 沉默HK2表达对肝癌HepG2细胞周期的影响
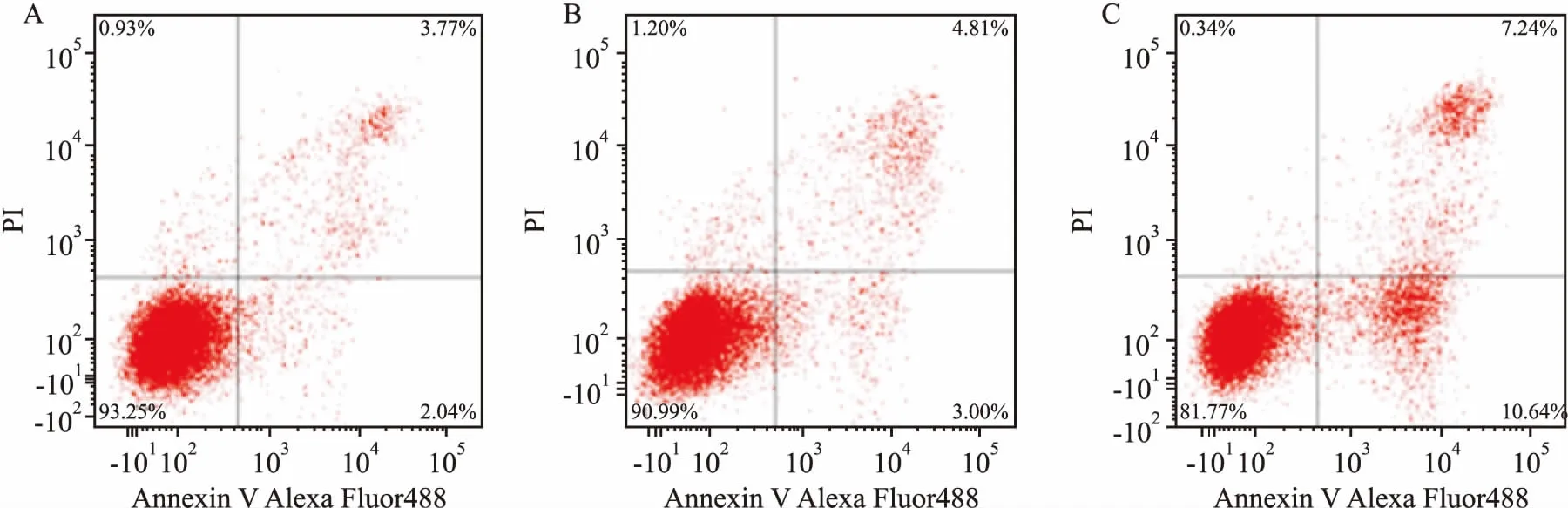
图5 沉默HK2X表达对肝癌HepG2细胞凋亡的影响
由于当前尚无有关HK2与肝细胞肝癌发生发展关系的研究报道,本研究通过沉默HK2研究其在人肝癌高转移细胞株HepG2中功能。首先,通过检测肝癌组织和细胞中HK2蛋白表达,结果显示HK2在肝癌组织中表达显著升高,与Zhang et al[5]通过高通量测序手段发现HK2可能在肝细胞肿瘤中高表达结论一致。临床病理特征统计分析显示HK2表达与肿瘤直径、TNM分期、组织病理分级存在相关性,与HK2在其它肿瘤中表达意义一致。随后,建立稳定转染的细胞株HK2 shRNA,检测细胞周期变化可以看出HK2沉默干扰使得细胞周期发生明显转变,更少停滞在S期。此外,沉默HK2表达可显著降低HepG2细胞增殖活性,显著升高HepG2细胞凋亡率,与HK2在结直肠癌[13]、喉鳞状细胞癌[15]等肿瘤中作用机制一致。细胞凋亡是细胞生长分化调节的重要手段,又是机体免受肿瘤危害的重要保护机制,癌变了的细胞发生凋亡的能力通常极低,而增殖能力则相应增强,这直接导致了瘤细胞快速而病态的分裂增殖,暗示HK2可能通过抑制凋亡促进肿瘤生长。
以上实验结果提示HK2具有抗肿瘤潜能,为肝细胞癌患者的肿瘤靶向治疗提供理论基础,并为后续的肝细胞癌侵袭转移机制研究提供了实验依据。但是本研究还没有从动物水平探讨沉默HK2对裸鼠移植瘤可能的影响及治疗作用,有待在后续实验中完善,有关HK2在肝癌中作用的详细机制有待更加深入的探讨。
