二氢杨梅素对SHED活性及其成骨分化能力的影响
2019-03-05岳二丽李夏宁赵红宇王一飞肖剑礴
岳二丽,李夏宁*,赵红宇,王一飞,刘 飞,肖剑礴
牙周病是一种慢性炎症性的疾病,可以导致牙周支持组织的破坏,牙周病治疗的目标是使缺失的牙周组织获得再生。近年来,组织工程学的飞速发展为这一目标提供了新的研究方向,其中种子细胞是其中的重要角色之一。因乳牙牙髓干细胞(stem cells from human exfoliated deciduous teeth,SHED)增殖能力及成骨分化能力要强于骨髓间充质干细胞及恒牙牙髓干细胞[1-2],使其在组织工程学中表现出了巨大的应用潜力。目前多项研究[3-4]证实显齿蛇葡萄中主要成分为黄酮类化合物,黄酮类化合物具有抑制破骨细胞形成、促进成骨分化能力及增加骨密度的作用。二氢杨梅素(Dihydromyricetin,DMY)是显齿蛇葡萄中含量最高的成分[5],郭航 等[6]及Zhang et al[7]证实一定浓度的DMY可促进肉仔鸡肠上皮细胞内碱性磷酸酶(alkaline phosphotase,ALP)活性并通过激活Wnt /β-catenin信号通路促进人骨髓间充质干细胞的成骨分化能力。该研究旨在通过将DMY作用于SHED,探索其对SHED 的活性及骨向分化能力,探究其用于辅助治疗牙周病等骨缺损性疾病的可能性。
1 材料与方法
1.1实验试剂及仪器DMY纯度>96%(暨南大学王一飞教授馈赠);胎牛血清、DMEM培养基(美国Gibco公司);CCK-8试剂盒(日本同仁公司);SABC染色试剂盒、鼠抗人CD45、CD105和CD146单克隆抗体(北京索莱宝科技有限公司); ALP试剂盒(南京建成公司);逆转录试剂盒、q-PCR试剂盒(日本TaKaRa公司);超净工作台(苏州佳宝净化公司);二氧化碳培养箱(美国Thermo公司);流式细胞仪(美国Biolegend公司);实时荧光定量 PCR检测仪(美国Bio-Rad公司)。
1.2方法
1.2.1乳牙牙髓细胞的分离培养 将于2016年7月~9月在广东省口腔医院外科门诊拔除的6~8岁健康儿童的无牙体牙髓牙周疾病的滞留乳牙(患儿家属均知情同意)在超净台内拔出牙髓组织,剪碎成约1 mm×1 mm×1 mm的组织块,接种于培养瓶里,翻转,加入约4 ml培养液,置于37 ℃、5% CO2培养箱中,12 h后小心翻转培养瓶,每3~4 d换次液。待细胞汇合约80%左右时进行传代。
1.2.2SHED的纯化培养 取对数期的第1代细胞,倍比稀释调整细胞密度为10~15个/ml,接种于96孔板中,24 h后标记单个细胞孔,待克隆长至孔底约80%后,将多个单细胞孔混合,扩大培养。
1.3SHED的鉴定
1.3.1SHED免疫组织化学鉴定 取生长良好的第3代细胞,调整细胞密度为1×104/ml,接种于24孔板,制备细胞爬片,细胞融合至约80%时,用4%的多聚甲醛固定15 min,按照SABC试剂盒进行波形丝蛋白和角蛋白的免疫荧光染色(以PBS代替一抗作为阴性对照)。
1.3.2SHED流式细胞术鉴定 取生长良好的第3代细胞,用PBS调整细胞密度为1×106个/ml,取100 μl置于EP管中,实验组中加入2 μl含FITC荧光标记的1 ∶200稀释的鼠抗人CD45、CD105和CD146抗体,对照组为无抗体组;4 ℃下孵育30 min,离心,用500 μl的PBS重悬细胞,避光,流式细胞仪检测。
1.4CCK-8检测不同浓度的DMY对SHED活性的影响将生长状态良好的第4代SHED调整细胞密度为1×104个/ml,接种在3块96孔板中,每孔200 μl培养液,周边一圈填充无菌PBS。均置于5% CO2、37 ℃培养箱内24 h,随机分组,每组6孔,吸去上清液,分别加入200 μl含0、0.02、0.1、0.5、2、10、50 μmol/L浓度的DMY细胞培养液,并设置空白组。第24、48、72 小时分别随机取一块96孔板,用CCK-8试剂盒于450 nm酶标仪处测定每孔的吸光度值。
1.5不同浓度的DMY对SHEDALP活性的影响取生长状况良好的第5代SHED,调整细胞密度为3×104个/ml,接种于96孔板中,待细胞贴壁后,随机分为7组,6个实验组及对照组,每组设置6个复孔,吸去孔内培养液,分别加入含不抑制SHED活性的及0 μmol/L的DMY的成骨诱导液200 μl,周围一圈加入无菌PBS,培养箱内培养72 h后,按ALP试剂盒说明书进行操作,用酶标仪设置在520 nm处测吸光度值。
1.6不同浓度的DMY对SHEDRunt相关转录因子2(runt-relatedtranscriptionfactor2,Runx2)及骨钙素(osteocalcin,OCN)mRNA表达的影响分别收集经不抑制SHED活性的及0 μmol/L浓度的DMY成骨诱导后第7天的细胞的总RNA,将RNA反转成 cDNA,Real-time PCR检测Runx2和OCN mRNA 的表达情况,以β-actin为内参。基因序列见表1。

2 结果
2.1SHED形态观察5~10 d组织块周围见细胞爬出(图1A),贴壁生长,细胞大多为长梭形,呈成纤维细胞状。纯化培养时在第6天左右见标记的单个细胞孔克隆形成(图1C),细胞体积较小,排列紧密,形态均一 。

表1 基因序列

图1 倒置显微镜下SHED 原代及传代培养 ×40
2.2SHED免疫组织化学鉴定图2A中见胞质染成红色,抗波形丝蛋白免疫荧光染色阳性;图2B中胞质无着色,角蛋白染色阴性。
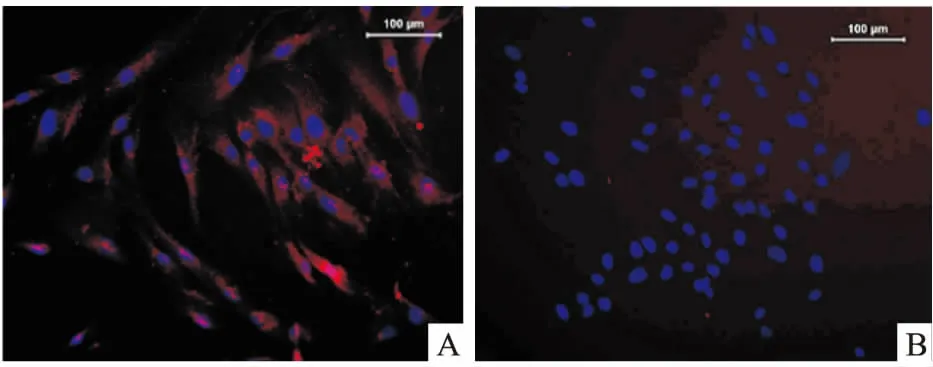
图2 SHED的免疫细胞化学染色 ×200
2.3SHED流式细胞术鉴定结果显示:细胞CD45表达阴性,比率为1.78%,CD146和CD105表达阳性,比率分别为88.55%及86.20%。见图3。
2.4DMY对SHED活性的影响由表2所示,各浓度DMY作用下的SHED,随着时间的延长,各个组的吸光度值都升高;在24、48及72 h时,各浓度DMY组与对照组相比,增殖能力差异无统计学意义。
表2 不同浓度的DMY在不同时间点对SHED活性的影响
2.5DMY对SHEDALP活性的影响0、0.02、0.1、0.5、2、10、50 μmol/L DMY组ALP活性分别为(0.172±0.003)、(0.174±0.005)、(0.172±0.003)、(0.176±0.002)、(0.182±0.004)、(0.200±0.003)及(0.220±0.006),差异有统计学意义(F=20.120,P=0.000)。10、50 μmol/L DMY组ALP活性均显著高于对照组(P<0.05),并呈浓度依赖性;0.02、0.1、0.5及2 μmol/L DMY组ALP活性与对照组相比,差异无统计学意义。见图4。
2.6DMY对SHEDRunx2及OCNmRNA表达的影响0、0.02、0.1、0.5、2、10及50 μmol/L DMY组Runx2 mRNA的表达结果分别为(1.00±0.02)、(1.15±0.09)、(1.39±0.02)、(1.90±0.28)、(1.97±0.04)、(2.33±0.04)、(3.31±0.08),差异有统计学意义(F=139.00,P=0.00),其中0.1、0.5、2、10及50 μmol/L Runx2 mRNA表达显著高于对照组(P<0.05),并呈浓度依赖性,0.02 μmol/L组与对照组相比差异无统计学意义;OCN mRNA表达结果分别为(1.00±0.06)、(1.14±0.07)、(1.29±0.02)、(1.57±0.18)、(2.57±0.08)、(2.65±0.04)、(2.77±0.20),差异有统计学意义(F=140.30,P=0.00),其中, 0.5、2、10及50 μmol/L DMY组OCN mRNA表达显著高于对照组(P<0.05),并呈现一定的浓度依赖性,0.02、0.1、0.5、2、10及50 μmol/L组与对照组比较差异无统计学意义(图5)。
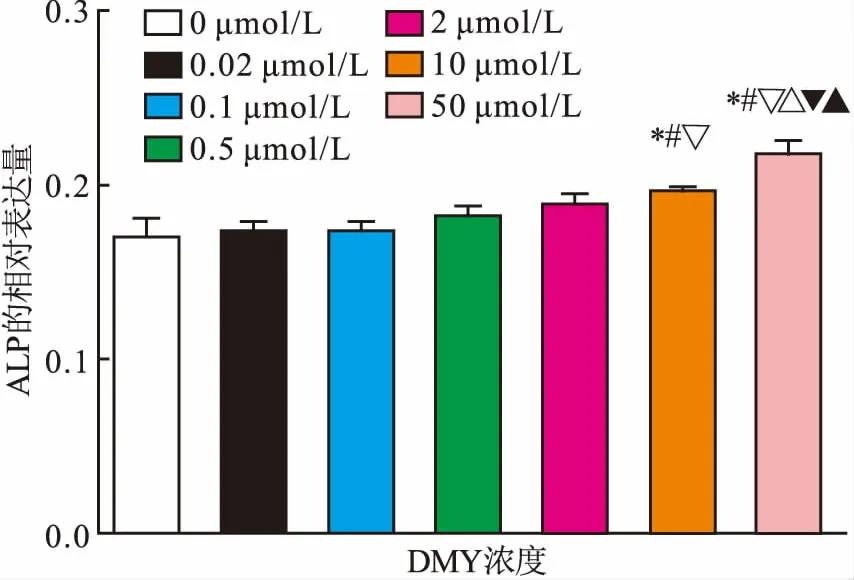
图4 DMY对SHED ALP活性的影响
与对照组比较:*P<0.05;与0.02 μmol/L的DMY组比较:#P<0.05;与0.1 μmol/L的DMY比较:▽P<0.05;与0.5 μmol/L的DMY比较:△P<0.05;与2 μmol/L的DMY比较:▼P<0.05;与10 μmol/L的DMY比较:▲P<0.05
3 讨论
DMY化学结构为3,5,7,3’,4’,5-六羟基-2,3双氢黄铜醇,属黄酮类化合物,有抗氧化、抗炎、抗病原微生物、提高动物肠上皮ALP活性、促进人骨髓间充质干细胞成骨分化能力、降血糖、抗肿瘤、抗心血管疾病、解酒护肝等多方面的药理作用[6-10],且在自然界中分布广泛,存在于藤茶、葡萄科、豆科、杨梅科、金丝桃科及柳科等植物中,此外DMY在显齿蛇葡萄中的含量高达30%以上[7],其在治疗骨缺损及骨质疏松方面有较好的开发应用前景。

图5 q-PCR检测DMY作用于SHED 7 d时Runx2及OCN mRNA的表达情况
A:Runx2;B:OCN;与对照组比较:*P<0.05;与0.02 μmol/L的DMY比较:#P<0.05;与0.1 μmol/L的DMY比较:▽P<0.05;与0.5 μmol/L的DMY比较:△P<0.05;与2 μmol/L的DMY比较:▼P<0.05;与10 μmol/L的DMY比较:▲P<0.05
SHED是Miura et al[1]在2003年首次从人脱落的乳牙牙髓中发现的具有较强的增值能力以及向成骨细胞、成牙本质细胞、神经细胞等多向分化潜能的干细胞。Zheng et al[11]将获得的小型猪的乳牙牙髓干细胞与β-磷酸三钙支架材料复合,移植至下颌骨缺损的部位,6个月后通过CT及免疫组织化学分析显示小型猪的乳牙牙髓干细胞复合β-磷酸三钙组的骨缺损部位大部分形成了新生骨(矿化基质达到83.1%)明显较单纯的β-磷酸三钙组(52.2%)高。Fu et al[12]将SHED结合者羟基磷灰石-磷酸三钙后植入牙周炎模型的患牙处,2~3个月后,通过临床检查、组织学检查及CT扫描均可见牙槽骨、牙周膜及牙骨质的再生,且比单独植入羟基磷灰石-磷酸三钙组牙周软硬组织的再生率均高许多。SHED在骨组织的再生中表现出了极大的应用潜能。
本实验中,通过组织块法及有限稀释法获得了SHED,免疫荧光组织化学鉴定获得的细胞抗波形丝蛋白阳性,抗角蛋白阴性,并且流式细胞术结果显示CD45 表达阴性,CD146和CD105表达阳性,证明获取的细胞为间充质来源的干细胞而非上皮细胞或者造血细胞来源。
在进行DMY对SHED的成骨分化能力的研究前,首先通过CCK-8法检测了DMY对SHED细胞活性的影响,结果表明0.02、0.1、0.5、2、10及50 μmol/L浓度的DMY与对照组相比对SHED的增殖差异无统计学意义,说明一定浓度的DMY对SHED无明显的细胞毒性,这与与周防震 等[13]及Zhang et al[7]的研究结果相似。
ALP是成骨分化过程中早期阶段的标志物,是一种非特异性的磷酸单酯酶,可水解磷酸盐,在骨的矿化过程中为磷灰石晶体的沉积提供必需的磷酸,ALP活性的高低可以反映不同组织和细胞的矿化能力,及其骨向分化的趋势[14]。本研究结果显示10、50 μmol/L的DMY与对照组相比均可促进ALP的活性,并呈浓度依赖性。Runx-2和OCN均是检测细胞矿化过程的重要指标,Runx-2表达于成骨分化的起始阶段,是骨形成最早的及最具特异性的标志;OCN由成熟的成骨细胞、成牙骨质细胞和成牙本质细胞合成,在维持骨的正常矿化速率中起着重要作用,是成骨分化过程中晚期阶段的标志物[15]。q-PCR检测不同浓度DMY对SHED内Runx-2和OCN mRNA表达的变化,直接反映了DMY对SHED早期及晚期的成骨能力。结果显示,在成骨诱导第7天时,0.5、2、10及50 μmol/L DMY组与对照组相比,Runx2 mRNA表达均呈上调趋势; 2、10及50 μmol/L DMY组与对照组相比,OCN mRNA表达均呈上调趋势,且均具有一定的浓度特异性。但DMY在对SHED成骨诱导过程中的具体作用机制尚不清晰,而且细胞体外培养和体内生长的微环境也不同,此外,DMY能否促使牙周组织再生,缺乏动物实验及临床试验,这些仍需更进一步的研究。
