MDCK细胞外基质对HK-2细胞的增殖和迁移的影响
2019-03-05袁育珺杨秀玲胡志坚
袁育珺,杨秀玲,胡志坚,汪 渊
肾小管上皮细胞生长、移行在急性肾损伤修复,延缓糖尿病肾病(diabetic nephropathy,DN)进展等过程中起重要作用,寻找促进肾小管上皮细胞增殖和迁移的因素或药物十分重要。整合素(integrin)是一类由α亚基和β亚基组成的异源二聚体跨膜蛋白,属细胞黏附分子家族,研究[1]表明,其能介导细胞与细胞及细胞外基质(extracellular matrix,ECM)之间的黏附,是细胞迁移、增殖等生理活动重要的调控因素。整合素α3和α6能与细胞外间质中的层黏连蛋白(Laminin,LN)结合[2-3],影响细胞的黏附和运动[4]。该研究采用体外培养HK-2细胞,运用相关分子生物学技术(如酸性磷酸酶活性、细胞划痕实验、免疫荧光、Western blot等)分析生长于细胞外基质上的HK-2细胞的增殖和迁移状况以及整合素α3和α6蛋白表达的变化,并进一步探讨这些作用可能的分子调控机制,以开拓其在临床的应用前景。
1 材料与方法
1.1材料犬肾小管上皮细胞株MDCK和肾近曲小管上皮细胞株HK-2均购自中国科学技术大学生命科学院细胞库,于实验室液氮保存;DMEM和原装小牛血清均购自美国Gibco公司;酸性磷酸酶(acid phosphatase,ACP)活性检测试剂盒购自安徽碧云天生物试剂公司;一抗actin、整合素α3和α6均购自美国Santa Cruz公司;二抗购自美国Pierce公司。
1.2方法
1.2.1细胞培养和细胞外基质的制备 液氮取出HK-2和MDCK细胞,迅速37 ℃循环水浴解冻,及时接种于含10%小牛血清DMEM,细胞培养箱(条件:37 ℃、5% CO2、饱和湿度)培养过夜。胰酶消化传代,备用。细胞外基质制备方法如下[5-6]:取MDCK细胞(细胞覆盖率90%),弃上清液,PBS清洗2遍,加入氨水(浓度为20 mmol/L)处理10 min,弃氨水,PBS清洗基质3遍,在含或不含MDCK细胞外基质上接种HK-2细胞,备用。分组为:正常对照组和细胞外基质组。
1.2.2ACP活性检测细胞增殖 按1.2.1事先在96孔板内制备细胞外基质,取对数期生长的HK-2细胞,胰酶消化,制成(1×102)~(1×105)/ml细胞悬液,平均接种于含或不含基质的96孔板,分别设6复孔。连续培养48 h后,取出96孔板,弃上清液,PBS清洗2遍,按照ACP活性检测试剂盒说明书操作,第一步:加入底物,37 ℃孵育2 h;第二步:加终止液,室温静置20 min;第三步:酶标仪检测A405吸光度,实验重复3次。
1.2.3细胞划痕检测细胞迁移 按1.2.1预先在6孔板内制备细胞外基质,取一瓶HK-2细胞(对数期生长),弃上清液,PBS清洗2遍,胰酶消化,制成合适细胞悬液(5 000个/ml),平均接种于含或不含基质的6孔板。待各孔细胞覆盖率90%,弃去上清液,PBS清洗2遍,用划痕笔轻轻的在各孔正中央划“十”字,PBS清洗3遍(尽量洗去残留细胞),加DMEM做好标记并拍照。拍照分为0、24和48 h,实验重复3次。
1.2.4免疫荧光 6孔板内铺上盖玻片,事先在一半玻片上铺细胞外基质,再平均接种HK-2细胞。待细胞覆盖率80%左右时,弃上清液,PBS清洗2遍,4%多聚甲醛固定20 min,PBS清洗3遍,5%脱脂奶粉封闭2 h,用镊子小心取出玻片,置于载玻片上,PBS清洗3遍(每遍静置10 min,尽量洗去残留物),加入鼠抗人α3多克隆抗体(1 ∶40稀释于脱脂牛奶),4 ℃孵育过夜;次日PBS清洗3遍,加入FITC标记的羊抗鼠IgG(1 ∶100稀释于PBS),孵育2 h,PBS清洗3遍,加盖玻片封片,经复聚焦显微镜(confocalmicroscopy)双光观察,拍照备用,实验重复3遍。
1.2.5Western blot 细胞总蛋白的提取:按1.2.1分组,细胞培养瓶批量培养,48 h后,弃上清液, PBS清洗2遍(尽量去除残留培养基,并控干),按照本实验室蛋白提取指南[7],方法:① 蛋白提取,培养瓶置冰上,每瓶加裂解液150 μl充分裂解,细胞刮子收集细胞,低温冷冻离心,上清置于-80 ℃备用;② BCA测定蛋白浓度,每组加入浓缩蛋白上样缓冲液,水浴煮沸,分装备用,置于-20 ℃保存;③ SDS-PAGE,配制12.5% SDS-PAGE,微量加样针上样,先用40~50 V电泳浓缩胶,100 V 电泳分离胶,100 mA冰浴转膜,伊利脱脂牛奶封闭,PBS洗膜;④ 一抗结合,配置一抗浓度为抑制素α3(1 ∶400)、α6(1 ∶800)、actin(1 ∶1 000),将膜置于一抗4 ℃过夜;⑤ 二抗结合,配置相应二抗浓度分别为1 ∶1 000、1 ∶1 500、1 ∶3 000,37 ℃孵育2 h,PBS洗膜3次;⑥ 暗室内胶片显影、定影,重复实验3次。结果进行统计学分析。

2 结果
2.1细胞外基质对HK-2细胞体外增殖的影响ACP结果显示:从表1可以看出随着接种浓度的增加,无论含或不含基质的HK-2细胞ACP活性也随之增加;且细胞外基质组ACP活性明显高于正常对照组,结果表明细胞外基质能促进HK-2细胞体外增殖(图1)。

表1 细胞外基质对HK-2细胞体外增殖的影响
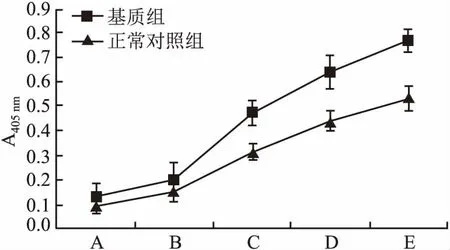
图1 细胞外基质对HK-2细胞体外增殖的影响
A:细胞浓度为1×102;B:细胞浓度为1×103;C:细胞浓度为1×104;D:细胞浓度为1×105;E:细胞浓度为1×106
2.2细胞外基质对HK-2细胞迁移的影响细胞划痕结果显示:基质能明显增强HK-2细胞损伤愈合速度,由图2可以看出,无论是24 h或者48 h,基质组迁移距离都明显高于正常对照组,结果表明细胞外基质能促进HK-2细胞迁移。见表2。
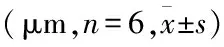
表2 细胞外基质对HK-2细胞迁移的影响

图2 细胞外基质对HK-2细胞迁移的影响 ×100与正常对照组比较:*P<0.05
2.3细胞外基质对整合素α3在细胞内表达的影响免疫荧光结果显示:正常对照组(图3A)细胞周围有弱的、零散的荧光,表明整合素α3在正常HK-2细胞内有表达;但是由图3B可以看出,基质组细胞周围整合素α3呈片状表达,而且荧光比较强。
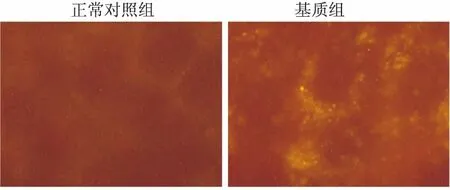
图3 细胞外基质对整合素α3在细胞内表达的影响 ×400
2.4细胞外基质对整合素α3和α6蛋白表达的影响结果采用单因素方差分析进行主体间效应检测(Fα3=39.54,Fα6=57.31,P<0.01)。组间两两比较显示:与正常对照组比较,整合素α3和α6蛋白表达明显增加,见图4。
3 讨论
DN是常见的糖尿病并发症,近些年的发病率呈逐年上升趋势,已成为引起糖尿病患者死亡的主要原因。相关研究[8-9]指出在糖尿病肾病发生早期,肾小管上皮细胞的凋亡和氧化损伤是糖尿病并发症的原始启动因子和细胞损伤的首要因素,也是肾小管间质纤维化发生的关键环节;同样,在缺血性急性肾损伤病理特征中,肾小管上皮细胞凋亡增加,是缺血性急性肾损伤的重要发病机制之一[10]。因此,寻找促进肾小管上皮细胞增殖和迁移的因素或药物来干预肾小管上皮细胞凋亡,维持上皮细胞活性,能有效地促进急性肾损伤修复,并有望延缓糖尿病肾病进展。
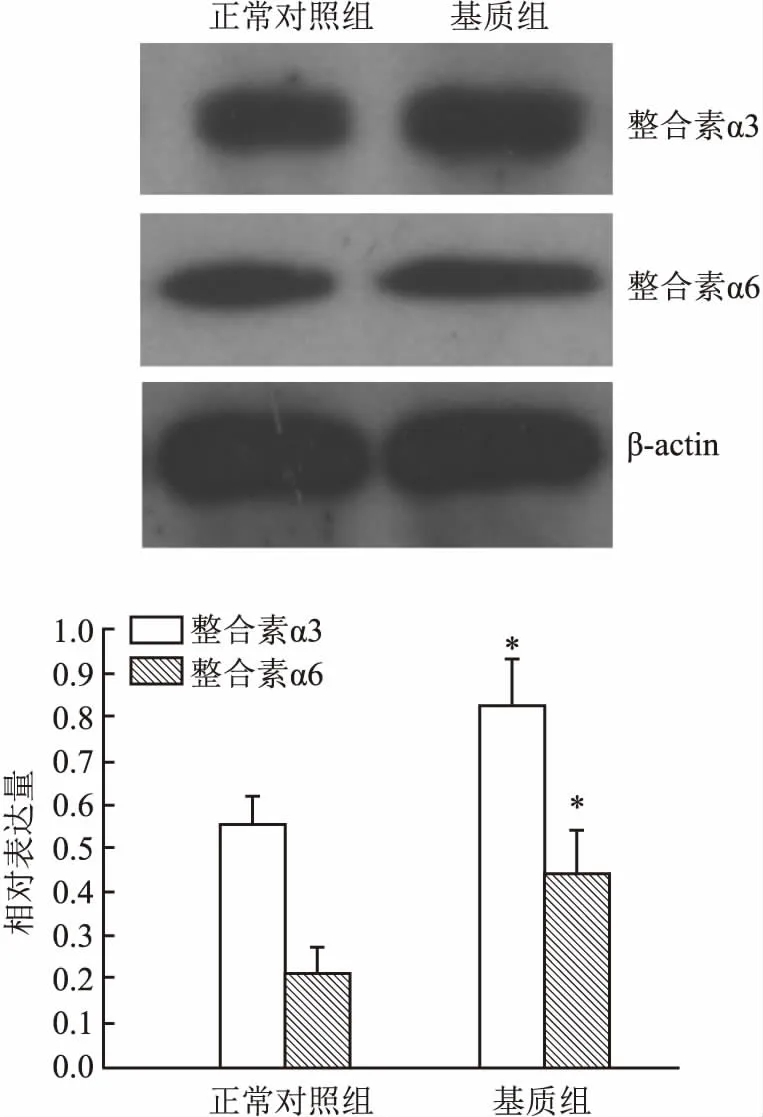
图4 细胞外基质对整合素α3和α6蛋白表达的影响与正常对照组比较:*P<0.05
MDCK细胞外基质是犬肾小管上皮细胞基底膜成分,富含LN[11]。整合素是一类由α亚基和β亚基组成的异源二聚体跨膜蛋白,属细胞黏附分子家族,能介导细胞与细胞及细胞外基质之间的黏附,是细胞迁移、增殖等生理活动重要的调控因素[1]。每种亚单位包含胞外域、单跨膜和胞内域。由外向内的信号转导 (outside-insignaling)和由内向外的信号转导(inside-outsignaling)两种途径,由外向内介导骨架重构,由内向外调节与配体的亲和力[12]。因为能够在细胞与细胞之间、细胞与胞外环境之间传递信息;从而对细胞的生存、增殖、黏附和迁移起到严格的控制[13]。实验结果表明:与正常对照组比较,MDCK细胞外基质能明显增加HK-2细胞的增殖和迁移,且整合素α3和α6的表达也呈上升趋势。其机制可能为:整合素α3和α6属层黏连蛋白受体,可以作为桥梁与细胞外间质中的LN结合,调控多种细胞内信号通路,包括肌动蛋白(actin)成核、聚合的激活以及促活、促有丝分裂原信号等[14-15],进而促使培养的细胞进行有丝分裂,影响HK-2细胞的黏附和运动。
但是细胞调控既复杂而严密,且细胞外基质也是一个动态且复杂的微环境,在不同的组织当中呈现出不同的生物物理、机械性、生物化学方面的特征,所以MDCK细胞外基质调控HK-2细胞增殖和迁移的机制并非如此的简单,如高表达的整合素α3和α6是通过哪些机制或信号通路来调控HK-2细胞的增殖和迁移尚不清楚,有待进一步的研究和探讨。
