siRNA沉默Skp2基因对肝癌HepG2细胞生物学行为影响及机制
2019-03-05郭云霞秦宝山冯军安王志凌王郁杰
郭云霞 秦宝山 冯军安 韩 莉 王志凌 王郁杰
肝癌在我国发生率较高,而浸润和转移是该病恶化和死亡的重要原因[1,2]。研究表明,肝癌的发生与部分基因异常表达有关[3]。Skp2基因位于5p13,与多种恶性肿瘤发生、发展相关[4,5],其中Skp2蛋白能特异性识别泛素连接酶复合物的底物,并将其磷酸化促进泛素化降解及细胞周期从G1期向S期过渡,导致细胞过度增殖[6]。已有研究表明,Skp2高水平者其预后差,多变量分析显示,Skp2 mRNA表达水平可以作为肝癌患者独立的预后指标[7,8]。然而目前Skp2基因沉默后调节肝癌细胞生物学行为中的分子机制仍然未知。本研究采用siRNA方法沉默Skp2的表达,研究其对肝癌细胞增殖和侵袭能力的影响。
材料与方法
1.实验材料:人肝癌HepG2细胞(齐氏生物科技有限公司)。Skp2 Human siRNA(美国Origene公司)。BeyoFastTMSYBR Green qPCR Mix (2X)(上海碧云天生物技术有限公司)。Annexin Ⅴ-FITC/PI双染细胞凋亡检测试剂盒(南京建成生物工程研究所)。MMP2、MMP9 ELISA试剂盒(武汉博士德公司);Lipofectamine TM2000 (美国Invitrogen公司)。兔抗人caspase-3、P27蛋白抗体、羊抗兔HRP标记的二抗(碧云天生物技术研究所)。
2.实验方法: (1)组织标本的采集:选取2010年1月~2017年1月笔者医院病理科明确诊断的16例肝癌组织标本。取同期配对且病理分析为正常组织的癌旁组织16例作为对照组。所有患者年龄在38~87岁,平均年龄为69.43±7.25岁。标本采集均告知患者并签署知情同意书,并经笔者医院伦理学委员会批准。(2)细胞培养和转染:HepG2细胞于含10%胎牛血清的RPMI1640培养基,在37 ℃、5% CO2培养箱中培养,0.25%的胰蛋白酶-EDTA消化、传代。将1×104个/ml细胞接种于6孔板培养,当细胞汇合度达80%以上时,将培养基换成无血清无双抗的培养基,并根据Lipofectamine TM2000使用说明进行转染细胞操作。37 ℃、5% CO2培养箱中培养6h后,PBS 洗去转染试剂,改换含10%胎牛血清的RPMI1640培养基继续培养。实验分3组:对照组(仅有空载体)、NC-Skp2组(仅含有SKP2阴性序列)、siRNA-Skp2组(含有Skp2基因干扰序列),每个实验重复3次。(3) qRT-PCR:Trizol裂解人肝癌组织、癌旁组织或细胞系,4℃、12000g离心10min,吸取水相层,按每毫升最初的Trizol加入0.5ml异丙醇,4℃、12000g离心10min,弃上清,所得沉淀即为 RNA,并测定纯度。按照反转录试剂盒说明书反转录生成 cDNA。反应体系为20μl,其中BeyoFastTMSYBR Green qPCR Mix (2×)10μl,上游(3μmol/L)和下游(3μmol/L)2μl,cDNA2μl,PCR级高纯水6μl。采用light cycleR96实时荧光定量PCR仪,反应条件:预变性95℃2 min ;95℃变性15s,60℃退火 25s,60℃延伸 30s,共40 个循环。引物序列由上海英骏公司提供。Skp2上游序列:5′-GCTGAACATTTCAGTACTCTCGC-3′,下游序列:5′-GTCTCTGACACATGCGCAAC -3′,产物大小194p;内参 GAPDH上游引物:5′-CCACTAGGCGCTCACTGTT-3′,下游引物:5′- TGGAATTTGCCATGGGTGGA -3′,长度228bp。SKP2相对表达量=2-△△Ct×100%,△Ct=Ct(待测基因)-Ct(GAPDH)。(4)CCK-8测定细胞活力:取对数生长期细胞,调整密度为1×104个/ml细胞接种于96孔板,每组设置3个复孔,培养24、48、72、96h,每孔加入CCK-8 10μl,培养2h各孔细胞在450nm测定吸光度A值,另设空白对照组调零,计算抑制率。实验重复3次。(5)流式细胞仪检测细胞凋亡:对数期HepG2细胞转染72h后,胰酶消化,1000×g离心5min,收集细胞,PBS重悬计数,5×104重悬细胞,1000×g离心5min,加入结合液500μl重悬细胞,加入Annexin Ⅴ-FITC5μl,然后加入PI 5μl,混匀,室温孵育10min,随即行流式细胞仪检测。(6) Transwell 小室检测细胞的侵袭力:Transwell 上室膜面铺上 Matrigel。将分组干预72h的细胞采用胰酶消化,调整,每孔上室加入细胞密度为4×104的无血清培养基100μl,每孔下室加入10%胎牛血清的RPMI1640培养基500μl,37℃、5%CO2培养箱中培养24h,棉签刮净滤膜上层细胞,100%多聚甲醛固定10min,染色,拍照计数。(7) ELISA法测定检测 MMP2和MMP9水平:对数期HepG2细胞转染72h后,收集细胞上清。等比稀释标准品绘制标准曲线,每孔加入样品和标准品100μl,置37℃孵育1.5h。每孔添加生物素标记抗体100μl,置37℃孵育1h。然后0.01mol/L TBS洗涤3次。每孔加过氧化物酶孵育1h, TMB37℃避光反应0.5h,加入TMB终止液,在ELISA检测仪上,于450nm波长处,测各孔吸光度(A)值。(8)Western blot法检测caspase-3、P27的表达:常规方法提蛋白质,调整各样本蛋白总量,参照说明书进行SDS-PAGE凝胶电泳,参照规程分别孵育一抗和二抗,Bio-Rad凝胶成像系统成像拍照,以β-actin为内参分析待测蛋白相对表达值。

结 果
1.Skp2 mRNA在肝癌组织中的表达:利用qRT-PCR技术检测肝组织中Skp2 mRNA表达水平,检测结果显示肝癌组织中Skp2 mRNA的相对表达量为3.68±1.47,癌旁组织为1.10±0.47,其中肝癌组织中Skp2 mRNA水平明显高于癌旁组织(P<0.05)。
2.siRNA-Skp2沉默HepG2细胞中Skp2的mRNA的表达:qRT-PCR结果显示,空白对照组Skp2mRNA的相对表达量为2.42±0.06,NC- Skp2组为2.40±0.05。siRNA-Skp2组为1.07±0.05。与NC-Skp2组和空白对照组比较,转染siRNA-Skp2后,siRNA-Skp2组的Skp2的mRNA表达明显下调(P<0.05,图1)。
3.转染siRNA-Skp2对HepG2细胞增殖的影响:CCK-8实验结果显示,与空白对照组和NC-Skp2组比较,转染siRNA-Skp2后,siRNA-Skp2组的增殖率明显下调(P<0.05),而空白对照组和NC-Skp2组间比较,差异无统计学意义(P>0.05,图1)。
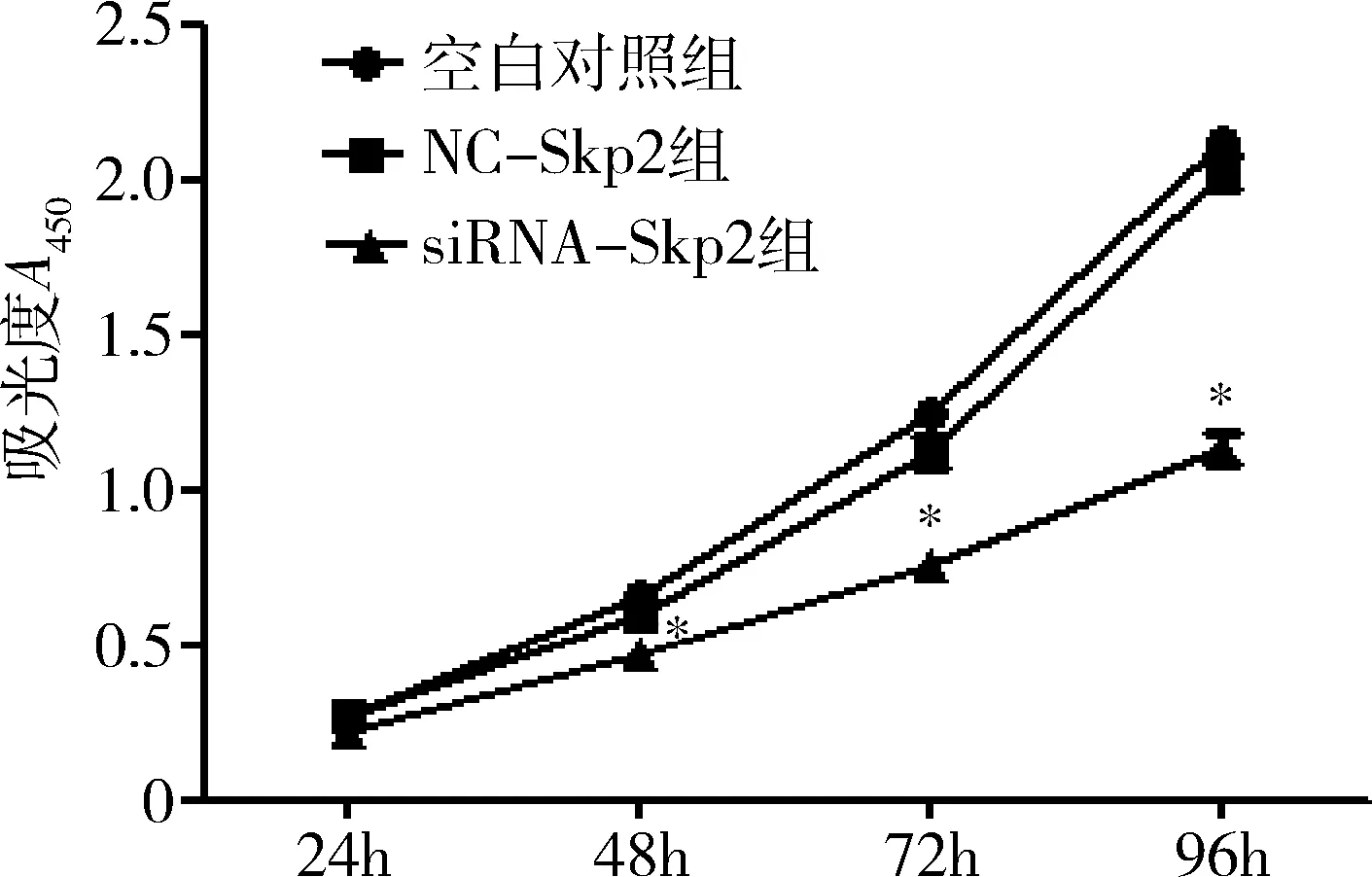
图1 转染siRNA-Skp2对HepG2细胞活力的影响与NC-Skp2组比较,*P<0.05
4.转染siRNA-Skp2对HepG2细胞凋亡的影响:采用流式细胞仪检测细胞凋亡,在转染72h后,空白对照组、NC- Skp2组和siRNA-Skp2组的细胞凋亡率分别为3.12%±0.74%、3.83%±1.14%、20.42%±1.24%。与空白对照组和NC- Skp2组比较,siRNA-Skp2组的细胞凋亡率明显上调(P<0.05,图2)。
5.转染siRNA-Skp2对细胞的侵袭力的影响:采用Transwell 小室检测细胞侵袭力,结果显示,在转染72h后,空白对照组穿膜细胞数为31.52±3.12;NC-Skp2组细胞数为30.27±1.42;siRNA-Skp2组细胞数为8.23±2.47。与空白对照组和NC-Skp2组比较,siRNA-Skp2组的细胞侵袭力明显下调(P<0.05,图3)。

图2 Skp2对HepG2细胞凋亡的影响

图3 Skp2对HepG2细胞侵袭力的影响
6.转染siRNA-Skp2对HepG2细胞侵袭蛋白的影响:采用ELISA法检测MMP2和MMP9水平,在转染72h后,与空白对照组和NC-Skp2组比较,siRNA-Skp2组的细胞分泌MMP2和MMP9能力明显下调(P<0.05,图4)。
7.转染siRNA-Skp2对HepG2细胞中caspase-3、P27的表达影响:采用Western blot法检测caspase-3、P27蛋白水平,在转染72h后,与空白对照组和NC-Skp2组比较,siRNA-Skp2组的caspase-3、P27的表达水平明显上调(P<0.05,图5,图6)。
讨 论
Skp2 为F-box家族的成员,对细胞G1~S 期具有特异性的调控作用,并已被广泛应用于实验研究[9,10]。李胜等[11]采用Skp2 RNA干扰表达载体降低Skp2蛋白在肺癌细胞中的表达。结果表明,干预组细胞的肺癌细胞生长较阴性对照组明显降低,而凋亡率较阴性对照组明显增加。在喉癌组织中也观察到相似的结果[12]。Xu等[13]通过沉默Skp2基因表达水平,膀胱癌T24细胞增殖和侵袭受到显著抑制。目前,已有研究表明,Skp2在肝癌组织中的中的阳性表达明显高于癌旁组织,但其机制并不太明确[8]。本研究结果显示,Skp2 mRNA在肝癌组织中表达水平明显高于癌旁组织,这与相关研究一致。为了进一步研究Skp2在肝癌的进展中的作用,将体外合成的siRNA-Skp2转染HepG2细胞72h后,采用qRT-PCR分析靶基因Skp2的mRNA水平变化。结果表明,siRNA-Skp2能有效降低Skp2基因表达。
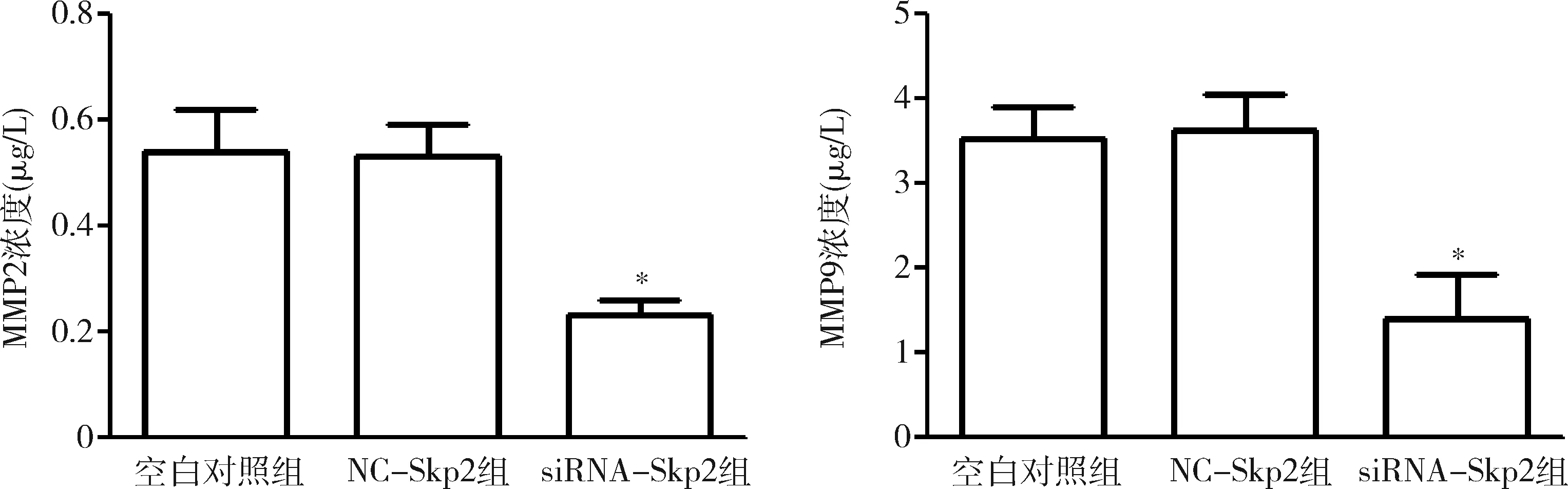
图4 转染siRNA-Skp2对HepG2细胞侵袭蛋白的影响与NC-Skp2组比较,*P<0.05

图5 转染siRNA-Skp2对caspase-3、P27蛋白表达的影响
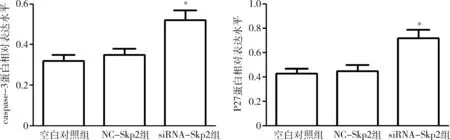
图6 转染siRNA-Skp2对caspase-3、P27蛋白水平的影响与NC-Skp2组比较,*P<0.05
已有研究表明,P27低表达与高度侵袭性肿瘤相关,而P27高水平可以抑制癌细胞的增殖[14]。本实验通过CCK-8实验检测了转染siRNA-Skp2后HepG2细胞增殖的影响,结果表明siRNA-Skp2能有效的抑制HepG2细胞的增殖。而且实验还观察到转染siRNA-Skp2 72h后,HepG2细胞中Skp2表达水平下调的同时,P27蛋白水平反而上升,这也间接说明Skp2可能通过P27蛋白信号通路调控细胞增殖。当然,肿瘤细胞能在机体内快速增值与细胞凋亡受到抑制也存在一定的关系。为了进一步研究Skp2对细胞凋亡的影响,本研究采用流式细胞仪分析了siRNA-Skp2转染HepG2细胞后的凋亡情况。结果siRNA-Skp2可有效的促进HepG2细胞凋亡,提示Skp2在抗肿瘤细胞凋亡方面发挥着重要作用。而且siRNA-Skp2转染72h后,凋亡蛋白caspase-3也显著增加,表明Skp2下调后可通过caspase信号通路诱导HepG2细胞凋亡。
为了研究siRNA-Skp2转染对HepG2细胞体外侵袭力的影响,本研究采用Transwell 小室检测细胞侵袭力。结果显示,siRNA-Skp2可有效降低HepG2细胞体外侵袭能力。已有研究表明,肿瘤细胞外基质的消化与肿瘤的侵袭有关[15,16]。肿瘤细胞分泌的MMP家族成员可以降解细胞外基质成分[17~19]。而且也有文献显示沉默Skp2后可下调MMP2和MMP9的分泌,进而抑制肿瘤的侵袭能力[20]。本研究通过MMP2和MMP9水平检测也表明,转染siRNA-Skp2后,HepG2细胞分泌MMP2和MMP9的能力明显降低。因此,降低Skp2表达水平,可通过降低MMP2和MMP9的分泌,抑制肝癌的侵袭力。
总之, Skp2基因沉默后肝癌HepG2细胞增殖和侵袭能力下降,细胞凋亡增强,其机制可能与调控P27、caspase-3、MMP2和MMP9有关。因此,抑制Skp2的表达,也可能成为肝癌基因治疗的新策略。