壳聚糖-介孔二氧化硅复合材料的制备与止血性能研究
2019-03-05夏德萌罗廷泽张洪跃吴江红许硕贵周潘宇
夏德萌 罗廷泽 汪 洋 张洪跃 吴江红 许硕贵 周潘宇
出血是创伤患者的主要临床表现之一,而难以控制的出血是平时和战时院前创伤死亡的主要原因[1]。美军根据历年战术数据的统计,发现战场上因出血而死亡的伤员约占91.0%,因此将出血列为战场三大可预防性死因之一[2,3]。平时各类意外事故、突发灾难中,出血过多同样是导致现代社会中人员死亡的主要原因之一[4]。为降低因出血而造成的致死率,各国医学界对止血材料的止血性能要求日益提高。
壳聚糖(chitosan)作为一种具有很大发展潜力的医用止血愈伤材料,是唯一自然存在的碱性多糖,是几丁质(甲壳素)经脱乙酰作用的产物[5]。其具有良好的生物相容性和可降解性,可以促进凝血和血栓的形成,同时还具有抑制多种细菌生长和促进创伤组织修复等优点[6,7]。由于该材料易于加工成型,适合作为敷料使用,Rall等[8]以壳聚糖为原料的止血敷料已通过美国FDA认证,并在伊拉克战场上配备美军。但是,由于壳聚糖溶于酸性环境中而难溶于水,纯壳聚糖膜敷料存在吸水和抗水性能差的缺点,在pH值中性环境下,血液中80%以上都是水分,因此各种对壳聚糖亲水性的改变是提高止血效果的关键,也是新一代止血材料的研究热点[9]。
介孔二氧化硅(mesoporous silica nanoparticle, MSN),是一种具有介孔和热稳定性的新型材料,其孔径为5~22nm,同时具有较大孔容、高比表面积、孔径可调范围较广且球形孔道之间通过窗口联结,因此具有优良的传质性能[10]。本研究探索以MSN为内核,壳聚糖为外壳,通过相转移和分子印迹原理,制备具有吸水性MSN内核和大孔壳聚糖外壳的复合止血剂,并对复合材料的微观表征、生物相容性和止血性能进行了进一步的研究。
材料与方法
1.材料:壳聚糖(脱乙酰度90.5%,相对分子质量400kDa,上海卡博工贸有限公司),盐酸、1,3,5-三甲苯(TMB)、正硅酸乙酯(TEOS)、氟化铵(NH4F)(上海凌峰化学试剂有限公司),冰乙酸(上海天莲精细化工有限公司),3-缩水甘油醚三甲氧基硅烷(GPTMS)、Pluronic P-123 (德国Sigma公司),3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT)。
2.仪器:D/max2550VB/PC型转靶X射线多晶衍射仪(日本 Rigaku 公司),Freezone 6型冷冻干燥机(美国Labconco公司)。
3.制备方法:(1)介孔二氧化硅(MSN)的制备:取质量分数为37%的浓盐酸10ml与超纯水65ml加入反应容器40℃ 水浴,混合均匀后缓慢加入4g Pluronic (P123)并剧烈搅拌,持续时间约1h,至其完全溶解,溶液呈澄清状态。加入4g 1,3,5-三甲苯(TMB),在40℃水中浴搅拌约2h,逐滴加入9.2ml正硅酸乙酯(TEOS)并强烈搅拌,待全部加完后再继续搅拌5min,将搅拌后的体系在40℃ 水浴中陈化20h,加入46mg氟化铵(NH4F),轻微搅拌至其溶解,除去离心瓶中的上层清液,将剩余产物放入高压反应釜,在100℃ 恒温箱中保持恒温24h。待水热反应完毕后,对反应产物进行离心(8000r/min,10min),再经水洗、醇洗各两遍,在60℃ 恒温箱烘干,最后用马沸炉900℃ 煅烧烘干后的产物6h,得到白色粉末介孔二氧化硅(MSN)。(2)壳聚糖-介孔二氧化硅复合材料的制备:首先配置质量分数为2% 的冰醋酸水溶液,再配置质量分数为0.5% 的壳聚糖-醋酸溶液,将壳聚糖-醋酸溶液20ml与3-缩水甘油醚三甲氧基硅烷(GPTMS)0.5ml在塑料瓶中进行混合并搅拌2h后置于冰箱中过夜,得到chitosan-GPTMS,将上述制备的MSN取0.1g加入过夜的液体中,室温搅6~8h,离心(8000r/min,10min),再使用超纯水冲洗2遍,最后置于冻干机中冻干,得到制备后壳聚糖-介孔二氧化硅复合材料(chitosan-MSN)。
4.材料表征测定:(1)氮气吸附-脱附曲线表征测定:采用全自动物理吸附仪测定MSN的比表面积,设定液氮温度 77.4K(-273.15℃=0K)。使用Brunauer-Emmett-Teller(BET)法计算材料的比表面积,Barrett-Joyner-Halenda(BJH)法计算材料的孔容和孔径。为去除物理吸附的水分,样品在 573K、(0.2~1.0)kPa条件下活化处理4h,并通过静态法测量吸附-脱附等温曲线。(2)粒径表征:使用动态光散射(DLS,Malven Autosizer 4700)测定纳米粒子在去离子水中的流体力学直径以及评价其在水中的稳定性。散射角度为900,激光光源功率为150W,激光波长为532nm。配制浓度大约为0.1mg/ml的纳米粒子分散液,放置于PS样品池中,温度控制在25℃,稳定5min后进行测量。设定分散剂水的折射率为1.332,黏度为0.89Pa·S。采用ZETA Size 3000HS型Zeta电位测试仪(Malvern Instruments Ltd., UK)对材料的表面电荷进行测定。
5.细胞毒性评价:采用MTT方法评价材料的细胞毒性。细胞株采用小鼠成肌细胞(C2C12,ATCC),细胞培养在含有10% FBS(fetal bovine serum,GIBCO),1%双抗(100U/ml青霉素和100μg/ml链霉素, GIBCO)的DMEM培养基中。首先消化细胞收集对数期的细胞,用培养基重悬并进行计数,使细胞悬液的浓度约5×104个/毫升,将细胞接种于96孔板中,每孔100μl,置于37℃、5%CO2的培养箱培养1天。将3种材料(MSN、chitosan、chitosan-MSN)加入培养基,配成1mg/ml浓度,浸泡1天。分别取100μl培养基浸提液,加入接种细胞的96孔板中,每孔100μl,替换原来的上清培养基,每个样品3个复孔,置于 37℃、5%CO2培养箱中分别培养 1、4和7天。每孔加入 10μl的MTT 溶液 (5mg/ml),置入培养箱中 37℃ 下继续培养4h;吸弃培养基浸提液并加入 DSMO (150微升/孔),在室温下震荡10min;采用酶标仪以 570nm 波长测定吸光度(A值)。细胞毒性评价根据下式计算相对增殖率(relative growth rate, RGR)。RGR(%)=A(实验组)-A(空白组)/A(阴性对照组)-A(空白组) ×100%。
6.吸水性能评价:采用比重法测试材料吸水性能。使用模拟体液(SBF)液体进行测试,首先通过电子分析天平准确称取试剂配制成 1L溶液并调节 pH值至7.25,置于37℃ 下备用。实验前,样品均经过120℃ 真空干燥过夜,以充分去除材料的吸收水分。计算吸水率,采用标准医用纱布作为对照。方法如下:称量样品重量标记为Wwet,将其置于放有滤纸的漏斗中,逐滴缓慢加入SBF溶液,置于第1滴液体从漏斗中滴出。再次称量样品标记为Wdry。采用公式:[(Wwet-Wdry)/Wdry]×100%计算出样品的吸水率,其中Wdry表示干燥样品质量,Wwet表示吸附SBF 溶液之后的样品质量,每组样品测3次。
7.体外凝血实验:通过凝血活酶时间(APTT)和凝血酶原时间(PT)的测定评价材料的体外凝血性能。取健康成年新西兰大白兔血液,首先用3.8%枸橼酸钠抗凝剂进行抗凝处理,然后高速离心(2500×g, 37℃),离心15min,得到贫血小板血浆(platelet poor plasma,PPP)。PT测试步骤如下:50μl PPP和100μl PT试剂分别在37℃下恒温5min,然后一同加入PT 测试管中,加入待测样品。APTT测试步骤如下:先将50μl APTT 试剂加入到50μl PPP中,并在37℃下恒温 5min,然后加入50μl浓度为0.025mol/L的CaCl2溶液以及待测样品,并放入APTT 测试管中,分别通过法国生物梅里埃公司血凝分析仪(HF6000,Biomerieux,France)测试PT和APTT,进行测试每个样品重复3次。
7.动物实验验证:通过建立肝创伤出血模型来评价样品的体外止血性能。取健康成年新西兰大白兔18只,随机分成3组,即对照组(不使用任何止血剂)、chitosan组(使用chitosan止血剂)、chitosan-MSN组(使用chitosan-MSN止血剂),每组6只。采用静脉注射3%戊巴比妥钠溶液麻醉,制造肝创伤模型,大致方法如下:术区备皮后,消毒铺单,逐层开腹,直至暴露肝脏组织,在肝脏左叶用手术刀做2cm×2cm“十”字型切口,深约0.5cm,形成脏器渗血创面。任其自由出血10s后,用医用纱布吸干血液,迅速平铺止血材料,通过秒表记录止血时间。
结 果
1.氮气吸附-脱附表征测定:介孔二氧化硅具有较大的比表面积、孔容量以及均匀的孔道分布等特性,为进一步验证,将制备的样品进行N2吸附-脱附实验。使用Brunauer-Emmett-Teller(BET)法计算材料的比表面积,Barrett-Joyner-Halenda(BJH)法计算材料的孔容和孔径,测定MSN的比表面积为524m2/g,孔容为1.2m3/g,孔径为3.5nm。
2.粒径和电荷测定:表1为MSN、Chi-MSN的Zeta电位值。从表中可以看出,MSN材料粒子粒径为153nm,Zeta电位为负值-18.5mV。而MSN粒子与壳聚糖复合改性后,粒径为221nm,Zeta电位值变为正值9.43mV。

表1 MSN和chitosan-MSN的粒径和电荷
3.细胞毒性评价结果:MTT法通过检测材料的浸提液对细胞的毒性,可以敏感地从体外评价材料的毒性。本实验中,对比了MSN、chitosan、chitosan-MSN 3种材料的毒性,通过观察发现,小鼠成肌细胞1天内就开始贴壁,生长状态良好,4天后细胞密度增大并持续到7天,材料在培养液中沉于孔板底面,其附近或边缘均长满小鼠成肌细胞。chitosan组、MSN组、chitosan-MSN组的细胞存活率均>90%(图1)。
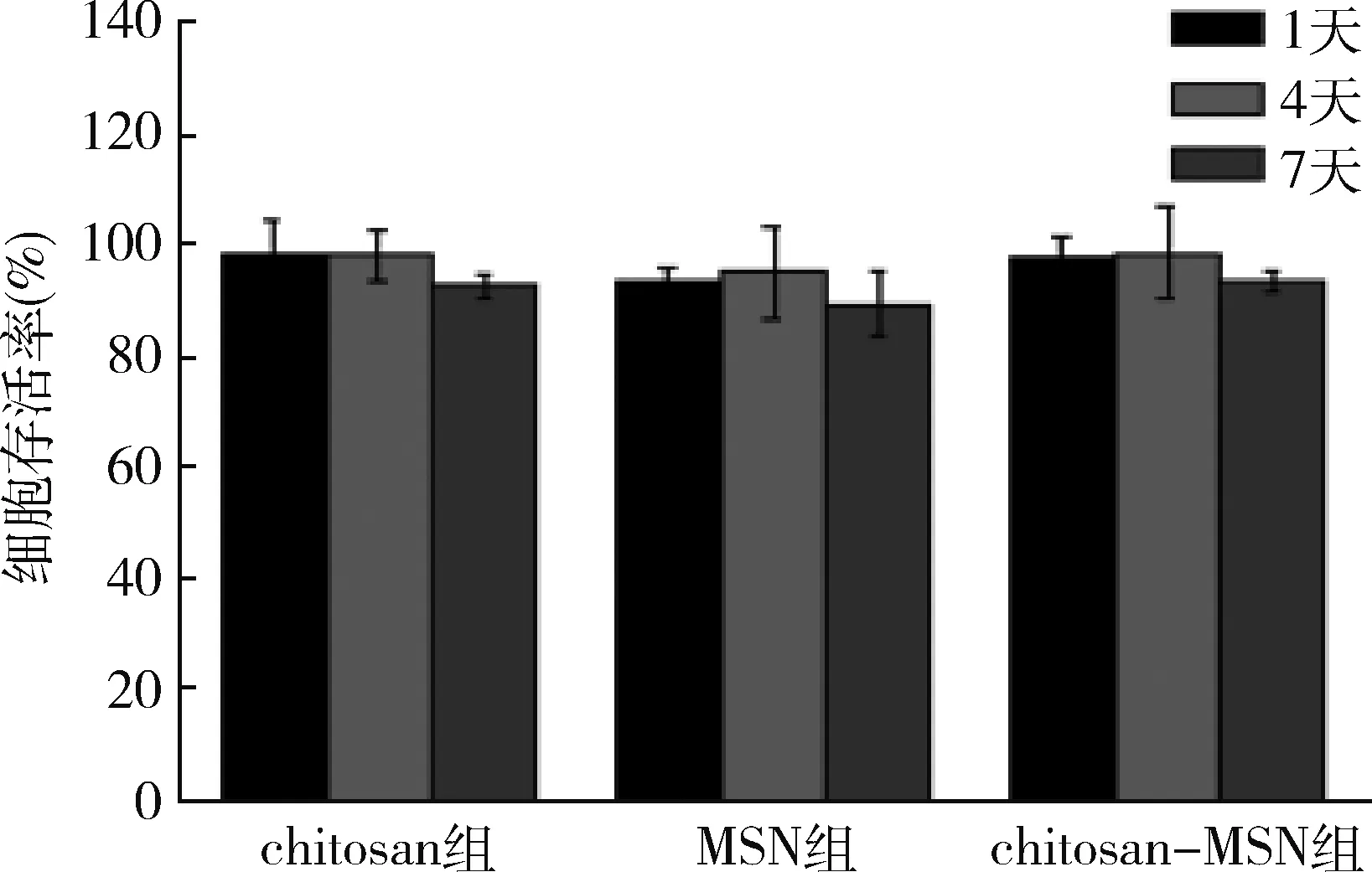
图1 chitosan、MSN、chitosan-MSN 3种材料的细胞存活率
4.吸水性能评价结果:对3种材料吸水率的测定,chitosan的吸水率只有118%,而MSN孔径大,吸水性强,到达295%。而MSN改进后的chitosan吸水率达到281%(图2)。
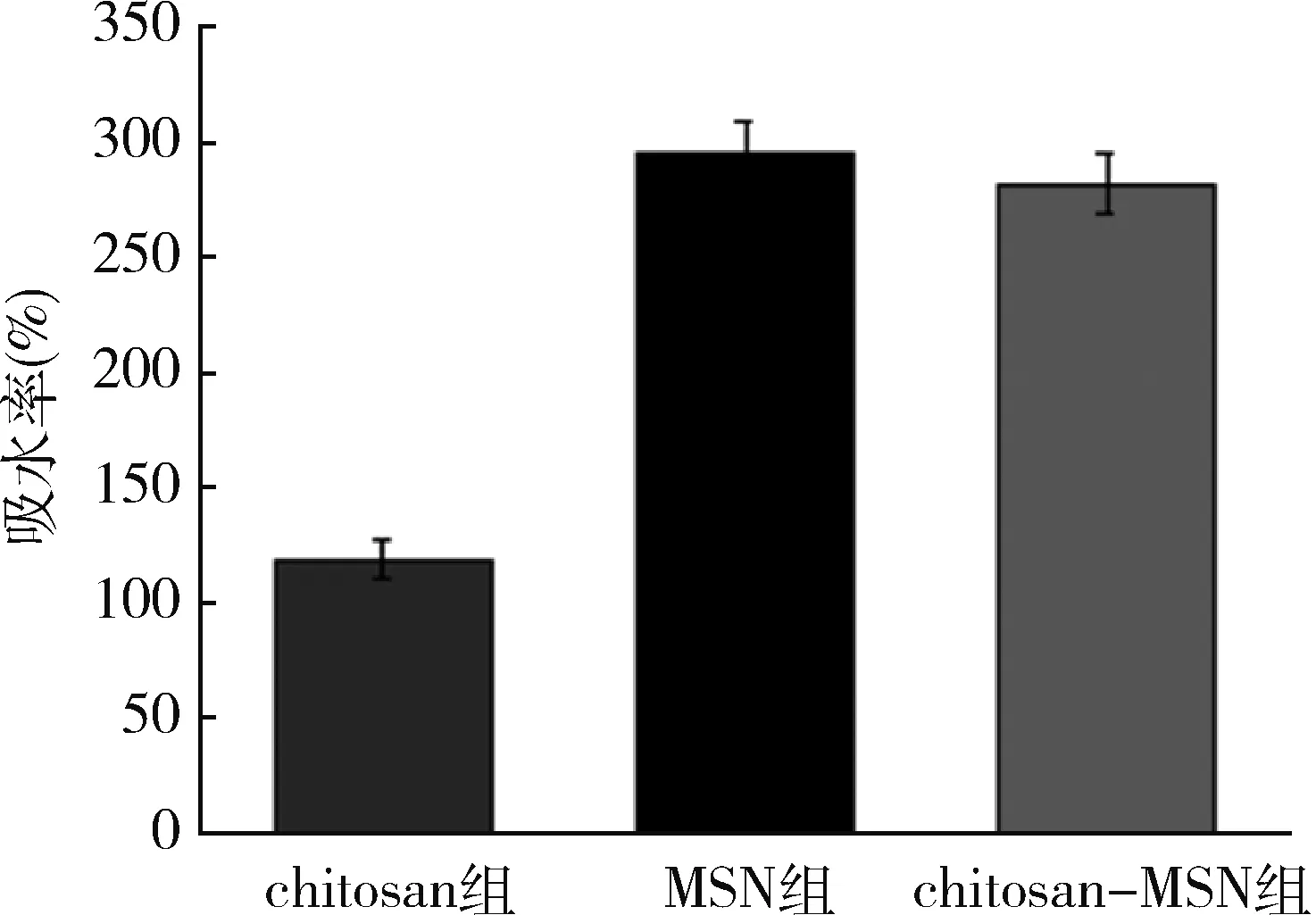
图2 chitosan、MSN、chitosan-MSN 3种材料吸水率
5.APTT和PT测定结果:3种材料的PT均没有显著影响(图3),但3种材料的APTT都有所下降。同时通过对3种材料间的对比,MSN和chitosan都有止血作用,与空白对照组比较,分别下降了18%和27%,而通过MSN修饰后的复合材料,止血效果有了显著的提高,APTT下降了56%,进一步证明了复合的chitosan-MSN有着更好的止血效果。
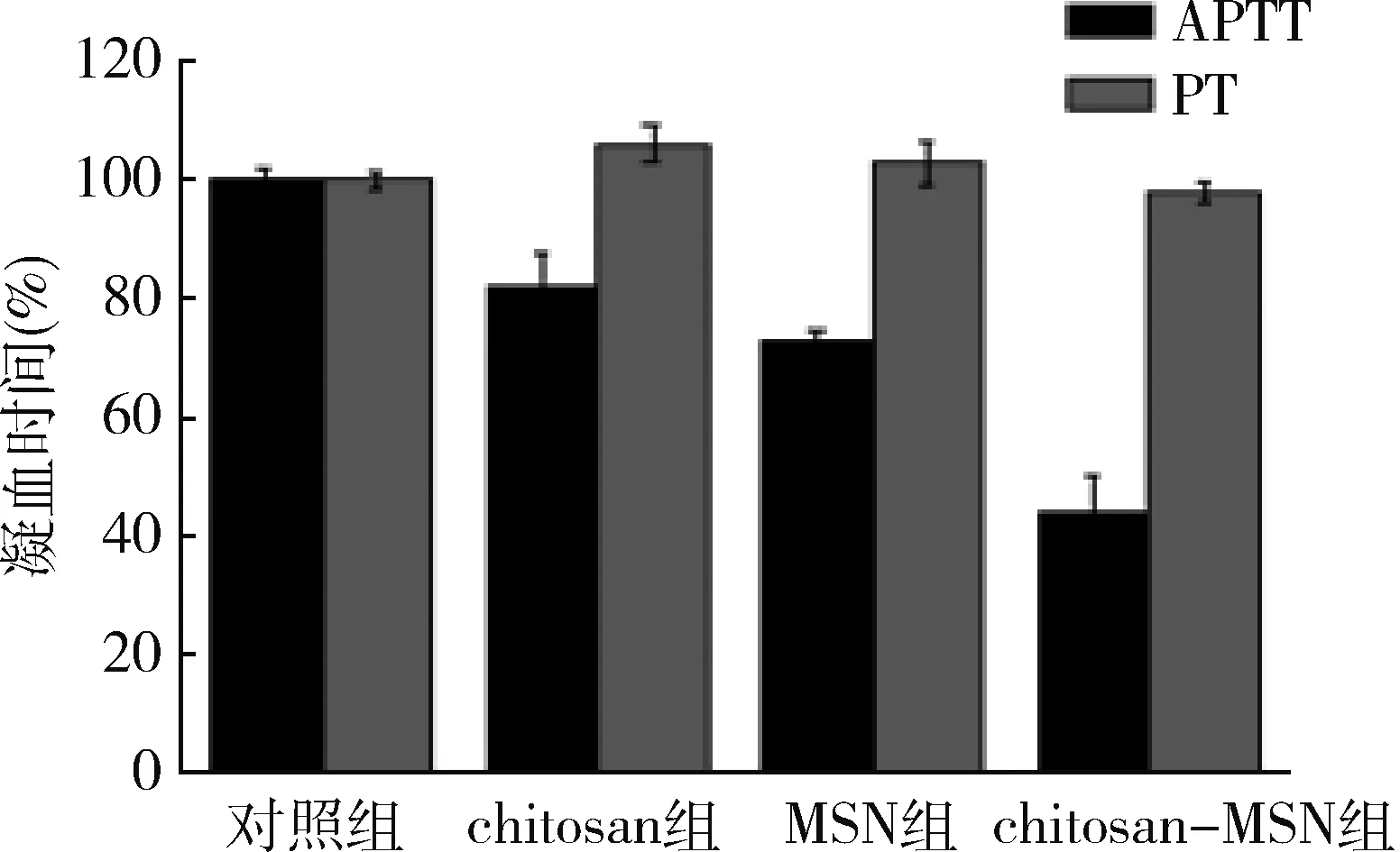
图3 chitosan、MSN、chitosan-MSN 3种材料活化部分凝血活酶时间(APTT)和凝血酶原时间(PT)相对于空白对照组的比率
6.肝创伤出血模型止血性能评价:本实验采用兔
的肝脏创伤出血模型,制造相对恒定的出血创面。在此基础上应用chitosan、chitosan-MSN两种止血剂,和不加任何止血剂,只用纱布止血进行对比,测量动物的出血量和出血时间。由图4可见,chitosan-MSN材料覆盖于出血的“十”字型创口上,并成功止血,同时也能很好地黏附于组织,不易脱落,有助于止血。在对止血时间的记录上,相较于纱布止血的对照组,chitosan和chitosan-MSN都显示出较好的止血效果,止血时间明显缩短(图5)。但chitosan-MSN组的止血时间比chitosan组更短。
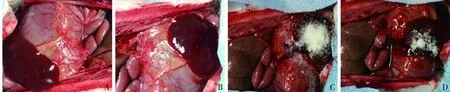
图4 chitosan-MSN复合材料在肝创伤模型中的止血过程图
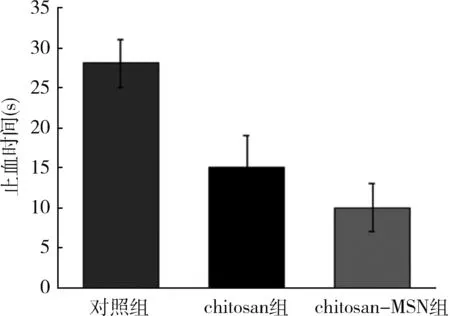
图5 3组止血时间
讨 论
壳聚糖(chitosan)作为一种具有多种功能的生物材料,具有较好的凝血特性,同时有着无毒、无抗原性等优点,以止血迅速而运用于军事行动和外科手术止血中。但其亲水和吸水性能较差,对人体有一定的微刺激性,同时单纯的壳聚糖止血效果有限,难以适用于实质脏器的大面积创伤的广泛出血[12]。近年来,介于微孔和大孔材料之间的介孔材料的发展,给解决这些问题提供新的思路。其有着孔容较大、比表面积较高、孔道结构有序且可调的特点,同时可在其孔道或表面进行物理吸附或化学修饰,固定功能分子等优势[13]。本身同样有着止血作用的介孔二氧化硅可以对壳聚糖的止血性能进行进一步的改进和完善,本实验预先制备出介孔二氧化硅(MSN),再通过相转移和分子印迹原理,用MSN对壳聚糖进行改性和修饰,以期提高止血性能。
止血是指停止受损血管出血的过程,并且是在几个连续阶段中进行的,包括血管的收缩,凝血级联反应的激活和血凝块的形成。因此,加速上述任何阶段的止血剂都可以有助于实现理想的止血[14]。壳聚糖通过自身所具有的聚阳离子特性,诱导红细胞的黏附和聚集,同时促进血小板的活化和凝集,以及激活补体系统,最终形成血凝块,起到止血的作用[15]。在此基础上,笔者将介孔二氧化硅引入,作为一种纳米级的二氧化硅,已有研究表明,纳米级的二氧化硅能与血液中的凝血因子FⅫ直接作用,激活FⅫ,且二氧化硅的粒径越小,激活作用越强[16]。FⅫ作为内源性凝血系统的启动因子,其活化的加速有助于凝血级联反应的加速,促进止血,本研究中APTT时间在MSN组的减少也进一步证明这一机制。同时MSN可以利用其较大孔容、高比表面积、三维孔隙系统等优势,吸收血液和组织中的水分,从而起到凝血因子和血小板浓缩的作用[17]。有助于壳聚糖更好地促进血小板的活化与聚集,克服其不适用于实质脏器创伤广泛出血的缺陷。本研究中,chitosan-MSN复合材料,在肝脏创伤出血模型中的作用也证明了改材料的止血性能。同时有研究认为,止血材料快速凝血作用导致血液在材料表面迅速凝结并堵塞材料的多孔结构,从而阻碍材料的进一步吸收液体的作用,这也是导致止血材料不能充分发挥作用的关键,本研究探索MSN为内核,壳聚糖为外壳,制备具有吸水性MSN内核和大孔壳聚糖外壳的材料,克服了这一弊端,有助于提高止血性能[18]。
理想的止血材料不仅要有很好的止血性能,而且要兼具好的生物相容性和安全性。本研究中,通过MTT法对材料的细胞毒性进行了评价,根据结果本研究发现chitosan-MSN组处理细胞1、4和7天后的细胞存活率均要高于90%,没有表现出明显的细胞毒性,进一步验证了该复合材料良好的生物相容性。因为复合材料有通过吸附血液中的水份来起到止血作用这一机制,因此安全性同样不可忽略。沸石止血剂(quickclot),这样一种通过FDA认证并被投入使用的止血剂,已经被证明在控制创伤性大出血有着出色的效果[19]。其具有较大的比表面积,可以从血液中选择性快速吸附大量水以促进凝血因子和血小板的浓缩与凝结,但在吸附水的同时,释放大量的热,易造成使伤员感到疼痛和创面的灼伤,现已不推荐在战场使用[20]。本研究中采用的MSN材料,已被证明有着良好的水热稳定性,不会造成创面的灼伤,是一种安全的止血材料。
综上所述,壳聚糖-介孔二氧化硅复合材料有着良好的止血性能、生物相容性和安全性,有着一定的应用前景,但其涉及的凝血机制可能是多个材料参与的多条凝血途径,有待于进一步探索研究。