不同类型低频电磁场抵抗失重引起的骨流失
2019-03-05李文苑田永辉高玉海朱保应葸慧荣陈克明
李文苑,田永辉,高玉海,朱保应,葸慧荣,陈克明
中国人民解放军联勤保障部队第九四○医院骨科研究所,兰州 730050
随着载人航空事业的发展,宇航员因太空失重引起的身体状况异常倍受关注,其中一个严重问题是失重引起的骨量丢失现象,失重会使骨质量大幅下降,最终导致骨质疏松症发生[1- 3]。研究显示,电磁场治疗骨质疏松症安全又可靠,是防治失重导致骨丢失的潜在对策之一[4- 8]。目前电磁场已被开发出多种类型,低频脉冲电磁场(pulse electromagnetic fields,PEMFs)和正弦交变电磁场(sinusoidal electromagngetic fields,SEMFs)由于疗效明显被广泛应用于研究。本课题组前期通过研究不同强度PEMFs和SEMFs对成骨细胞增殖和成熟矿化强度进行筛选,分别筛选出0.6 mT 50 Hz的PEMFs和1.8 mT 50 Hz的SEMFs为促进成骨细胞成熟矿化的最佳参数[9- 13],且在动物实验中得到进一步验证。但是对于哪种类型电磁场疗效更好,并没有明确描述。方清清等[14]研究发现,PEMFs可以激活环磷酸腺苷(cyclic adenosine monophosphate,cAMP)信号通路来促进成骨细胞成熟矿化,甲状旁腺激素(parathyroid hormone,PTH)作为一种信号分子,可以引起cAMP信号通路级联反应。至于PEMFs是否可通过促进大鼠体内PTH含量增加,进一步激活cAMP信号通路来防止后肢悬吊(hindlimb-suspended,HLS)大鼠骨量下降,其具体机制尚待进一步研究。尾吊大鼠模型是一种在实验室中模拟失重的良好模型[15],本研究采用该模型系统研究了PEMFs和SEMFs对尾吊大鼠骨代谢影响,以期获得治疗效果最佳的电磁场类型,为临床治疗废用型骨质疏松症提供依据,并为探讨电磁场治疗骨质疏松症分子机制提供依据。
材料和方法
材料高分辨率活体显微CT(Micro-CT SkyScan1176,比利时Bruker micro CT 公司),双能X射线骨密度仪(GE公司,美国),BX53型正置显微镜(奥林巴斯公司,日本),AG-X系列台式电子万能试验机(岛津公司,日本),酶标仪(BioTeK公司,美国),SP1600硬组织切片机(德国Leica公司);水合氯醛(天津大茂化学试剂公司),血清骨钙素(osteocalcin,OC)试剂盒(上海研吉公司),抗酒石酸酸性磷酸酶5b试剂盒(tartrate-resistant acid phosphatase 5b,Tracp 5b;IDS Itd公司,英国),甲状旁腺激素(parathyroid hormone,PTH)ELISA试剂盒(TSZ,Lexington,MA,美国),cAMP ELISA试剂盒(Enzolife sciences公司,美国)。
电磁场发生仪本研究所使用的磁场发生器由中国现代物理研究所和兰州理工大学信息工程学院联合研制,由程序控制计算机、数模转换器、功率放大器、电磁铁、磁场传感器和温度传感器6部分组成。数字模拟转换器(型号USB4711A,台湾燕化,中国台北)将数字信号转换成模拟信号(图1),功率放大器放大信号,将产生电磁场的螺线管连接到功率放大器。螺线管由3个串联连接的线圈组成,芯筒是丙烯酸管(直径40 cm,高64 cm)。该装置能够产生0~5.0 mT的磁感应强度范围和5~100 Hz的频率范围,并经中国人民解放军兰州军区医学计量检测站校准过,测量出磁场中的电磁发生器环境里的通量密度被认为是统一的,报告编号:医用磁性字ccqd.2008- 1。
实验动物及分组6周龄SPF级雌性SD大鼠40只,体质量(180±10)g,由中国农业科学院兰州畜牧兽医研究所[许可证号:SCXK(2015- 0001)]提供,实验开始前先训养大鼠1周,按照体质量随机分为对照组、HLS组、HLS+PEMFs组和HLS+SEMFs组4组,每组10只。采用75%的乙醇为大鼠尾巴消毒后,用胶带在大鼠尾端1/3处固定,使用带环的铁链穿过胶带,将其后肢抬离笼底俯仰角为30°,所有大鼠被固定环安装在定制设计的有机玻璃笼(45 cm×45 cm×45 cm)顶部的旋转箍上。HLS+PEMFs组采用50 Hz 0.6 mT的PEMFs,HLS+SEMFs组采用50 Hz 1.8 mT的SEMFs,治疗组每天干预1.5 h,治疗期间大鼠仍然保持后肢悬空(图1)。大鼠饲养温度(22±2)℃,湿度50%~70%。实验期间大鼠自由进水进食,每周监测1次大鼠体质量。
骨密度检测电磁场治疗4周后处死全部大鼠,剥离主要器官固定于10%甲醛溶液中。剥离股骨、胫骨和椎骨,用0.9% NaCl浸泡过的纱布包裹,于-20 ℃保存。检测前将冻存于-20 ℃冰箱中的椎骨和股骨在室温下自发解冻。通过双能X射线吸收测定法检测股骨和椎骨的骨密度(bone mineral density,BMD)。
生物力学检测椎骨和右侧股骨用浸透了0.9% NaCl溶液的纱布包裹后置于-80 ℃冻存,临用前自然解冻。股骨置于AG-IS型万能试验机上进行三点弯曲测试,跨距14 mm,加载速度10 mm/min,计算机记录载荷变形曲线及最大载荷、弹性模量等。取大鼠第4腰椎骨(L4)用于压缩试验,将椎体两面的椎间盘及软组织切除,用砂纸将椎骨打磨成上下两个面平行的圆柱体,将圆柱体垂直放置于不锈钢平台上,逐渐加载压力,加载速度为2 mm/min,记录载荷变形曲线,获得最大载荷、弹性模量等。

HLS:后肢悬吊
HLS:hindlimb-suspended
A.HLS大鼠;B.电磁场发生装置;C.数模转换器;D.电磁场治疗尾吊大鼠
A. HLS rats;B. electromagnetic field device;C. the digital to-analog converter;D. the device producing electromagnetic fields for animal exposure
图1尾吊大鼠造模
Fig1Modeling of HLS rats
血清生化指标检测大鼠麻醉后自腹主动脉抽取血样,静置10 min,1533×g离心10 min,取上层血清冻存于-80 ℃。检测骨形成指标OC和骨吸收指标Tracp 5b。按说明书制作各自标准曲线,计算出样品中OC和Tracp 5b的含量,单位分别为ng/ml和U/L。采用ELISA法分别测定PTH和cAMP的含量。
Micro-CT分析将大鼠股骨用显微CT成像后分析,分析区域选在骨骺线下方5 mm处。用显微CT软件对所选区域进行三维重建,得出三维重建效果图及股骨最大纵剖面图。同时对股骨松质骨的骨微结构进行骨形态参数分析,包括BMD、骨表面积(bone surface area,BS)/骨体积(bone volume,BV)、BV/组织体积(tissue volume,TV)、骨小梁数量(number of trabecular bone,Tb.N)、骨小梁厚度(trabecular thickness,Tb.Th)和骨小梁离散程度(trabecular bone dispersion,Tb.Sp),采用MicroView程序自动量化。同时检测皮质骨厚度(cortical bone thickness,Ct.Th)和皮质骨面积(cortical bone area,Ct.Ar)。
骨形态计量学分析将胫骨在4%多聚甲醛中固定24 h,然后在10%的EDTA溶液中脱钙2周,沿中线纵向切成两半,进行石蜡包埋。获得4 μm厚切片,将其固定在聚赖氨酸处理的抗脱落载玻片上,脱蜡行HE染色,然后在光学显微镜下检查。成骨细胞的密度是通过计数梭形的单核细胞,沿皮质骨和小梁骨表面6个连续的原生海绵体图像表示为每mm2骨小梁面积的成骨细胞数。骨髓面积内的脂肪细胞空洞计数,在4个随机图像内的松果体下部区域,表示为每mm2骨髓面积的脂肪细胞数量。
统计学处理采用SPSS 20.0统计软件,计量数据以均数±标准误表示,不同组间差异比较采用单因素方差分析,组间两两比较用LSD法,P<0.05为差异有统计学意义。
结 果
大鼠体质量实验期间保持大鼠一定的空间自由,大鼠饮食正常,无断肢、拒绝饮水的情况,精神状况良好。4组大鼠体质量均稳定增加,HLS组大鼠体质量增加速度降低,但4组间差异没有统计学意义(P均>0.05)(图2)。
股骨和椎骨离体BMD对照组、HLS组、HLS+PEMFs组和HLS+SEMFs组股骨的BMD分别为(0.1450±0.0037)、(0.1080±0.0020)、(0.1260±0.0044)和(0.1250±0.0038)g/cm3,椎骨的BMD分别为(0.1260±0.0020)、(0.1140±0.0026)、(0.1210±0.0017)和(0.1200±0.0030)g/cm3,HLS组股骨(P=0.000)和椎骨(P=0.001)的BMD显著低于对照组;HLS+PEMFs组股骨(P=0.001)和椎骨(P=0.039)的BMD显著高于HLS组;HLS+SEMFs组股骨的BMD明显高于HLS组(P=0.003),但椎骨的BMD与HLS组差异无统计学意义(P=0.130);HLS+PEMFs组和HLS+SEMFs组股骨(P=0.818)和椎骨(P=0.614)的BMD差异均无统计学意义。

PEMFs:低频脉冲电磁场;SEMFs:正弦交变电磁场
PEMFs:pulse electromagnetic fields;SEMFs:sinusoidal electromagngetic fields
图24组大鼠体质量变化趋势
Fig2Changes in the body weight of four groups
股骨和椎骨生物力学结果对照组、HLS组、HLS+PEMFs组和HLS+SEMFs组股骨的最大载荷分别为(135.0±4.0)、(108.0±3.7)、(125.0±5.8)和(117.0±5.9)N,弹性模量分别为(12 184.0±687.0)、(9447.0±973.0)、(10 561.0±565.1)和(10 212.0±716.5)N/mm2;椎骨的最大载荷分别为(264.0±16.5)、(195.0±15.4)、(254.0±20.1)和(228.0±16.9)N,弹性模量分别为(152.0±31.9)、(73.0±5.4)、(98.0±11.5)和(131.0±16.1)N/mm2;HLS组股骨和椎骨的最大载荷(P=0.000,P=0.009)和弹性模量(P=0.015,P=0.009)显著低于对照组;HLS+PEMFs组股骨(P=0.038)和椎骨(P=0.087)的最大载荷显著高于HLS组,但弹性模量与HLS组相比差异无统计学意义(P=0.324,P=0.091);HLS+SEMFs组股骨和椎骨的最大值载荷(P=0.190,P=0.222)和弹性模量(P=0.512,P=0.437)与HLS组相比差异均无统计学意义。HLS+PEMFs组和HLS+SEMFs组股骨(P=0.585,P=0.948)和椎骨(P=0.668,P=0.349)的最大载荷和弹性模量差异均无统计学意义。
血清生化指标对照组、HLS组、HLS+PEMFs组和HLS+SEMFs组的血清OC浓度分别为(63.6±2.79)、(39.5±1.84)、(57.3±3.36)和(50.9±2.19)mg/ml,HLS组的血清OC水平显著低于对照组(P=0.000),HLS+PEMFs组(P=0.000)和HLS+SEMFs组(P=0.006)的OC水平显著高于HLS组。
对照组、HLS组、HLS+PEMFs组和HLS+SEMFs组的血清Tracp 5b浓度分别为(1.860±0.114)、(3.380±0.600)、(2.270±0.381)和(2.260±0.500)U/L,HLS组的血清Tracp 5b浓度显著高于对照组(P=0.011),HLS+PEMFs组(P=0.459)和HLS+SEMFs组(P=0.469)与对照组相比差异无统计学意义;HLS+PEMFs组(P=0.056)和HLS+SEMFs组(P=0.054)的血清Tracp 5b浓度与HLS组相比差异无统计学意义。
对照组、HLS组、HLS+PEMFs组和HLS+SEMFs组的血清PTH浓度分别为(23.10±1.34)、(10.40±0.68)、(21.30±1.35)和(18.30±0.93)mg/L,cAMP浓度分别为(0.255±0.004)、(0.179±0.008)、(0.246±0.006)和(0.242±0.004)pmol/ml,HLS组的PTH(P=0.000)和cAMP浓度(P=0.000)显著低于对照组;HLS+PEMFs组和HLS+SEMFs组的PTH(P=0.000,P=0.000)和cAMP浓度(P=0.000,P=0.000)的浓度显著高于HLS组。
松质骨Micro-CTHLS组股骨松质骨与对照组相比非常稀疏,且体积较小。而对照组、HLS+PEMFs组和HLS+SEMFs组的松质骨密度和体积很接近。定量分析结果显示,与对照组相比,HLS组大鼠的BMD(P=0.000)、BV/TV(P=0.000)、Tb.N(P=0.000)和Tb.Th(P=0.000)最低,Tb.Sp(P=0.000)和BS/BV(P=0.000)最大;与HLS组相比,HLS+PEMFs组和HLS+SEMFs组的Tb.Sp(P=0.000,P=0.000)和BS/BV(P=0.000,P=0.000)显著降低,BMD(P=0.000,P=0.000)、BV/TV(P=0.001,P=0.004)、Tb.Th(P=0.000,P=0.001)和Tb.N(P=0.000,P=0.001)显著升高。HLS+PEMFs组和HLS+SEMFs组的骨小梁厚度差异有统计学意义(P=0.024)(图3)。

BMD:骨密度;BS:骨表面积;BV:骨体积;TV:组织体积;Tb.N:骨小梁数量;Tb.Sp:骨小梁离散程度;Tb.Th:骨小梁厚度;与对照组相比,aP<0.01;与HLS组相比,bP<0.01;与HLS+PEMFs组相比,cP<0.05
BMD:bone mineral density;BS:bone surface area;BV:bone volume;TV:tissue volume;Tb.N:trabecular bone number;Tb.Sp:trabecular bone dispersion;Tb.Th:trabecular thickness;aP<0.01 compared with control group;bP<0.01 compared with HLS group;cP<0.05 compared with HLS+PEMFs group
A.骨小梁微结构的3D显微图像;B.BMD;C.BS/TV;D.BV/TV;E.Tb.N;F.Tb.Th;G.Tb.Sp
A.3-D Micro-CT images of trabecular bone microarchitecture determined by the VOI;B.BMD;C.BS/TV;D.BV/TV;E.Tb.N;F.Tb.Th;G.Tb.Sp
图3股骨小梁骨Micro-CT比较和统计学分析
Fig3The Micro-CT of trabecular bone microarchitecture in the distal femora and statistical comparisons of indices of trabecular bone microarchitecture
皮质骨Micro-CTHLS组皮质骨的大小和厚度小于对照组、HLS+PEMFs组和HLS+SEMFs组,HLS+PEMFs组和HLS+SEMFs组与对照组差异不大。定量分析结果显示,对照组(P=0.001,P=0.000)、HLS+PEMFs组(P=0.009,P=0.044)和HLS+SEMFs组(P=0.001,P=0.008)的Ct.Th和Ct.Ar均明显高于HLS组;HLS+PEMFs组的Ct.Ar显著低于对照组(P=0.021),但Ct.Th与对照组差异无统计学意义(P=0.095);HLS+SEMFs组Ct.Ar(P=0.001)和Ct.Th(P=0.019)显著低于对照组;HLS+PEMFs组和HLS+SEMFs组的Ct.Th(P=0.102)和Ct.Ar(P=0.329)差异无统计学意义(图4)。
骨形态计量分析HLS组(P=0.000)、HLS+PEMFs组(P=0.000)和HLS+SEMFs组(P=0.000)骨小梁表面成骨细胞密度明显低于对照组,HLS+PEMFs组(P=0.000)和HLS+SEMFs组(P=0.000)明显高于HLS组(图5)。

Ct.Th:皮质骨厚度;Ct.Ar:皮质骨面积;与对照组相比,aP<0.05,bP<0.01;与HLS组相比,cP<0.05,dP<0.01
Ct.Th:cortical bone thickness;Ct.Ar:cortical bone area;aP<0.05,bP<0.01 compared with control group;cP<0.05,dP<0.01 compared with HLS group
A.皮质骨结构的3D显微图像;B.Ct.Th;C.Ct.Ar
A. the effects of cortical bone thickness in the mid-diaphysis;B. Ct.Th;C. Ct.Ar
图4股骨皮质骨3D显微图像以及统计分析
Fig4The Micro-CT of cortical bone microarchitecture in the distal femora and statistical comparisons of indices of cortical bone microarchitecture

与对照组相比,aP<0.01;与HLS组相比,bP<0.01
aP<0.01 compared with control group;bP<0.01 compared with HLS group
A.由箭头指向的小梁骨表面的成骨细胞(HE,×40);B.每mm2骨小梁的成骨细胞数
A. the osteoblasts on the surface of trabecular bone(arrows)(HE,×40);B. the osteoblasts per mm2trabecular bone
图5骨小梁成骨细胞密度HE染色及分析
Fig5The osteoblast density in trabecular bone
HLS组骨内膜成骨细胞密度显著低于对照组(P=0.000),HLS+PEMFs组(P=0.000)和HLS+SEMFs组(P=0.000)显著高于HLS组,HLS+PEMFs组又显著高于HLS+SEMFs组(P=0.041)(图6)。
HLS组相比对照组骨髓腔中产生大量脂肪空洞,但治疗组中脂肪空洞明显减少,几乎与对照组没有差别。统计结果显示,HLS组每mm2骨髓中的脂肪空洞数目是对照组的4倍(P=0.000),HLS+PEMFs组(P=0.000)和HLS+SEMFs组(P=0.000)显著低于HLS组,HLS+PEMFs组和HLS+SEMFs组间差异无统计学意义(P=0.086)(图7)。
讨 论
电磁场是治疗骨质疏松疾病最广泛研究的模式之一,据报道,极低强度、低频率的电磁场可以显著抑制双侧去卵巢大鼠的骨小梁骨流失,电磁场还可以部分预防糖尿病引起的骨骼强度和骨微结构受损情况[16- 17]。由于宇航员受到空间环境中微重力的影响而导致骨量下降,所以本课题组推测电磁场在太空失重环境下可能会具有很高的实用度。但是,目前电磁场治疗仍然存在争议,因为还没有建立标准化的治疗方案或参数选择原理。为了达到理想的预防效果,需要研究出一套完整的最佳治疗参数,才能为临床上治疗废用型骨质疏松提供有力帮助。
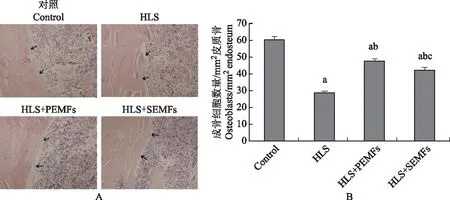
与对照组相比,aP<0.01;与HLS组相比,bP<0.01;与HLS+PEMFs组相比,cP<0.05
aP<0.01 compared with control group;bP<0.01 compared with HLS group;cP<0.05 compared with HLS+PEMFs group
A.由箭头指向的皮质骨表面的成骨细胞(HE,×20);B.每mm2骨内膜的成骨细胞数
A. the osteoblasts on the surface of endosteum bone(arrows)(HE,×20);B. the osteoblasts per mm2endosteum bone
图6皮质骨成骨细胞密度HE染色及分析
Fig6The osteoblast density in endosteum bone

与对照组相比,aP<0.01;与HLS组相比,bP<0.01
aP<0.01 compared with control group;bP<0.01 compared with HLS group
A.箭头指出的骨髓中的脂肪细胞空洞(HE,×20);B.每mm2骨髓的脂肪细胞空洞数
A. the adipocytes hole in the bone marrow(arrows)(HE,×20);B. the adipocytes hole in bone marrow(arrows)
图7骨髓中脂肪细胞空洞数量HE染色及分析
Fig7Number of adipocytes hole in bone marrow
体质量趋势可以反映大鼠在饲养过程中的状况,本研究结果显示,实验期间所有大鼠的体质量均呈上升趋势,各组间无显著差异,生长状况稳定。BMD反映的是骨量的多少,是衡量骨强度的良好标志,骨生物力学性则能直接反映出骨的抗性,其中最大载荷量反映骨的抗骨折能力,弹性模量反映骨的相对韧性[18- 19]。本研究发现,4周后HLS组大鼠的BMD较对照组大鼠显著下降,而电磁场治疗可以显著提高HLS大鼠的BMD,两种电磁场作用效果相比之下PEMFs对提高大鼠BMD的效果更好,且对股骨BMD的提高更明显。本研究还显示,HLS组大鼠股骨和椎骨弹性模量和最大载荷值明显下降,电磁场治疗后可以显著提高HLS大鼠的最大载荷值,而且对大鼠股骨和椎骨抗骨折能力的提高更为明显,但是对骨骼韧性并没有显著促进,其中PEMFs治疗对大鼠生物力学强度的提高更为有效。
骨骼能够保持其正常结构和功能完整性,是由于成骨细胞介导的骨形成和破骨细胞介导的骨吸收之间的动态平衡。生化指标可体现体内的骨代谢水平,客观反映大鼠的骨吸收和骨形成。本研究发现,HLS组大鼠的骨形成标记物(OC)浓度减少和骨吸收标记物(Tracp 5b)浓度增加,两种电磁场治疗对大鼠OC含量具有一定提高作用,但是对Tracp 5b浓度的抑制作用不佳。提示电磁场是通过促进骨形成来防止骨量下降,且PEMFs治疗效果更为明显。
PTH可以减少钙作为钙调节激素从骨中的流出,并具有活化成骨细胞生成和存活的作用,作为自然合成的代谢产物可增加骨形成。失重环境和长期卧床休息会导致PTH下降,并伴随着骨形成减少[20- 21]。在本研究中,治疗组血清中的PTH水平与对照组保持相似水平,表明电磁场可通过维持血清中PTH水平来预防骨质流失。PTH是启动下游cAMP信号通路的关键信号分子,尾吊会导致cAMP含量下降,但是电磁场治疗可以维持血清PTH和cAMP水平。本研究提示cAMP信号传导可能参与了由微重力环境下引起的骨形成调节,而电磁场可以通过影响PTH的含量来激活cAMP信号通路。
Micro-CT常用于骨微结构的研究,可以直观观察大鼠松质骨和皮质骨骨微结构的变化。本研究在大鼠股骨Micro-CT观察到HLS组大鼠松质骨和皮质骨的面积和体积下降,骨微结构被破坏,计量分析发现HLS导致松质骨BMD、BV/TV、Tb.N和Tb.Th降低,但是BS/BV和Tb.Sp明显升高,皮质骨Ct.Ar和Ct.Th显著下降。电磁场治疗阻止半数或更多的骨密度下降,最大程度保留其股骨松质骨显微结构和皮质骨厚度。通过进一步骨组织形态计量学观察大鼠骨内膜和骨小梁表面成骨细胞数量,发现HLS大鼠成骨细胞骨密度减少,骨髓中的脂肪细胞数目增加了4倍之多。由于骨髓脂肪细胞与成骨细胞之间的有一定制约关系,类似航天或失重环境中会导致成骨性突变的状况,骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)会向脂肪形成方向转移,并导致骨髓中脂肪球的形成[22]。电磁场治疗降低了尾吊对BMSCs成脂性分化的作用,并将脂肪细胞密度限制在与对照相似的水平。本研究结果表明,电磁场可以促进成骨细胞数量增多和抑制BMSCs的成脂分化能力,部分治疗尾吊大鼠的骨量减少和骨微结构的恶化,其中PEMFs治疗促进骨形成的效果更好。
总之,50 Hz 0.6 mT PEMFs和50 Hz 1.8 mT SEMFs作为高效的电磁场治疗方法,对HLS大鼠每日治疗90 min可防止大鼠后肢悬吊所引起的骨量下降,其中PEMFs可以防止大约50%的骨质流失。电磁场通过保持正常的骨密度、骨组织微结构、骨几何形态学与骨材料力学强度,提高PTH的血清含量并引起cAMP信号传导途径的激活,在微重力环境中维持骨形成水平。对两种电磁场作用效果的研究发现,PEMFs作用效果更佳,开发利用价值更为广阔,既可以在失重条件下维持骨代谢平衡,保护宇航员骨骼健康,又可以在地面上对废用型骨质疏松症进行预防和治疗。
本研究结果显示,两种电磁场并不能完全抑制骨量的降低和骨微结构的恶化,主要是由于低频电磁场只对于骨形成促进作用显著,而对骨吸收抑制效果不强,推测这可能是后肢悬吊引起的骨丢失没有被完全阻止的重要原因之一。由于电磁场的参数以及类型不同,可能最终的治疗效果也不同,或许可以尝试寻找一种明显抑制骨吸收的电磁场,进一步通过交替使用不同的电磁场,分别促进骨形成和抑制骨吸收,以此来达到完全消除骨丢失的现象。
