老年急性髓系白血病患者减低剂量化疗的疗效及预后影响因素分析
2019-03-05丁志勇赵文理潘韶英王素丽刘娟娟
朱 斌 丁志勇 赵文理 潘韶英 王素丽 刘娟娟
急性髓系白血病(acute myeloid leukemia,AML)是以造血干细胞异常增生为主要病理表现的恶性血液疾病,其发生率与年龄呈显著正相关,其中60岁以上人群的发生率超过4/100000,新发病例中大于70岁的约占35%[1]。化疗是当下AML最有效的方法之一,但老年AML患者由于其生物学及临床特点,耐受性差,初治诱导缓解率低,早期病死率高。研究显示,老年AML患者约占全部AML的1/3,化疗后完全缓解(CR)率仅40%~60%,且85%的患者在2~3年内出现复发[2]。AML的发病机制尚不十分明确,但研究已证实,细胞、分子遗传异常是其致病基础,也是预后判断的重要指标[3~5]。随着小剂量化疗方案的有效性得到证实,越来越多的研究人员倾向于根据患者年龄、预后影响因素制定个性化的治疗方案[6],但老年AML的治疗是否应用减低剂量化疗尚存在争议。本研究对老年AML患者分别采用标准剂量、减低量方案进行治疗,探讨二者的临床疗效,并分析预后的影响因素,现报道如下。
资料与方法
1.一般资料:选择2016年1月~2017年1月于上海健康医学院附属第六人民医院南院血液科收治的老年AML患者,共40例。入组标准:均符合中华医学会血液学分会《成人急性髓系白血病(非急性早幼粒细胞白血病)中国诊疗指南(2011年版)》[7]的相关诊断标准,均为初治病例;患者年龄60~75岁,至少完成2个及以上化疗疗程;排除临床资料不完整,合并其他恶性肿瘤、急性心脑血管疾病及严重心脏、肝脏、肾脏、功能异常等影响预后评估的患者。其中男性22例,女性18例,患者平均年龄69.3±4.5岁;FAB分型:M03例,M15例,M28例,M414例,M510例。将40例患者按照数字表法随机分为减低剂量组和标准化疗组,各20例。两组患者在性别、年龄、WHO分型等方面比较,差异无统计学意义(P>0.05)。本研究经笔者医院伦理学委员会审查,患者或家属表示知情同意。
2.方法:标准化疗组:柔红霉素(DNR)(海正辉瑞制药有限公司,批准文号:国药准字H33020925)40~60mg/(m2·d)×3天,阿糖胞苷(Ara-c)(辉瑞制药有限公司,批准文号:H20080412)100mg/(m2·d)×5~7天;IA方案:去甲氧柔红霉素(IDA)(辉瑞制药有限公司,批准文号:H20110076)8~10mg/(m2·d)×3~4天,Ara-c 100 mg/(m2·d)×5~7天;TA方案:吡柔比星(THP) (海正辉瑞制药有限公司,批准文号:国药准字H20045983)20mg/(m2·d)×3天,Ara-c 100mg/(m2·d)×5~7天。减低剂量组,所用化疗药物均为标准化疗剂量的 30%~60%。
3.观察指标:(1)化疗疗效:根据《血液病诊断及疗效标准(第3版)》[8],将化疗疗效分为CR、部分缓解(PR)、未缓解(NR),其中总有效率(ORR)=(CR+PR)/总病例×100%。(2)预后:采用门诊、电话或入户随访的方式,记录患者的总生存(OS)期,OS期定义为第1次确诊至随访截止日期或死亡(任何原因)为止,随访时间截止至2017年12月31日。(3)预后影响因素:通过查阅病历资料,收集患者的各项临床资料,包括性别、年龄、合并症及Charlson合并症指数(CCI)评分、治疗方案、核型、体能状况(PS)评分;初诊时白细胞(WBC)计数、血红蛋白(Hb)及血小板(PLT)计数、骨髓原始细胞比例、乳酸盐脱氢酶(LDH);治疗过程中骨髓流式细胞术监测CD34+表达水平,实时荧光定量RT-PCR检测微小残留病灶(MRD)-WT1表达水平,采用PCR结合DNA测序技术检测NPM1、FLT3-ITD、CEBPA及C-KIT等AML融合基因的表达水平。
4.统计学方法:采用SPSS 18.0统计学软件对数据进行统计分析,计数资料比较采用χ2检验,生存时间分析采用Kaplan-Meier法,并绘制生存曲线,差异性检验采用Log-Rank法,多因素预后分析采用COX比例风险模型,以P<0.05为差异有统计学意义。
结 果
1.两组化疗疗效比较:减低剂量组ORR为55.0%,标准化疗组ORR为65.0%,二者之间比较差异无统计学意义(χ2=0.42,P>0.05)。详见表1。

表1 两组化疗疗效比较[n(%)]
2.两组预后分析:生存分析结果显示,AML患者中位OS期为8.6个月(95%CI:7.4~9.8),其中减低剂量组、标准化疗组中位OS期分别为8.0个月(95%CI:6.5~9.5)、9.1个月(95% CI:8.2~9.9);两组中位OS期比较,差异无统计学意义(χ2=2.281,P>0.05)。详见图1。
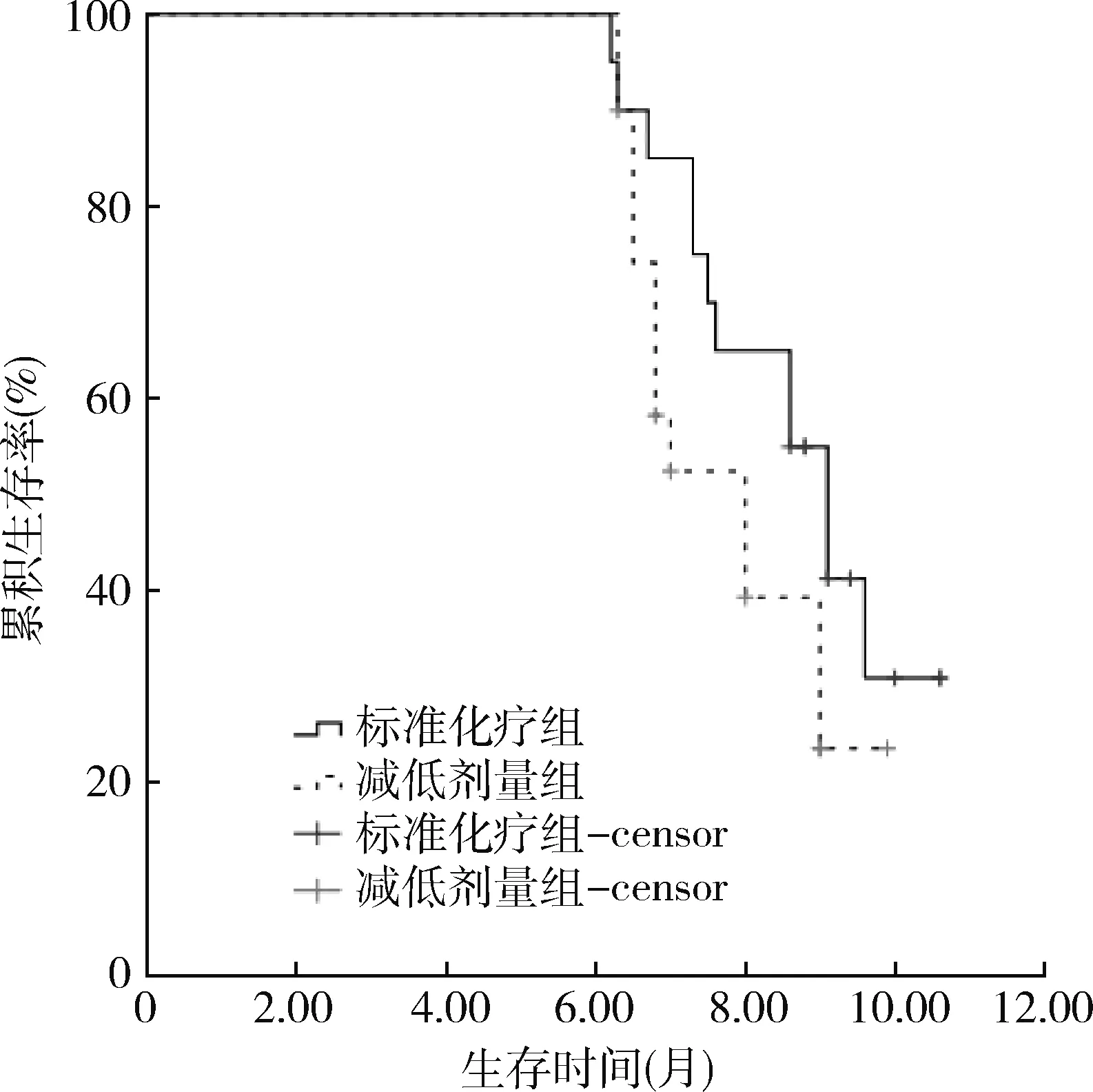
图1 两组患者OS期的生存曲线比较
3.影响老年AML患者预后的单因素分析:单因素分析结果显示,年龄>70岁、CCI评分≥2、PS评分≥2、高危核型、骨髓原始细胞比例>50%、初治时WBC计数≥10×109/L、初治时PLT<40×109/L、CD34+表达阳性、MRD-WT1表达阳性、NPM1突变阴性、C-KIT突变阳性的老年AML患者中位OS期明显缩短,差异均有统计学意义(P<0.05),详见表3。
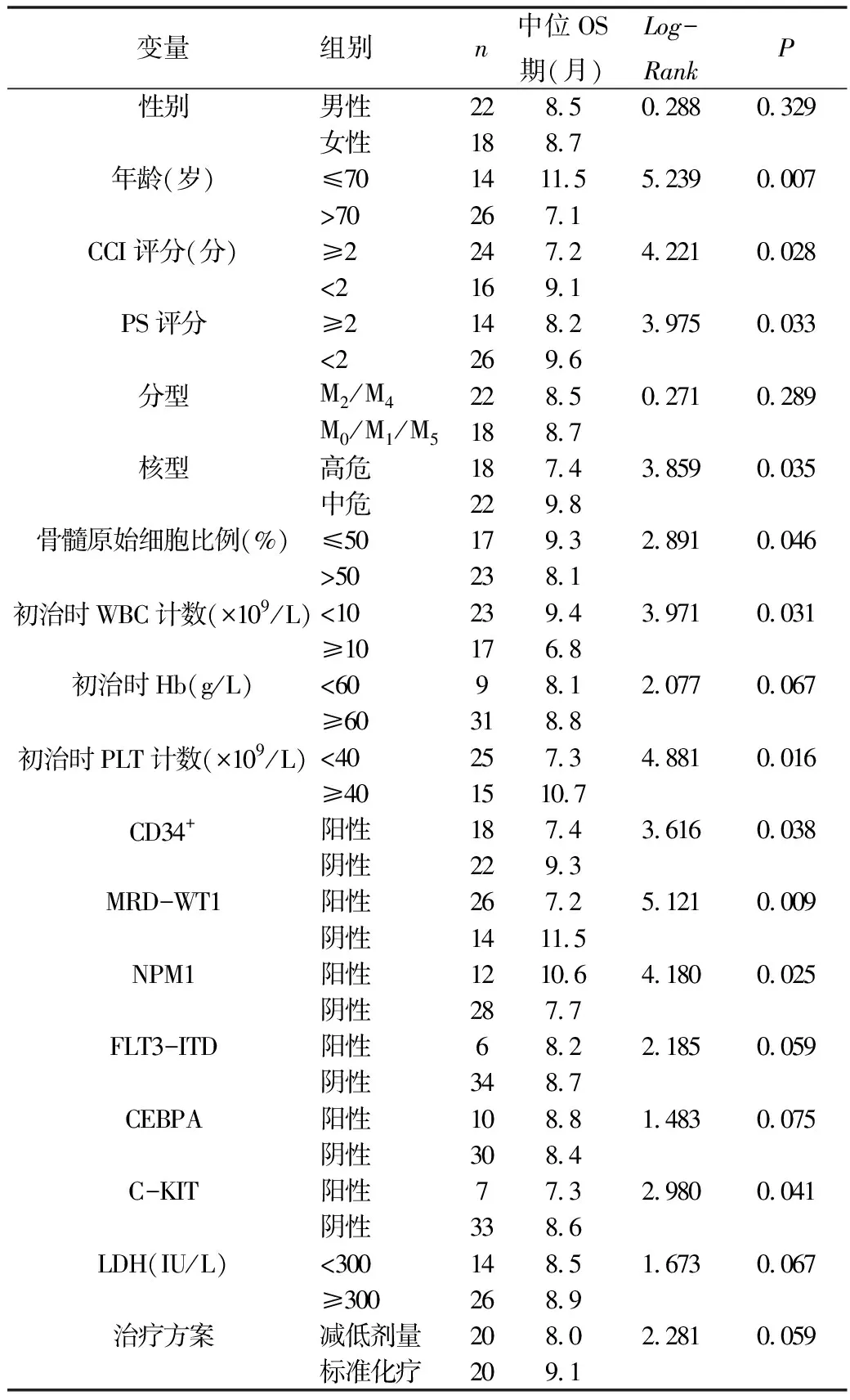
表3 影响老年AML患者预后的单因素分析
4.影响老年AML患者预后的多因素分析:以中位OS期为因变量,将单因素分析有意义的变量纳入多因素COX模型分析,结果显示,年龄、PS评分、初治时WBC计数及MRD-WT1表达阳性是影响老年AML患者预后的独立危险因素(P<0.05)。详见表4。
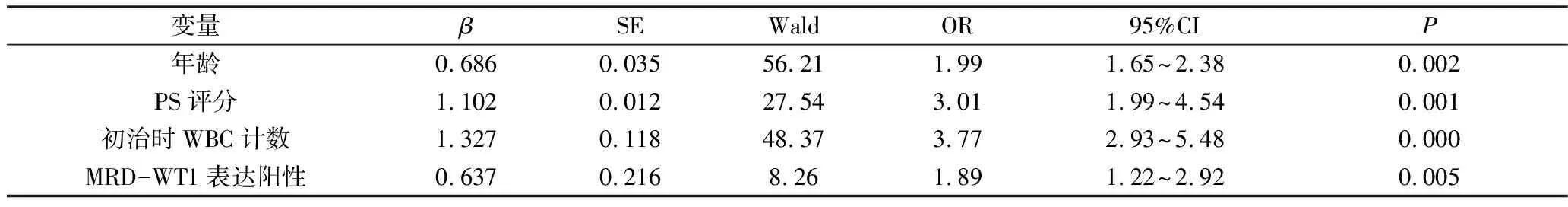
表4 影响老年AML患者预后的多因素分析
讨 论
联合化疗仍是目前AML治疗的主要手段,随着AML患者老龄化现象愈发明显,根据患者的健康状况制定更安全有效的化疗方案一直是棘手的问题,且国内外对于老年AML患者尚缺乏最佳化疗方案。DNA甲基化是AML常见的分子学改变,临床研究认为无论是否有异常基因表达,DNA甲基化异常均存在,且异常甲基化类型与预后相关[9]。近年来,针对AML患者DNA甲基化的治疗药物获得了长足发展,给AML的治疗带来了更多选择。有研究表明,<60岁患者采用标准化疗方案,其CR可达到50%~75%,5年无病生存期(DFS)约40%,而对于老年AML患者而言,完全缓解率仅50%左右,DFS低于12个月,3年DFS率不足15%,化疗早期相关病死率高达30%[10]。即使在新型化疗药物与支持治疗不断更新的情况下,其疗效也无明显突破[11]。同时,通过增加药物剂量提高化疗强度将对患者的正常细胞和组织造成严重损伤,不适用于大部分的此类患者。
近几年,临床研究人员愈发倾向于采用低剂量或亚标准剂量化疗,但在降低化疗药物毒性不良反应及病死率的前提下,能否保证较好的CR率且延长OS期尚不确定[12~14]。李占勇等[15]研究发现,持续小剂量化疗在降低毒性相关性病死率的同时可相对提高CR率,其机制可能在于低剂量化疗药物可通过促进细胞凋亡,并使AML细胞缓慢进入细胞周期而发挥作用。本研究结果显示,减低剂量和标准剂量的诱导缓解方案,老年AML患者的CR率均不高,主要考虑与本组病例的年龄较高有关,而两组CR率、ORR率及OS期比较差异无统计学意义(P>0.05),说明增加剂量并不能进一步提高老年AML患者的化疗效果,反而可能导致并发症风险增加。
研究证实,老年AML患者预后受多种因素的影响,近年随着分子水平研究的深入,基因组学的改变也可能影响AML患者的预后,并发现了可能对预后有影响的相关基因异常。本研究发现,年龄、PS评分、初治时WBC计数及MRD-WT1表达阳性是影响老年AML患者预后的独立危险因素(P<0.05)。年龄、PS评分对预后的影响均与自身健康状况、基础疾病及并发症等有关,与国内外研究结果一致[16,17]。高强度的化疗后骨髓抑制严重,使得药物耐受性和骨髓造血活力进一步衰退,从而影响治疗效果和预后。临床研究也证实,初治时外周血WBC异常升高可使化疗过程中出现白细胞停滞综合征,导致血管堵塞、脏器缺血等严重并发症,预后较差,亦是AML患者死亡的主要原因之一[18]。
AML的基因突变类型主要包括NPM1、FLT3-ITD、CEBPA及C-KIT,有研究报道称上述基因突变与AML患者的预后有关[19]。胡瑞萍[20]研究认为,NPM1、FLT3-ITD、CEBPA突变主要见于正常核型的AML患者,而C-KIT突变主要见于核心结合因子相关的AML患者;CEBPA、NPM1突变患者的初次诱导CR率较高,且复发率较低,FT3-ITD、C-KIT突变患者初次诱导CR率较低,提示NPM1和CEBPA突变阳性可能是AML患者预后较好的标志,而FLT3-ITD、C-KIT则可能是预后不良的标志。本研究多因素分析中未发现其对预后的影响,考虑与样本量较少有关。基因检测是MRD常用的监测手段,有研究发现,绝大多数AML患者存在WT1基因异常高表达,且其异常表达程度与复发有关,诱导缓解后,WT1基因的表达明显下降,故认为WT1基因可作为MRD监测敏感指标,判断疾病预后[21]。
综上所述,减低剂量化疗方案诱导缓解治疗老年AML患者可获得与标准化疗方案相当的疗效和OS期。老年AML患者的预后与其复杂的生物学特征相关,且受年龄、PS评分、初治时WBC计数及MRD-WT1表达阳性等多种因素影响,临床上应采取合理、有效的个体化的化疗方案,以改善患者的预后。
