功能性消化不良与代谢综合征及其组分的相关性
2019-03-05韦良宏陈海东韦良鹏苏东兴劳雪莲
宁 琳 韦良宏 陈海东 韦良鹏 苏东兴 劳雪莲
功能性消化不良(functional dyspepsia,FD)为功能性胃肠病的一个重要分支,是一种或一组起源于胃十二指肠区域的症状集合,但无消化道溃疡或器质性疾病,发生率高,发病机制复杂多样,病因尚不十分明确[1]。近年来FD具有较高的发生率,临床上多采用促进胃动力、抑制胃酸药物、保护胃黏膜、抗焦虑等对症治疗,且大多数效果欠佳,该病尚未出现特效的药物根治,常导致患者生活质量下降, 对医疗卫生资源的有效利用亦造成一定压力[2,3]。FD发病机制尚未完全阐明,多数认为与胃肠道运动异常、内脏高敏感、肠道菌群失调有关[4]。代谢综合征(metabolic syndrome,MS)是机体内一系列代谢成分异常聚集的病理状态,包括腹型肥胖、胰岛素抵抗、血脂异常和高血压等[5,6]。
随着人们生活水平的提高和物质生活的极大丰富,MS发生率呈逐年升高趋势, 临床上发现,MS与一些胃肠疾病有相关性,如糜烂性食管炎、胃食管反流病、肠易激综合征等,大多数患有脂代谢紊乱相关疾病的患者, 同时会出现腹胀、腹泻、暧气等消化不良的症状[7~9]。MS对功能性胃肠病的影响开始受到关注,但目前研究仅集中在肠易激综合征方面,对FD及MS相关性研究极少,本研究旨在进一步发现FD的高危因素,通过加强对高危人群的监测干预,为FD的预防提供新的思路。
对象与方法
1.研究对象:收集2015年4月~2017年6月在钦州市第一人民医院体检人群1000例为研究对象,已经得到该医院伦理委员会的批准及患者知情同意。
2.诊断标准:严格按照罗马Ⅲ诊断标准区分出功能性消化不良患者及非功能性消化不良患者,分为观察组及对照组。采用改良的2005年国际糖尿病联盟标准诊断代谢综合征。采用2010年中华医学会肝脏病学分会NAFLD肝病诊疗指南工作定义诊断非酒精性脂肪肝。并执行以下纳入标准和排除标准。
纳入标准:选择年龄≥18且≤60岁,按照罗马Ⅲ诊断标准筛查功能性消化不良患者,需符合以下条件:①早饱、上腹痛、上腹烧灼感等反复发作;②症状出现≥6 个月;③排除胆胰腺肾病、结缔组织病等;④既往无腹部手术史;⑤排除伴有消化性溃疡、反流性食管炎、肿瘤、糜烂等上消化道器质性疾病;⑥无酗酒及药物滥用史。
排除标准:排除体检前4周使用抑酸药物及胃肠动力药物、长期应用糖皮质激素、急性感染、酒精性肝病、慢性病毒性肝炎、消化道手术史、恶性肿瘤及严重的心肺功能不全者及消化道器质性病变患者。
3.研究方法:采用统一的健康体检表填写一般情况,既往史及烟酒等嗜好。所有研究对象均测量身高、体重、血压[收缩压(systolic blood pressure, SBP)/舒张压(diastolic blood pressure,DBP)],并计算体重指数(body mass index,BMI),晚餐后禁食10h以上,次晨,采集空腹血清标本应用全自动生化分析仪测定空腹血糖(fasting plasma glucose, FBG)、甘油三酯(triglyceride, TG)、总胆固醇(total cholesterol, TC)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C) 等。超声检查受检者空腹,平卧位或左侧卧位,采用东软飞利浦二维彩超,由固定的高年资超声诊断科医师进行肝胆脾肾脏以及脂肪肝超声检查。
以BMI≥24kg/m2为超重, BMI≥28kg/m2为肥胖; 总胆固醇(TC)≥5.2mmol/L和(或)甘油三酯(TG)≥1.7mmol/L为高血脂; HDL-C≤1.04mmol/L为异常;LDL-C≥3.12mmol/L为异常,空腹血糖(FPG)≥6.1mmol/L定义为高血糖≥7.0mmol/L诊断为糖尿病。SBP≥140mmHg(1mmHg=0.133kPa)和(或)DBP≥90mmHg,及既往有高血压病史,即诊断为高血压。
统计观察组及对照组MS各组分肥胖人数、高血糖、高血压、脂肪肝、高脂血症检出率,入组人群以诊断FD为因变量,以MS各组分为自变量,进行危险度、风险度分析。

结 果
1.一般情况资料的比较:共有1000例体检者纳入研究,因失访退出调查87例,资料、随访结果完整的病例共913例,其中对照组466例,观察组 447例,其中,男性458例,患者年龄18~59 岁,平均年龄38.1±12.0岁;女性455例,患者年龄17~60岁,平均年龄39.4±11.8岁。所有对象均详细询问既往病史, 对照组与观察组性别、年龄、文化程度及既往病史比较,差异无统计学意义(P>0.05),两组资料具有可比性。
2.NAFLD检出率的比较:在对照组中,NAFLD检出率为16.3%;观察组NAFLD检出率为27.1%,观察组中NAFLD检出率高于对照组,差异有统计学意义(P<0.01),详见表1。
与对照组比较,*P<0.01;NAFLD.非酒精性脂肪肝
3.MS相关组分的比较:两组间各指标的比较见表2。观察组的BMI、TG、TC、SBP、FPG均高于对照组,两组间比较差异有统计学意义(P<0.05,表2)。
4.FD的危险因素的单因素分析:以FD发生为因变量,将与FD可能相关的性别、年龄、脂肪肝、BMI、高脂血症等10个变量赋值后,进行单因素Logistic回归分析,结果显示脂肪肝、BMI 、TC、TG 、高血压及高血糖6 个变量比较,差异有统计学意义(P<0.05,表3)。

表2 观察组及对照组MS各指标的比较
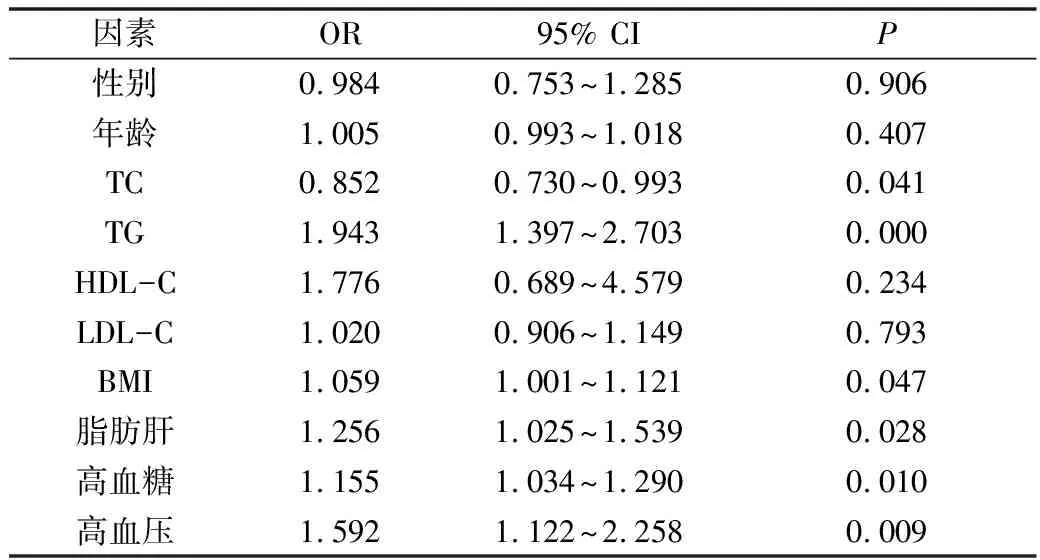
表3 FD危险因素单因素分析结果
5.FD的危险因素的多因素分析:通过向前逐步引入法,在进一步校正混杂因素的影响后,经多因素Logistic回归分析结果显示,FD与脂肪肝、TG、高血压、高血糖4个变量密切相关(P<0.05),详见表4。
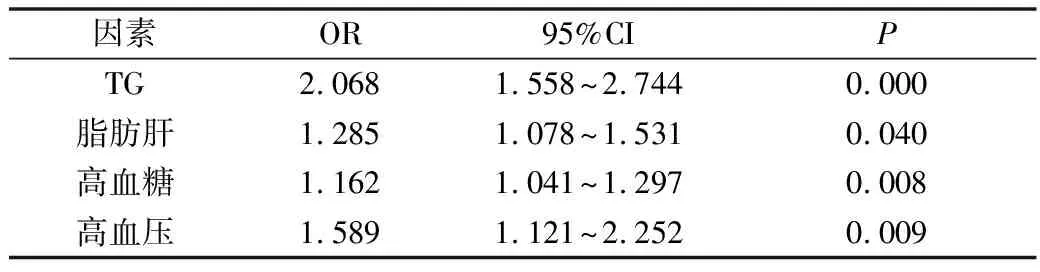
表4 FD多因素条件Logistic回归分析
讨 论
功能性胃肠病(functional gastrointestinal disorders,FGID)是临床常见病,严重影响患者的生存质量,其中FD是FGID发生率最高的一个分支。FD病因及发病机制,尤其是相关的危险因素目前尚不明确,一直是研究关注的热点[2]。随着近年来膳食结构的改变,体力活动相对减少,MS发生率呈逐年上升的趋势。临床上发现,MS及其组分与FGID有相关性,如肠易激综合征等[10]。肠易激综合征与FD的症状、发病机制有相似性[11]。因此,推测MS与FD发生可能相关。
高脂血症、脂肪肝、超重肥胖三者之间,有着密切的联系,脂代谢紊乱是其共同的危险因素[12,13]。过多的内脏脂肪堆积使腹内压升高,内脏脂肪会分泌一系列的脂肪素和细胞因子,使胃肠道运动起搏细胞减少及兴奋活动受到抑制,引起胃肠道平滑肌痉挛,导致引起早饱、餐后饱胀、上腹痛等胃肠动力紊乱相关症状[9,14,15]。Lee等[9]研究表明超重(BMI≥24 kg/m2)、内脏脂肪堆积是引起功能性胃肠病胃肠动力紊乱的危险因素。Soza等[16]发现NAFLD患者较健康志愿者的口盲传输时间明显延长,存在胃肠排空障碍。本研究结果显示,非FD人群NAFLD检出率为16.3%,FD人群检出率为27.1%, FD患者脂肪肝发生率、BMI均高于对照组(P<0.01),与上述两项研究结果基本相符。
诸多研究表明,机体存在高脂血症时往往会造成肠道菌群中的双歧杆菌、乳酸杆菌等多种益生菌数量减少,从而导致FD患者出现消化不良的症状[17]。而益生菌则是能抑制肠上皮细胞的致病细菌增殖,改善内脏高敏感和肠运动功能障碍的重要物质,因此,脂肪肝及与其密切相关的高血脂可能为FD发病因素之一[18]。Singh等[19]在东印度对632例偶然发现NAFLD的患者研究中发现,有54.5%患者原先是因功能性消化不良而就诊的,而该群体中高脂血症发生率高达40%,但由于缺乏非FD人群做比较,高脂血症是否为功能性消化不良的危险因素尚存在争议。而本研究中,FD患者总胆固醇及甘油三酯较对照组升高,差异有统计学意义(P<0.01)。多因素Logistic回归分析结果显示, 甘油三酯及NAFLD与FD的发生密切相关(P<0.05),且OR值分别为2.068及1.285, 均>1,提示为FD独立危险因素, 说明排除混杂因素的影响后, 甘油三酯、脂肪肝是FD发生的独立危险因素。
胰岛素抵抗是代谢综合征发病的重要环节,长期高血糖,可引起糖化血红蛋白沉积在外周神经微血管壁,导致胃黏膜上皮细胞损伤及胃肠道自主神经病变,使消化道间期移行性复合运动减弱或发生变异甚至消失,从而导致餐后饱胀、恶心、呕吐等症状出现[20,21]。本研究显示高糖血症是FD发生独立危险因素(P=0.008,OR=1.162),与上述研究结果相符。
高血压可引起胃肠功能紊乱,其中重要原因之一为高血压患者血清及胃肠道中平滑肌舒张剂——一氧化氮含量降低,导致胃肠容受性舒张功能障碍,不利于胃肠排空而引起腹部不适症状[22]。而研究表明,一氧化氮降低是与FD患者胃肠道高反应性特别是餐后腹痛密切相关,因此推测高血压可能是FD发生的危险因素[23]。本研究Logistic回归分析高血压是FD发生的独立危险因素(P=0.009,OR=1.589),与此推测相符,但其确切机制尚需进一步研究。
综上所述,FD的发生与MS组有相关性,相信通过不断的临床探索,在今后可以破解二者之间的启动机制,临床治疗中重视和关注FD患者是否合并代谢综合征,并积极帮助患者纠正代谢异常,从严格控制血脂、血压和血糖水平入手,可能有为FD的预防及诊治提供帮助。
