宫颈活组织病理检查及免疫组化P16蛋白检测在高危型人乳头瘤病毒阳性病人中的意义
2019-03-04王海玮柴丽丽杨国青陈燕
王海玮,柴丽丽,杨国青,陈燕
宫颈癌是严重威胁女性生命健康的恶性肿瘤之一,近年来,越来越多的流行病学资料显示,高危型人乳头瘤病毒(HPV)感染与子宫颈癌及癌前病变的发生密切相关,而我国是世界上HPV感染率较高的国家之一,因此高危型HPV的检测对于宫颈癌及癌前病变的筛查显得尤为重要。此外,在日常诊断工作中,宫颈上皮鳞状上皮化生,尤其是不成熟鳞化与宫颈上皮病变的鉴别,是困扰病理医师的一个难题。研究表明,持续性感染HPV会导致P16的过度表达。本研究通过免疫组化法检测P16蛋白在高危型HPV感染者中的表达,以探讨它们在宫颈癌筛查和诊断中的价值及意义。
1 资料与方法
1.1一般资料对西安市中心医院妇科门诊2016年1月至2016年12月期间薄层液基细胞学技术(liquid-based ThinPrep cytology test,TCT)和第二代杂交捕获法(HC2)二联检测中发现高危型HPV阳性的226例病人行常规子宫颈活检,并联合免疫组化检测P16蛋白的表达。病人病理切片及免疫组化均由两位高年资病理诊断医师共同给出最终诊断结果。本研究得到了西安市中心医院医学伦理委员会批准,病人或其近亲属签署了知情同意书。
1.2宫颈细胞学检查采用TCT进行检测,诊断标准采用TBS(the Bethesda system)分类法。分为无宫颈上皮内病变(negative for intraepithelial lesion or malignancy,NILM),未明确诊断意义的不典型鳞状上皮细胞(atypical squamous cell,ASU),低度鳞状上皮细胞病变(low squamous intraepithelial lesion,LSIL),高度鳞状上皮病变(high squamous intraepithelial lesion,HSIL)。
1.3高危型HPV检测所有标本均由妇科医师用专用细胞采集器采取,HC2法定量检测13种HPV-DNA含量(包括HPVl6、18、31、33、35、39、45、51、52、56、58、59、68型)。阴阳性对照标本均由试剂盒提供。HPV DNA高危型检测试剂盒及HC2基因杂交捕获仪均购自美国Digene公司。结果判断标准:HPV-DNA≥1.0 pg/mL为阳性;HPV-DNA<1.0 pg/mL为阴性。
1.4免疫组织化学方法采用MaxVision法检测P16蛋白。所有标本经4%甲醛溶液固定,常规石蜡包埋,4 μm切片备用,染色步骤按照试剂盒说明书操作。抗体及试剂盒均购自福州迈新生物技术有限公司。
P16表达定位于细胞核或细胞质,鳞状上皮无表达时记录为(-),仅基底层和副基底层可见散在少量细胞P16阳性时记录为(+),10%~90%的上皮细胞表达时为(++),≥90%的上皮细胞弥漫表达时记录为(+++)。
1.5统计学方法采用SPSS 19.0统计软件进行数据的处理与分析,采用非参数的Kruskal Wallis秩和检验,两两比较采用Bonferroni校正,P<0.001为差异有统计学意义。
2 结果
2.1宫颈细胞学检查结果NILM72例,ASU32例,LSIL77例,HSIL45例。
2.2宫颈活检结果病理活检为炎症/萎缩者73例,低级别上皮病变者98例,高级别上皮病变者55例。宫颈活检结果与TCT结果比较见表1。
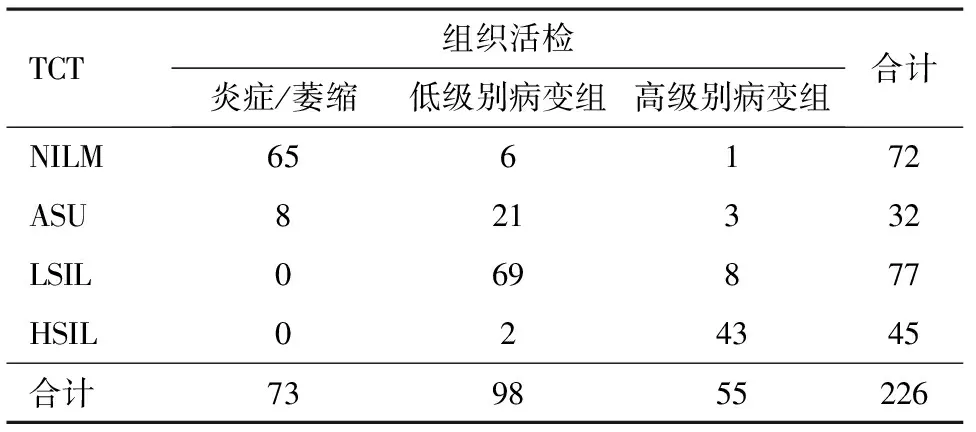
表1 宫颈活检结果与TCT结果比较/例
从表1中可以看出,TCT结果为NILM者中,病理活检阳性有7例,漏诊率约为9.7%(7/72)。
2.3P16蛋白表达情况P16蛋白在宫颈活检中的表达见表2。在炎症/萎缩病变中,P16多无表达(图1);低级别病变中,大多数病例P16为局灶阳性,且阳性细胞占据鳞状上皮的下1/3(图2);而高级别病变中,P16则为弥漫阳性(图3)。

图1 P16蛋白在萎缩中无表达(HE×100)

图2 P16蛋白在低级别病变中的表达(HE×100)
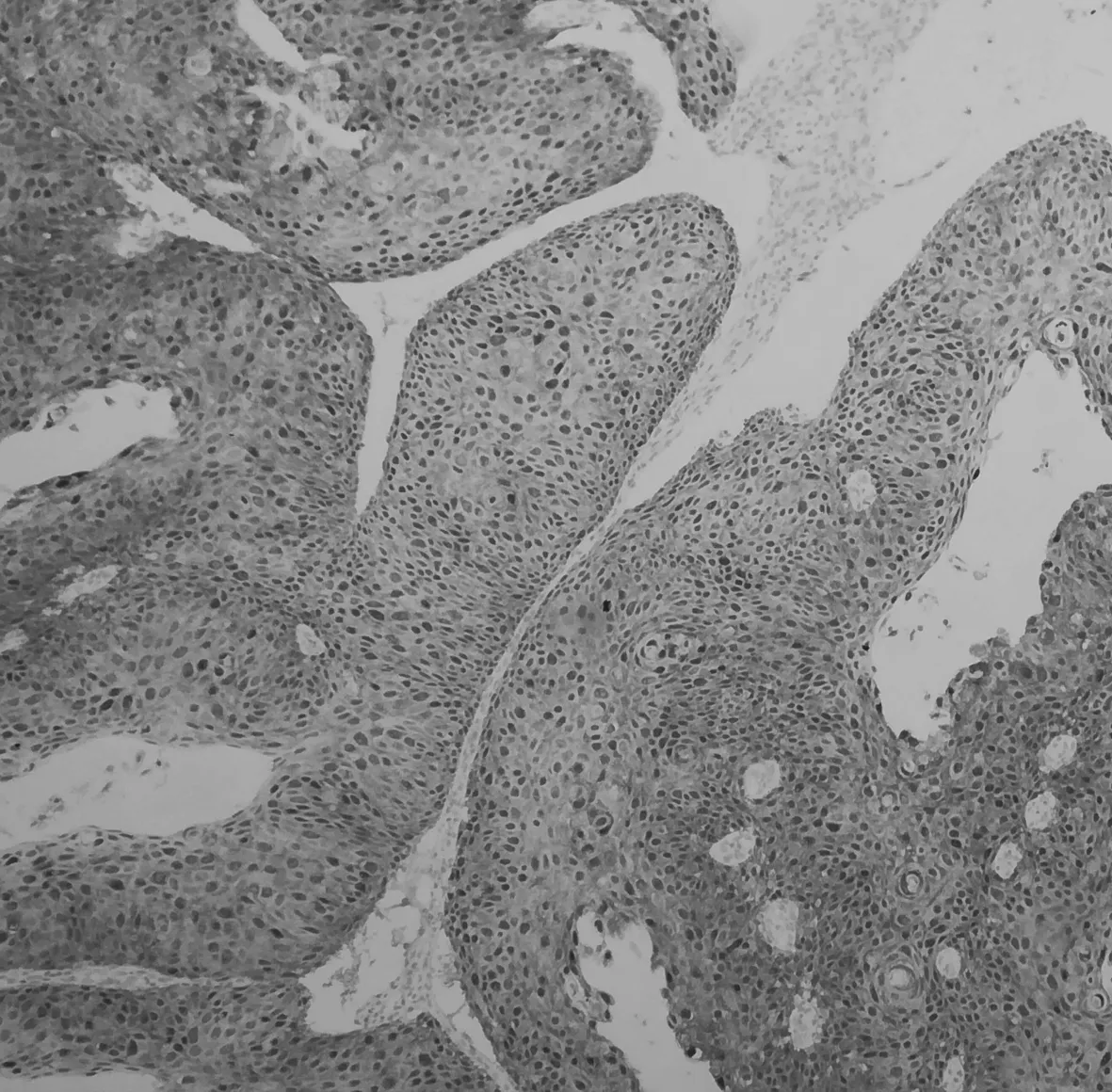
图3 P16蛋白在高级别病变中的表达(HE×100)
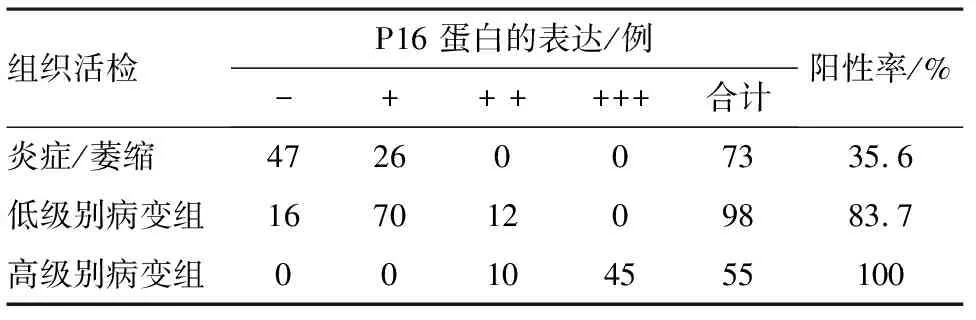
表2 P16蛋白在宫颈活检中的表达
Kruskal Wallis秩和检验结果显示,P16蛋白表达在炎症/萎缩组、低级别病变组及高级别病变组间差异有统计学意义(χ2=158.29,P<0.001);三组病变间的两两比较,采用Bonferroni校正后,P16蛋白表达均差异有统计学意义(P<0.001)。
3 讨论
宫颈癌是女性生殖系统最常见的恶性肿瘤之一,几乎所有子宫颈癌组织中均能检测到HPV DNA[1],从而验证了HPV是子宫颈癌的重要病因,尤其是高危型HPV感染是宫颈癌发生的必要条件[2]。目前已被鉴定出的HPV类型已超过100种,依其致病性不同可将其分为高危型和低危型两大类,一般认为,高危型HPV如HPV16、18、31、33、35、39、45、51、52、56、58、59、68等,与宫颈癌及宫颈上皮病变的发生密切相关;低危型HPV如HPV6、11、42、43等,则常引起生殖道湿疣等良性病变。女性生殖系统HPV感染很常见,但大部分妇女在感染后8~10个月可以自行消除,约5%~10%的持续感染者才成为子宫颈癌的高危人群。自20世纪50年代以来,发达国家已广泛开展宫颈癌涂片筛查,其流行病学数据显示,宫颈浸润癌的发病率和死亡率已明显下降[3];我国宫颈癌的普查率较低,尚未形成成熟的筛查模式[4],因此尽早发现高危型HPV感染,积极治疗宫颈癌前病变,是我国当前预防宫颈癌的重点。
宫颈细胞学检查和高危型HPV检测是临床宫颈病变筛查的常规手段,由于细胞学诊断受诊断医师主观因素影响较大,使得其重复性稍差。有研究认为在 HR-HPV 阳性、 TCT 阴性者中高级别上皮病变的检出率明显高于 HR-HPV阴性、 TCT 阳性者[5-6]。目前检测HPV的方法主要有:聚合酶链式反应(PCR)技术、杂交捕获技术(Hybrid Capture)、基因芯片导流杂交技术等。杂交捕获技术已经被美国食品药品管理局(FDA)批准,用于30岁以上女性宫颈癌的初筛。将高危型HPV检测作为常规筛查手段,可以比通常采用的宫颈液基细胞学检测更有效地浓缩高风险人群,降低漏诊率[7]。本研究结果显示,226例高危型HPV感染者中,TCT结果未发现宫颈上皮病变者为72例,而其中病理活检阳性者有7例,漏诊率约为9.7%(7/72),与上述研究结论一致。因此HPV(+)者,尤其HPV和TCT均(+)者,应及时行宫颈活检。
P16基因定位于人染色体9p21,编码P16蛋白,负性调节细胞周期从G1期进入S期。研究表明,P16基因的异常甲基化参与了多种肿瘤的发生和发展[8]。宫颈组织中P16的强阳性表达往往提示HPV在宿主细胞中的整合[9]。大部分学者的研究报告显示,P16散在点状弱阳性常常预示低危型HPV感染的低级别CIN,而P16弥漫性或带状强阳性表达则预示高危型HPV感染的高级别CIN[10-11]。因此P16可以作为一种辅助标志物,联合HR-HPV检测,有效分流薄层液基细胞中的ASUS病人[12-14]。本研究结果显示,P16的阳性率在炎症/萎缩组、低级别病变组及高级别病变组间的表达差异有统计学意义,其表达程度随病变级别的进展而升高,说明P16与宫颈病变的级别密切相关,与陆晓青等[15]的研究结果一致。此外,在高级别及低级别病变组,P16的表达明显高于宫颈炎症/萎缩组,且表达类型以弥漫阳性或带状阳性为主,不同于炎症/萎缩组的点灶表达或无表达,故P16表达也有助于宫颈上皮病变与炎症/萎缩的鉴别。
随着宫颈癌筛查的普及,HC2法检测高危型HPV可作为临床宫颈病变筛查的常规手段,HR-HPV阳性者应及时行阴道镜下活组织检查,必要时联合应用免疫组化行P16蛋白检测,以提高诊断的准确率,早期发现癌前病变、早期干预。
