外周血Th17细胞对大剂量地塞米松治疗免疫性血小板减少症长期疗效的预测价值
2019-03-04李颢姜海华王新伟
李颢,姜海华,王新伟
免疫性血小板减少症(immune thrombocytopenia,ITP)是临床最为常见的出血性疾病,其主要发病机制是由于病人对自身抗原的免疫失耐受,导致免疫介导的血小板破坏增多和巨核细胞产血小板障碍[1]。阻止血小板过度破坏和促进血小板生成是治疗ITP的两个重要方面。糖皮质激素是治疗ITP的主要药物,由于长期服用泼尼松的不良反应发生率高,目前关于ITP的专家共识把短疗程、大剂量地塞米松(dexamethasone,DXM)放在常规剂量泼尼松之前进行推荐[2]。尽管短疗程、大剂量的DXM方案能取得更高的治疗反应率及更短的达反应时间,但停止治疗6个月后仍有约50%的治疗反应者再次复发[3-4]。因此,筛选大剂量DXM远期疗效的预测指标有助于对潜在的复发病人进行早期干预。Th17细胞是分泌IL-17等细胞因子的CD4+T细胞亚群,多项研究表明ITP病人外周血Th17细胞比例增高,并与ITP的发病密切相关[5-7]。本研究通过检测大剂量DXM治疗前ITP病人外周血Th17细胞比例,探讨Th17细胞在预测短疗程、大剂量DXM长期疗效中的价值。
1 资料与方法
1.1临床资料2015年2月至2016年8月汝南县人民医院收治的原发初诊ITP病人42例,诊断依据文献[1],并排除其他继发性疾病。男20例,女22例;中位年龄36岁(18~58)岁;中位血小板计数(PLT)12×109/L [(1~35)×109/L]。本研究得到汝南县人民医院医学伦理委员会批准,病人或其近亲属对研究方案签署知情同意书。
1.2治疗方案连续口服DXM 4 d,每天40 mg,不进行维持治疗;如停止治疗1周后PLT仍低于30×109/L,或仍有出血症状,再予DXM (40 mg/d),口服4 d。
1.3疗效判断标准完全反应(Complete response,CR)定义为治疗后PLT ≥ 100×109/L且无出血症状;有效(Response,R)定义为治疗后PLT ≥ 30×109/L且至少为基础PLT的2倍,同时无出血症状;无效(No response,NR)定义为治疗后PLT<30×109/L或PLT不到基础值的2倍或仍有出血症状;持续反应(Sustained response,SR)定义为取得治疗反应后6个月内PLT≥ 30×109/L且无出血症状。
1.4试剂与仪器胎牛血清、RPMI-1640培养基购自美国Hyclone公司;佛波酯、离子霉素购自美国Sigma公司,布雷菲德菌素A购自美国Alexis公司;PE-Cy7标记的抗人CD3抗体、FITC标记的抗人CD8抗体、PE标记的抗人IL-17A抗体、Cytofix/Cytoperm试剂盒均购自美国BD公司;FACSCanto Ⅱ 型流式细胞仪为美国BD公司产品。
1.5Th17细胞比例测定采集治疗前的ITP病人空腹静脉血5 mL,肝素抗凝,于无菌条件下采用密度梯度离心法提取单个核细胞,用含10%胎牛血清的RPMI-1640培养基调整单个核细胞密度为4×106/mL。取单个核细胞悬液1 mL加入24孔培养板,再依次加入佛波酯、离子霉素和布雷菲德菌素A,使其终浓度分别为50 ng/mL、1 μg/mL、3 μg/mL,将培养板置于37 ℃、5%二氧化碳培养箱中孵育4 h。收集细胞,加入PE-Cy7标记的CD3抗体和FITC标记的CD8抗体各10 μL,避光孵育15 min;然后按照Cytofix/Cytoperm试剂盒说明书固定、破膜,加入PE标记的IL-17A抗体孵育30 min,最后用PBS洗涤细胞2遍后上机检测,计算CD3+CD8-IL-17A+细胞(Th17细胞)占CD3+CD8-T细胞的比例。
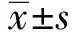
2 结果
2.1ITP病人的临床疗效42例初诊ITP病人接受大剂量DXM治疗后,CR 20例(47.6%),R 13例(31%),NR 9例(22.4%)。33例取得治疗反应的病人(CR+R)中,SR 15例(45.45%),6个月内复发18例(54.55%)。
2.2ITP病人外周血Th17细胞比例与大剂量DXM长期疗效的关系比较治疗前外周血Th17细胞比例在SR组病人与复发组病人之间的差异,如图1、图2所示,复发组 (Relapse) Th17细胞比例显著高于SR组[(1.50±0.46)% 比 (0.93±0.24)%,P<0.01]。
图1 ITP病人外周血Th17细胞比例与大剂量DXM长期疗效的关系

注:Th17细胞群(灰色)为CD3+CD8-IL-17A+,A为1例SR病人流式图,B为另外1例SR病人流式图
图2代表性Th17细胞流式分析图
2.3ITP病人外周血Th17细胞比例对大剂量DXM长期疗效的预测价值由于ITP病人初诊时外周血Th17细胞比例与大剂量DXM的长期疗效有关,进一步采用ROC评价Th17细胞比例是否有助于判断大剂量DXM的长期疗效。如图3所示,初诊时Th17细胞比例预测大剂量DXM长期疗效的曲线下面积(AUC)为0.857(95%CI0.717~0.998,P<0.01),cut-off值为1.235%,此时敏感性为77.8%,特异性为93.3%。
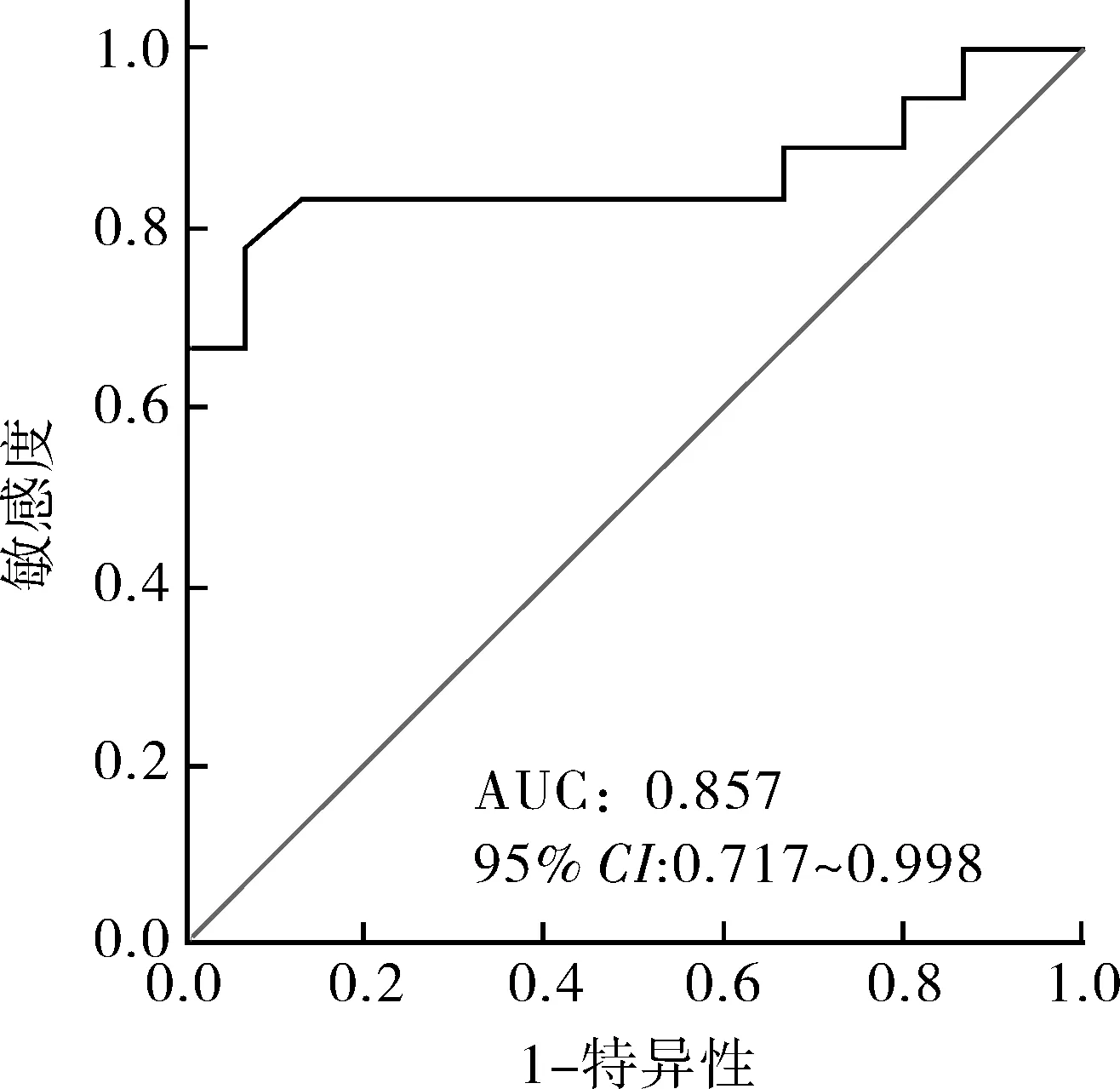
图3 外周血Th17细胞比例对大剂量DXM长期疗效的预测价值
3 讨论
传统观点认为,自身抗体介导的血小板破坏增多是ITP的主要致病机制。近年来,越来越多的研究表明失调的细胞免疫也参与ITP的发生发展,如ITP病人外周血存在Th1/Th2及Th17/Treg细胞比例失衡[8]。Th17细胞分泌特征性的促炎细胞因子IL-17,而在包括ITP在内的多种自身免疫性疾病病人外周血中Th17细胞及IL-17水平升高[7,9-10]。Yoh等[11]通过转基因技术成功构建Th17细胞上调的小鼠模型,观察到Th17细胞比例上调可促进抗血小板自身抗体产生。
糖皮质激素是初治ITP病人的一线治疗方案,研究表明短疗程、大剂量的DXM方案较长疗程、常规剂量的泼尼松方案有更高的治疗反应率,且感染、高血糖、高血压等不良反应发生率低于强的松方案[4]。在本研究中,初治ITP病人对大剂量DXM的总体反应率(CR+R)为78.6% (33/42),6个月后仍有45.5%(15/33)的病人维持治疗反应,与既往研究结果基本一致[3-4]。大剂量DXM可校正ITP病人外周血中失调的Th17/Treg细胞比例[12],提示下调Th17细胞是DXM治疗ITP的途径之一。笔者观察到,对大剂量DXM持续反应的ITP病人初诊时外周血Th17细胞比例低于取得治疗反应但6个月内复发的ITP病人,表明治疗前外周血Th17细胞比例与DXM的长期疗效有关。采用ROC进一步评价Th17细胞比例对大剂量DXM长期疗效的预测价值,结果显示曲线下面积为0.87(P<0.01),表明初诊时外周血Th17细胞比例有助于预测大剂量DXM的长期疗效。
当然,本研究也存在一些局限性,一是纳入的样本量偏少,统计效率相对较低;二是多数ITP病人的随访时间截止到取得治疗反应后的6个月,无法评价Th17细胞比例对大剂量DXM方案更长疗效的预测价值。因此,尚需大样本的病例研究和更长的随访时间予以证实。
