碱性成纤维细胞因子对SD大鼠表皮干细胞分化为神经干细胞的影响
2019-03-04许正伟贺宝荣刘团江郭华郝定均
许正伟,贺宝荣,刘团江,郭华,郝定均
中枢神经系统损伤会导致神经元的坏死或变性,这些受损的神经元由于无法再生和修复,会给病人留下偏瘫或者截瘫的严重生理后遗症,为病人家庭和社会带来了沉重的负担。神经干细胞因其独特的优势,在神经系统损伤性疾病的基因或细胞治疗中具有广阔的临床应用前景。作为来源于皮肤的表皮干细胞,由于其材料来源丰富且获取方便,合适培养体系下在体外还能够实现快速增殖、长期存活且与机体具有良好的相容性,亦不存在违反伦理道德的问题,成为治疗神经系统疾病的优良材料[1]。
碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)是一种广谱的微量活性蛋白[2],具有广泛的生物学作用,在皮肤创伤治疗、神经组织的发育和血管的形成受损以及组织的修复与再生过程中具有十分重要的作用[3]。bFGF作为一种能够促进有丝分裂活性的蛋白,可诱导神经分化[3],对神经元具有促进增殖的活性[4]。此外,bFGF对于表皮创伤的愈合以及上皮的形成也具有重要调节作用[5]。研究表明,bFGF可以促进表皮细胞的多向分化,在创伤面的修复过程中促进“层次性”分化[6]。那么,bFGF是否也影响了表皮干细胞向神经细胞分化的行为过程?为此,本研究自2015年11月至2016年11月分离、培养获得SD大鼠背部表皮干细胞,在不同密度的表皮干细胞实验组中加入bFGF作为诱导剂,通过观察细胞分化的形态、数目变化以及免疫组化鉴定,探究bFGF对表皮干细胞向神经细胞分化的影响作用。
1 资料与方法
1.1实验动物与材料出生后生长1~3 d的清洁级SD大鼠10只,雌雄不限[源自西安交通大学实验动物中心,许可证号:SYXK(陕)2015-002]。本研究中对于大鼠的处理符合动物伦理学标准。
K-FSM培养基、大鼠来源Ⅳ型胶原、胰酶(0.25%)、中性蛋白酶(0.15%)大豆蛋白和碱性成纤维细胞生长因子(bFGF)购自GIBCO公司; Nestin抗体(兔抗大鼠,多抗)和NSE抗体(兔抗大鼠,多抗)购自Abcam公司;HE染色试剂盒和PBS缓冲液购自北京索莱宝科技有限公司;D-hank′s缓冲液(Hyclone)购自成都君海生物科技有限公司。
1.2表皮干细胞的分离、培养与鉴定实验前,将所需要的器械进行消毒处理,整个操作在无菌环境中进行。取出生3 d的SD大鼠,颈椎脱臼处死后取背部含毛囊皮肤,先后用含双抗的D-Hank′s液和不含有双抗的D-Hank′s液洗涤3遍,清洗后的组织再置于含有中性蛋白酶(0.15%)的消化液中于8 ℃的环境下过夜处理。第2天分离得到含毛囊皮肤的表皮,切碎后用0.25%的胰酶消化处理。10 min后加入等体积的大豆蛋白液(0.25%)终止消化。300目过滤、离心、弃上清,再悬浮于K-SFM培养基中洗涤一次重新悬浮。细胞计数,密度调成0.5×107/mL,再向六孔板(Ⅳ型胶原8 ℃过夜处理)没空中个加入2 mL细胞悬浮液,37 ℃培养10 min。吸出培养液,用D-Hank′s液轻柔洗涤3次,再每孔加入2 mL K-SFM培养基,置于培养箱(37 ℃,5% CO2)中培养。
在倒置显微镜下,200倍视野下每日观察细胞形态和数目变化。行常规HE染色,鉴定表皮细胞。
1.3bFGF对不同密度表皮干细胞的诱导以表皮干细胞的密度不同共分为4组,密度分别为0.1×107/mL、0.3×107/mL、0.5×107/mL、0.1×106/mL。每个浓度设置3个重复(3个六孔板),每孔中分别加入2 mL对应密度的细胞悬液。然后将培养板置于37 ℃的环境中温育10 min,立即移除培养液,再用D-Hank′s液轻柔洗涤3遍。每孔中再加入2 mL含有bFGF(20 ng/mL)[6]的K-SFM培养基,于培养箱(37 ℃,5% CO2)中培养。
1.4诱导后细胞形态数目的变化统计4组不同浓度的表皮干细胞,各组每天随机取6个孔在倒置显微镜下观察细胞形态的变化,利用分割法计算视野内形态发生变化的细胞数量,并计算平均值。
1.5细胞免疫组织化学法鉴定待细胞培养到一周,且细胞融合达到80%后,取出盖玻片,各组细胞行常规细胞免疫组织化学法鉴定,其中Nestin抗体最佳浓度为1∶250,NSE抗体最佳使用浓度为1∶500,每组实验设置3个重复。
2 结果
2.1表皮干细胞的分离、培养与鉴定K-SFM培养基环境下,24 h内大多数细胞出现向四周伸展生长的现象,细胞多呈圆形或者多角形,但未发生形变,且均匀分布,贴壁细胞少(图1A)。在第3~4天,大部分细胞开始呈现克隆样生长、变大,约在第5天细胞出现80%融合,细胞形态变大且清晰,呈现长圆形,胞核较大,核质比例大,视野内细胞成“铺路石样”形态(图1B)。HE染色,细胞呈椭圆形或多角形,细胞着色均匀,细胞质染成红色,细胞核为蓝色;细胞密度较大,整体呈现“铺路石样”形态(图1C)。

注:A为表皮干细胞生长24 h时的形态(×400);B为表皮干细胞生长5 d时的形态(×200);C为HE染色鉴定(×400)
图1K-SFM培养基培养的表皮干细胞形态观察
2.2诱导后细胞形态变化bFGF诱导后,0.3×107/mL组(图2A)和0.1×107/mL组(图2B)的表皮干细胞形态发生很大变化。在第3天即可以看到细胞开始发生伸展性生长,呈多角形或短棒状形态,且分布较均匀。在第7天左右,可以观察到细胞生长均匀,大小一致,体积小,且呈克隆生长,细胞形态大部分呈多角形或者椭圆形,形态发生双极或多级改变的细胞数目随着培养时间逐渐增多,呈神经细胞形态,且细胞分布均匀。0.5×107/mL组在第3天时,形态发生双极或多极变化的表皮干细胞数量出现高峰,然后逐渐减少直到消失;0.1×106/mL组的表皮干细胞一直未出现形态改变的现象,也未发现细胞进行了伸展生长。

注:A为0.1×107/mL组;B为0.3×107/mL组
图2bFGF诱导后细胞形态变化(×200)
2.3诱导后细胞形态数目的变化加入bFGF诱导后,每天观察表皮干细胞发生形态变化的细胞数量,持续观察1周。结果显示,在bFGF诱导作用下,0.1×107/mL组和0.3×107/mL组的表皮干细胞发生双极或多极形态改变的细胞数量增多,且随着培养时间的延长而增多;0.5×107/mL组表皮干细胞在第3天时,发生双极或多极形态变化的细胞数量达到最大值,然后逐渐减少直至消失。0.1×106/mL组表皮干细胞未发现有形态改变的现象(图3)。
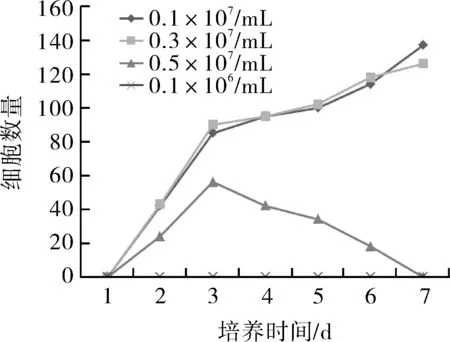
图3 bFGF诱导后不同密度表皮干细胞形态变化趋势
2.4细胞免疫组织化学法鉴定bFGF诱导后,表皮干细胞发生向神经细胞分化现象,细胞体积变大,部分细胞的形态呈现出梭形,另有部分细胞形态出现双极或多极化形态变化,而巢蛋白(Nestin)染色细胞质呈显棕黄色,神经元特异性烯醇化酶(NSE)染色细胞质呈显棕黄色,两种标志物的免疫组化染色结果均呈阳性(图4)。

图4 细胞免疫组织化学鉴定Nestin和NSE显阳性(×200)
3 讨论
皮肤干细胞是一类具有高度增殖、多向分化潜能,且自我更新能力和修复能力强的一种成体干细胞,也是目前研究比较多的一类成体干细胞[7]。目前,对于皮肤干细胞的定位、种类和数量的研究并不明确,在已发现的6种皮肤干细胞中,有表皮干细胞(Epidermal Stem Cells,ESCs)和毛囊干细胞(Follilar Stem Cells,FSCs)的研究报道相对较多[8-9]。普遍认为表皮干细胞主要存在于表皮基底层和毛囊隆突区这两个生理区域,本研究中,我们取SD大鼠背部含毛囊皮肤,利用快速贴壁法[10],成功消化、分离得到表皮细胞,这些细胞胞核较大,核质比例大,且在培养中有大量克隆形成。表皮干细胞在维持上皮的再生与平衡方面起着重要作用,在损伤皮肤的修复与治疗、肿瘤和炎症反应中都具有巨大的临床应用价值[11-12]。而表皮干细胞能够诱导分化形成神经细胞的研究,也可能为治疗中枢神经系统损伤疾病带来福音。代学良等[13]通过慢病毒介导Ngn2基因转染SD大鼠皮肤源性前体细胞,成功制备出再程序化的皮肤来源神经干细胞。Hu等[14]将表皮干细胞移植入挫伤脊髓神经,结果显示植入的表皮干细胞有助于促进感觉神经的连接和触觉神经的修复。对于表皮干细胞向神经系分化所涉及到的信号通路和关键因子,已成为当前的研究热门。
bFGF是构成成纤维细胞生长因子(fibroblast growth factor,FGF)家族的主要成单元之一[15-16],广泛分布于人体组织中,是一种广谱的微量活性蛋白[2]。bFGF具有广泛的生物学作用,其靶细胞有神经元、成纤维细胞、内皮细胞和表皮细胞等,在皮肤创伤治疗、神经组织的发育和血管的形成受损以及组织的修复与再生过程中具有十分重要的作用[3,17]。bFGF诱导所涉及的信号途径是绝大多数正常细胞发育所必须的,目前的研究表明,bFGF与受体结合后主要是通过四种信号通路发挥作用,蛋白激酶C途径(PKC),Ras/Raf/MEK/ERK途径,蛋白酪氨酸激酶/信号转导子及转录激活子途径(JAK/STAT)和磷脂酰肌醇-3-激酶途径(PI3K)[18-19]。bFGF作为一种能够促进有丝分裂活性的蛋白,可诱导神经分化[3],对神经元具有促进增殖的活性[4]。Yang等[20]的研究发现bFGF能够显著促进人类的胚胎干细胞分化形成多巴胺能神经元。Duobles等[21]发现大鼠坐骨神经损坏后,钙离子结合蛋白(S100beta)能够通过促进受损伤神经周边的细胞大量分泌bFGF,从而达到自我修复受损神经的目的。此外,bFGF对于表皮创伤的愈合以及上皮的形成也具有重要调节作用[5]。研究表明,bFGF可以促进表皮细胞的多向分化,在创伤面的修复过程中能够促进“层次性”分化[6]。同时,有研究认为,bFGF的作用存在浓度决定作用效果的情况,较低浓度的bFGF有利于骨髓间充质干细胞向神经前体细胞的分化。本研究中,bFGF的浓度为20 ng/mL时,有助于表皮干细胞向神经细胞的分化[22],在第3天即可以看到细胞开始发生伸展性生长,细胞呈双极或多极形态改变。
本研究中,我们选取新生SD大鼠作为实验材料,取其背部含毛囊皮肤,利用快速贴壁法成功消化、分离得到表皮细胞。在浓度为20 ng/mL的bFGF诱导下,0.3×107/mL组和0.1×107/mL组的表皮干细胞形态发生很大变化,在第3天即可以看到细胞开始发生伸展性生长,在第7天左右,可以观察到细胞生长均匀,细胞形态基本一致,体积小且呈克隆生长,而且细胞形态大多呈多角形或者椭圆形,形态发生双极或多级改变的细胞数目随着培养时间逐渐增多,呈神经细胞形态,且细胞分布均匀。这初步说明,在bFGF的诱导下,表皮干细胞开始向神经细胞发生分化。通过调节表皮干细胞的密度进行诱导实验发现,0.1×107/mL组和0.3×107/mL组的表皮干细胞发生双极或多极形态变化的细胞数量随着培养时间的延长而增多。NSE[23]和Nestin[24]作为神经元样细胞的生物标志物已经被广泛的研究和应用。本研究中,0.1×107/mL组和0.3×107/mL组实验细胞免疫组织化学鉴定结果显示NSE和Nestin显阳性,初步分析为神经元样细胞。细胞密度改变所引起的分化异同,可能是由于细胞接触距离的不同导致0.1×107/mL组和0.3×107/mL组细胞启动了与表皮干细胞的分化相关的Notch信号转导通路,进而导致激发了表皮干细胞的定向分化潜能,发生向神经细胞分化的现象。
作为来源于哺乳动物皮肤的表皮干细胞,由于其材料来源丰富且获取方便,合适培养体系下在体外还能够实现快速增殖、长期存活且与机体具有良好的相容性,亦不存在违反伦理道德的问题,因此为神经系统疾病的细胞和基因治疗带来了新的希望。本研究结果显示,在SD大鼠中bFGF能够促进表皮干细胞分化为神经细胞,这为后续解析SD大鼠表皮干细胞向神经细胞分化的机制提供了一定的理论参考。
