Triton X-100与SDS对SD大鼠皮下移植猪主动脉瓣巨噬细胞表型极化的作用比较
2019-03-01
去细胞处理的猪主动脉瓣是构建组织工程瓣膜的重要材料。去细胞处理能有效降低猪主动脉瓣的免疫性,增强瓣膜的体内生物相容性,提高瓣膜的耐久性[1-2]。聚乙二醇辛基苯基醚(Triton X-100)与十二烷基硫酸钠(SDS)是猪主动脉瓣去细胞处理最常用的试剂。SDS作为一种离子型去污剂,在低浓度下即可完全去除猪主动脉瓣中的细胞[3-4],而Triton X-100属于非离子型去污剂,可以有效去除细胞的质膜和内膜系统,使抗体及大分子物质能够进入胞浆。
近年来,巨噬细胞极化在组织移植领域受到关注。研究证实,极化的巨噬细胞能够影响局部免疫反应,调控组织修复过程[5]。但在对去细胞猪主动脉瓣支架材料的研究中,有关化学处理方法对巨噬细胞极化影响的研究较少。本研究分别采用SDS 和Triton X-100对猪主动脉瓣进行去细胞处理,并通过体内实验分析两种去细胞方法对巨噬细胞极化的影响,以期为心脏瓣膜组织工程研究提供依据。
1 材料与方法
1.1 试剂与材料
Triton X-100购自美国Sigma公司;SDS、三羟甲基氨基甲烷(Tris)购自国药化学试剂有限公司;CD163抗体购自美国Adcam公司;CCR7抗体购自巴傲得生物科技有限公司;S-P超敏试剂盒购自福州迈新生物技术开发有限公司;二甲氨基偶氮苯(DAB)显色试剂盒购自北京中杉金桥生物技术有限公司。Triton X-100缓冲液的配制方法:配制10 mmol/mL的Tris缓冲液,加入1% Triton X-100试剂,调节pH值为7.6。SDS缓冲液的配制方法:配制10 mmol/mL的Tris缓冲液,加入1% SDS试剂,调节pH值为7.6。Triton X-100和SDS缓冲液中均加入青链霉素双抗。
1.2 猪主动脉瓣的获取
于上海五丰上食食品有限公司购买新鲜宰杀猪的心脏,清洁条件下在30 min内取出心脏瓣膜。将瓣膜置入4 ℃无菌PBS中,运送回实验室,在无菌操作台中用PBS反复清洗干净。
1.3 去细胞瓣膜的制备
将新鲜完整的猪主动脉瓣(n=36)随机分为3组。未处理组(n=12):置于无菌的Tris缓冲液中,40 ℃摇床振荡48 h,每8 h换液1次。Triton X-100处理组(n=12):置于Triton X-100缓冲液中,40 ℃摇床振荡48 h,每8 h换液1次,然后在含有双抗的蒸馏水中4 ℃浸泡12 h。SDS处理组(n=12):置于SDS缓冲液中,40 ℃摇床振荡48 h,每8 h换液1次。3组完成上述操作后,换含有双抗的PBS,4 ℃浸泡72 h,每8 h换液1次。
1.4 建立SD大鼠皮下移植猪主动脉瓣模型
18只4周龄雌性SD大鼠购于第二军医大学实验动物中心,将其随机平均分配给未处理组、Triton X-100处理组和SDS处理组以备皮下植入瓣膜。大鼠经异氟烷吸入麻醉后仰卧位固定于操作台,于大鼠胸部左右两侧各做长约2 cm的切口,每侧埋入1片经上述方法处理后的瓣膜,随后缝合切口并于动物中心正常饲养。分别于瓣膜组织植入皮下后第3、14、28 天时将各组中2只SD大鼠皮下移植的瓣膜组织取出,以便进一步分析。
1.5 免疫组织化学染色
将瓣膜标本置于10%福尔马林溶液中固定,常规石蜡包埋、切片,二甲苯脱蜡入水,梯度酒精脱水,柠檬酸钠缓冲液抗原修复。过氧化物酶阻断剂室温孵育10 min,PBS冲洗后非免疫性动物血清室温孵育10 min。加入CCR7一抗(1∶200)、CD163一抗( 1∶500),4 ℃孵育过夜,加入生物素标记的二抗,室温孵育10 min。加入链霉菌-过氧化物酶溶液室温孵育后,DAB显色,苏木素复染细胞核,1%盐酸乙醇分化,碳酸锂返蓝,无水乙醇脱水,中性树胶封片观察。免疫组织化学染色结果判定方法:CD163、CCR7主要定位于细胞膜和(或)细胞浆,以胞膜和(或)胞浆出现棕黄色颗粒为阳性。随机选定10个高倍镜视野,计数阳性细胞数,取平均值。
1.6 统计学分析
统计学分析采用 GraphPad软件,数据以均数±标准差表示,两组间比较采用独立样本的t检验或Wilcoxon检验,P<0.05为差异有统计学意义。
2 结果
2.1 瓣膜移植物中CCR7免疫组织化学染色结果
CCR7免疫组织化学染色结果见图1、表1。经处理的猪主动脉瓣膜于皮下移植3 d、14 d和28 d后,未处理组、Triton X-100处理组与SDS处理组瓣膜中均可见CCR7表达,其中SDS处理组CCR7+细胞数显著少于Triton X-100处理组与未处理组(P均<0.05)。但Triton X-100处理组与未处理组的差异无统计学意义。
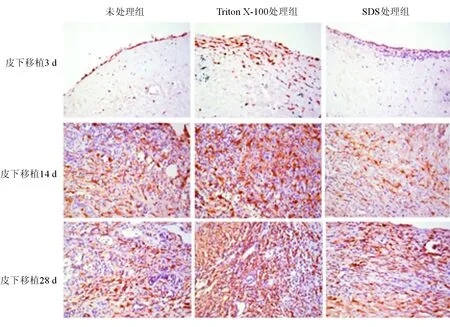
图1 免疫组织化学染色法检测瓣膜移植物中CCR7表达情况(×400)

表1 高倍镜视野下各组瓣膜CCR7+细胞数比较/个
2.2 瓣膜移植物中CD163免疫组织化学染色结果
CD163免疫组织化学染色结果见图2、表2。经处理的猪主动脉瓣膜于皮下移植3 d、14 d后,未处理组、Triton X-100处理组和SDS处理组瓣膜中均可观察到CD163表达,其中SDS处理组CD163+细胞数显著少于未处理组及Triton X-100处理组(P均<0.05)。Triton X-100处理组与未处理的差异无统计学意义。皮下移植28 d后,上述3组瓣膜CD163+细胞数无明显统计学差异。
2.3 瓣膜移植物中巨噬细胞表型极化分析
CCR7为经典活化的M1型巨噬细胞的标志物,CD163为选择性活化的M2型巨噬细胞的标志物。在本研究中,我们通过计算M2型巨噬细胞与M1型巨噬细胞的比值来分析巨噬细胞表型极化的情况,M2型/M1型巨噬细胞=CD163+细胞数/CCR7+细胞数。
未处理组、Triton X-100处理组与SDS处理组SD大鼠皮下移植3 d、14 d和28 d时猪主动脉瓣中M2型/M1型巨噬细胞比值见表3。第3、14、28 天时,空白对照组M2型/M1型巨噬细胞比值<1;SDS处理组与Triton X-100处理组在第14、28天时,M2型/M1型巨噬细胞比值>1。在第14天时,SDS处理组猪主动脉瓣M2型/M1型巨噬细胞比值明显高于其他两组(P均<0.05)。
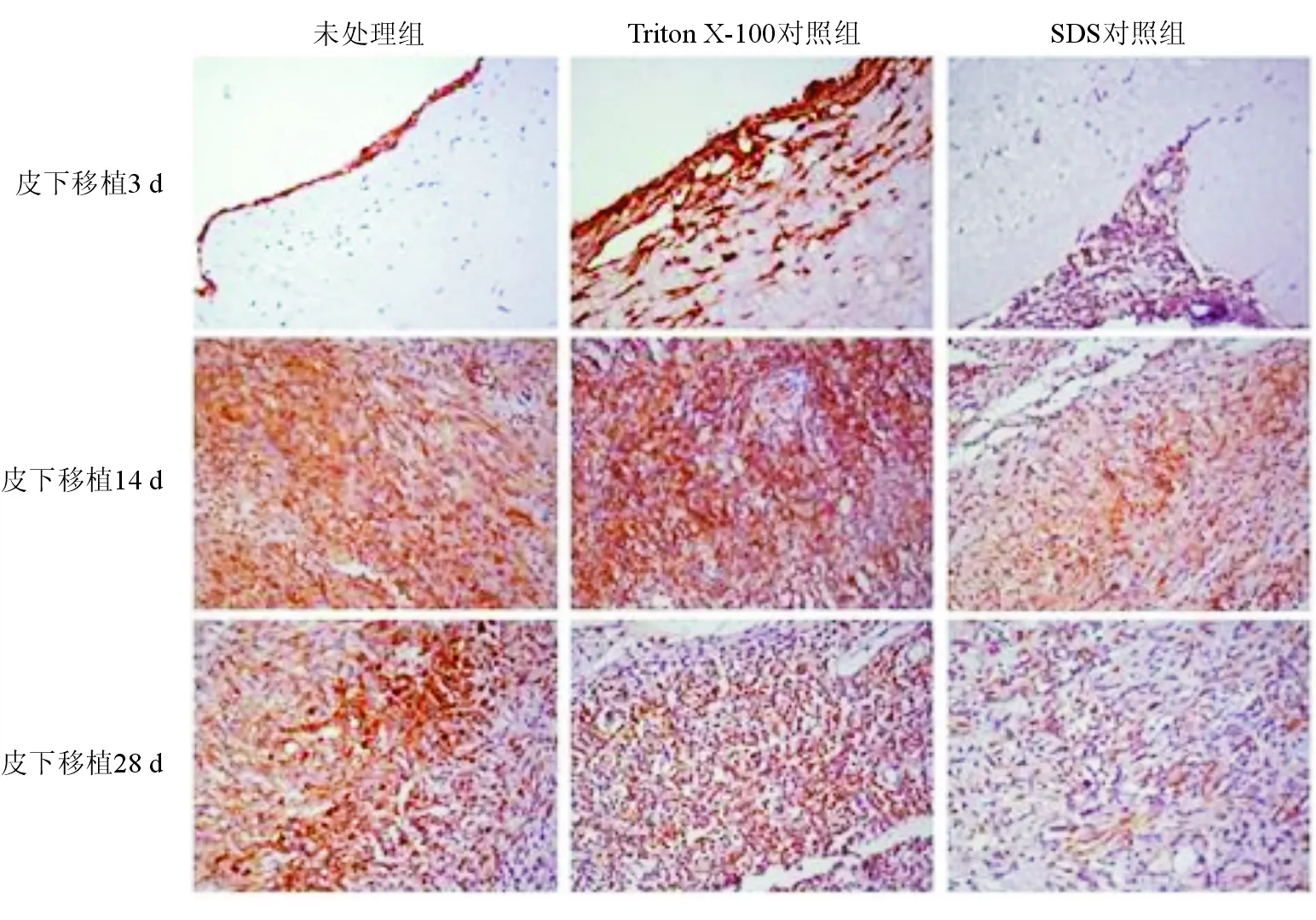
图2 免疫组织化学染色法检测瓣膜移植物中CD163表达情况 (×400 )
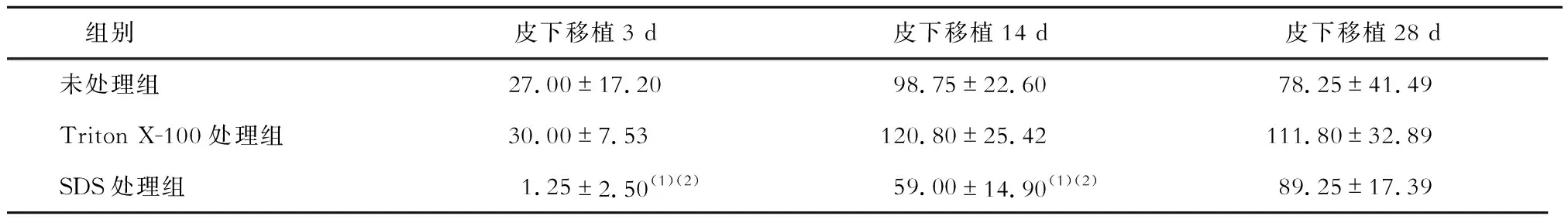
表2 高倍镜视野下各组瓣膜CD163+细胞数比较/个

表3 各组瓣膜M2型/M1型巨噬细胞比较
3 讨论
手术植入人工心脏瓣膜是目前治疗心脏瓣膜病的唯一有效方法[6-7]。患者植入机械瓣后需终身抗凝,同源性生物瓣由于伦理学限制,来源较少。猪心脏瓣膜的解剖结构与人类极为相似且来源丰富,因而更具吸引力。去细胞猪主动脉瓣因其适当的空隙率、良好的细胞黏附性和机械性能、天然的构型等优点成为心脏瓣膜组织工程较为理想的材料[8-9]。目前已成功建立了多种去细胞方法,但不同方法处理的瓣膜在体内组织修复过程中的作用还需进一步探索。
移植材料被植入宿主体内后常常伴随着炎性反应和组织修复,巨噬细胞是调控两者平衡的主要细胞。在不同条件下,巨噬细胞会出现形态和功能变化,发生极化。根据免疫表型和细胞功能不同,巨噬细胞可分为经典活化的M1型巨噬细胞和选择性活化的M2型巨噬细胞。在本研究中,我们建立了SD大鼠皮下移植模型,以CCR7+细胞为M1型巨噬细胞,CD163+细胞为M2型巨噬细胞。瓣膜在小鼠皮下包埋28 d后,未处理瓣膜中M2型/M1型巨噬细胞比值<1,提示巨噬细胞向M1型巨噬细胞极化,M1型巨噬细胞主要功能为分泌促炎性因子,在炎性反应时期发挥重要作用,因此未去细胞猪瓣膜在宿主体内可能促进巨噬细胞介导的炎性反应。SDS、Triton X-100处理的瓣膜在小鼠皮下包埋14 d后,M2型/M1型巨噬细胞比值>1,提示巨噬细胞向M2型巨噬细胞极化,M2型巨噬细胞激活后可发挥促进组织修复的作用,因此去细胞能促进异种瓣膜在宿主体内的组织修复过程。猪主动脉瓣在SD大鼠皮下移植第14天时,SDS促进瓣膜组织修复的作用较Triton X-100更为明显,提示SDS去细胞处理方法是促进猪心脏瓣膜组织体内修复更为有效的方法。
本研究探索不同去细胞方法制备的猪心脏瓣膜对巨噬细胞向M1型或M2型巨噬细胞表型极化的调控作用,证实去细胞能促进巨噬细胞向M2型巨噬细胞极化,SDS去细胞方法在促进巨噬细胞极化时优于Triton X-100去细胞方法。由于人造瓣膜仍有较多缺陷,利用组织工程技术制造瓣膜成为研究的热点[10]。组织工程瓣膜能很好地解决抗凝、抗感染、耐久性差等问题,有良好的应用前景[11-12]。该研究可为组织工程瓣膜支架的构建提供新的研究依据。
