C1ORF54在小鼠心肌梗死后心脏修复中的作用
2019-03-01
缺血性心脏病是威胁人类健康的主要疾病之一。急性心肌梗死后心肌组织大量损伤、坏死[1],由于成年哺乳动物的心肌再生能力有限,坏死心肌常由肉芽组织和胶原瘢痕替代,引起心室结构和功能的改变,最终导致心力衰竭[2-4]。以往的研究发现,骨髓来源的前体细胞群可以分泌一系列细胞因子、趋化因子以及生长因子,并通过旁分泌作用促进组织修复[5]。1号染色体开放读码框54位基因编码蛋白(C1ORF54)是一种具有潜在促修复功能的分泌蛋白[6],本研究旨在探讨C1ORF54对心肌梗死后心脏修复的作用和机制。
1 材料与方法
1.1 实验动物
C57BL/6小鼠购买自上海斯莱克实验动物有限公司,C1ORF54敲除小鼠(C57BL/6遗传背景,C1KO)购自上海南方模式生物科技股份有限公司。小鼠在上海交通大学附属瑞金医院实验动物中心SPF级环境中以普通饲料喂养。实验期间,保持动物房内适宜的温度、湿度以及光照时间,小鼠自由进食,自由饮水。
1.2 实验动物分组
选取8~12周雄性C57BL/6小鼠随机分为4组:敲除假手术组(n=12)、野生假手术组(n=12)、敲除心肌梗死模型组(n=17)和野生心肌梗死模型组(n=17)。其中,野生型小鼠处理流程见图1,C1ORF54敲除小鼠做相同分组处理。
1.3 主要试剂
C1ORF54一抗购自Abnova和Santa Cruz公司;Ki-67、p38丝裂原活化蛋白激酶/磷酸化的p38丝裂原活化蛋白激酶(p38/p-P38)、信号传导及转录激活因子3/磷酸化的信号传导及转录激活因子3(STAT3/p-STAT3)、β-连环蛋白(β-catenin)和蛋白激酶B/磷酸化蛋白激酶B(AKT/p-AKT)抗体购自Cell Signal Technology公司,鼠/兔超敏反应组织化学试剂盒、Masson染色试剂盒、二氨基联苯胺(DAB)显色试剂盒购自福州迈新公司。
图 1 野生型小鼠处理流程
1.4 心肌梗死模型构建
C1ORF54敲除小鼠及野生型小鼠经异氟烷麻醉,气管插管后连接小动物呼吸机维持麻醉,侧卧位剪开皮肤,撑开器撑开第3、4肋软骨,暴露心脏。7-0丝线结扎冠状动脉左前降支,依次关闭肋骨,并使用5-0丝线缝合各层皮肤,撤除麻醉,待小鼠恢复自主呼吸后拔管。假手术组小鼠在暴露心脏后不结扎左前降支,但按相同步骤进行缝合。
1.5 心肌梗死后心脏质量及超声心动图检测
造模后,使用小动物超声系统Visual Sonics Vevo 2100(VISUAL SONIC公司)检测并计算各组小鼠心功能各项指标,包括左室舒张末期内径(LVEDD)、左室收缩末期内径(LVESD)、短轴缩短率(FS)、射血分数(EF)。测定小鼠体质量及心脏组织质量并计算其质量比。
1.6 Masson染色
小鼠于心肌梗死造模后21 d行超声检测后处死,并用生理盐水行全身灌注,取出心脏浸泡于4%多聚甲醛中固定,石蜡包埋,最终制作成厚度为5 μm的组织切片。依次进行脱蜡水化、苏木精染核、盐酸酒精分化、丽春红酸性品红染色、冰醋酸浸洗、磷钼酸溶液分化、苯胺蓝染色、常规透明后中性树胶封片等步骤。采用Olympus光学显微成像系统观察并拍照记录。
1.7 免疫组织化学染色法检测Ki-67蛋白表达
各组小鼠术后第3天的心脏组织石蜡切片,经常规脱蜡水化后,使用柠檬酸缓冲液进行微波加热抗原修复。滴加过氧化酶阻断液阻断内源性过氧化酶,经非免疫动物血清封闭后,加入稀释后一抗孵育,加入生物素标记二抗孵育,加入链霉菌抗生物素-过氧化酶溶液,最终滴加DAB显色液。苏木素染核,分化并返蓝,透明,中性树胶封片。于Olympus显微镜下观察心肌梗死后心肌组织中蛋白的表达情况。
1.8 Western blot法检测p38、STAT3、β-catenin、AKT等蛋白的表达水平
在各组小鼠术后第3天的蛋白样本中加入PMSF+RIPA裂解液并研磨、定量,制成蛋白样本。凝胶电泳后,将蛋白转移至聚偏氟乙烯(PVDF)膜上。使用3%BSA室温下封闭。按蛋白大小裁剪条带并加入对应一抗,于4 ℃孵育过夜。之后加入对应一抗种属来源的二抗,室温下孵育1 h,使用显影液显影,采用Tanon成像系统进行拍摄。
1.9 统计学分析
图像结果均采用ImageJ软件进行灰度值分析。使用SPSS 19.0软件进行统计学分析,计量资料使用均数±标准差表示。组间比较采用two-way ANOVA检验,P<0.05为差异有统计学意义。
2 结果
2.1 心功能及纤维化程度比较
造模21 d后,心肌梗死模型组与假手术组小鼠相比,心功能各指标均有明显恶化,见表1。而敲除心肌梗死模型组与野生心肌梗死模型组相比,尽管两组心率相似,但敲除心肌梗死模型组小鼠的LVEDD、LVESD和心脏质量比明显升高,而EF明显降低(P均<0.01)。Masson染色结果显示,C1ORF54基因敲除小鼠心肌纤维化程度高于野生型小鼠,见图2。
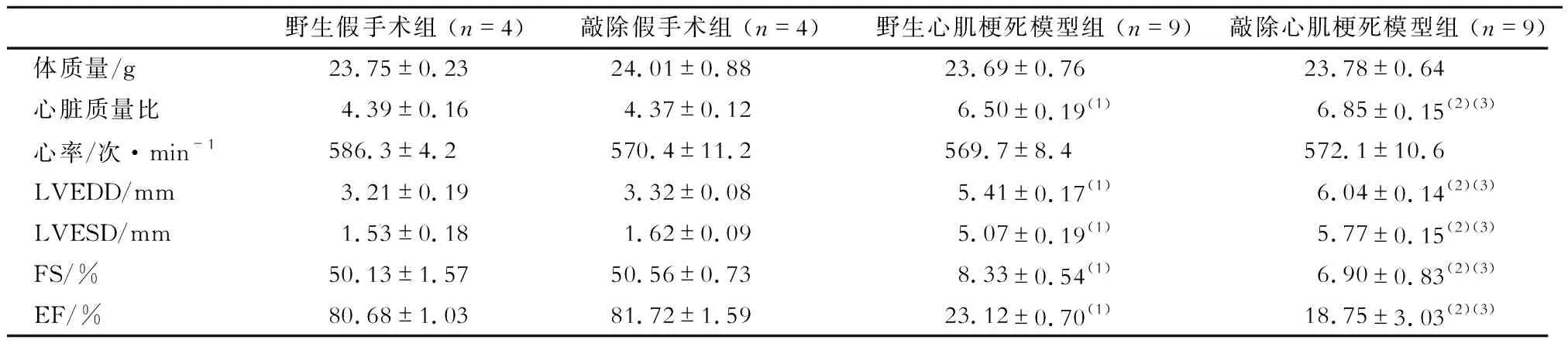
表1 造模21 d后各组小鼠心脏超声测定比较
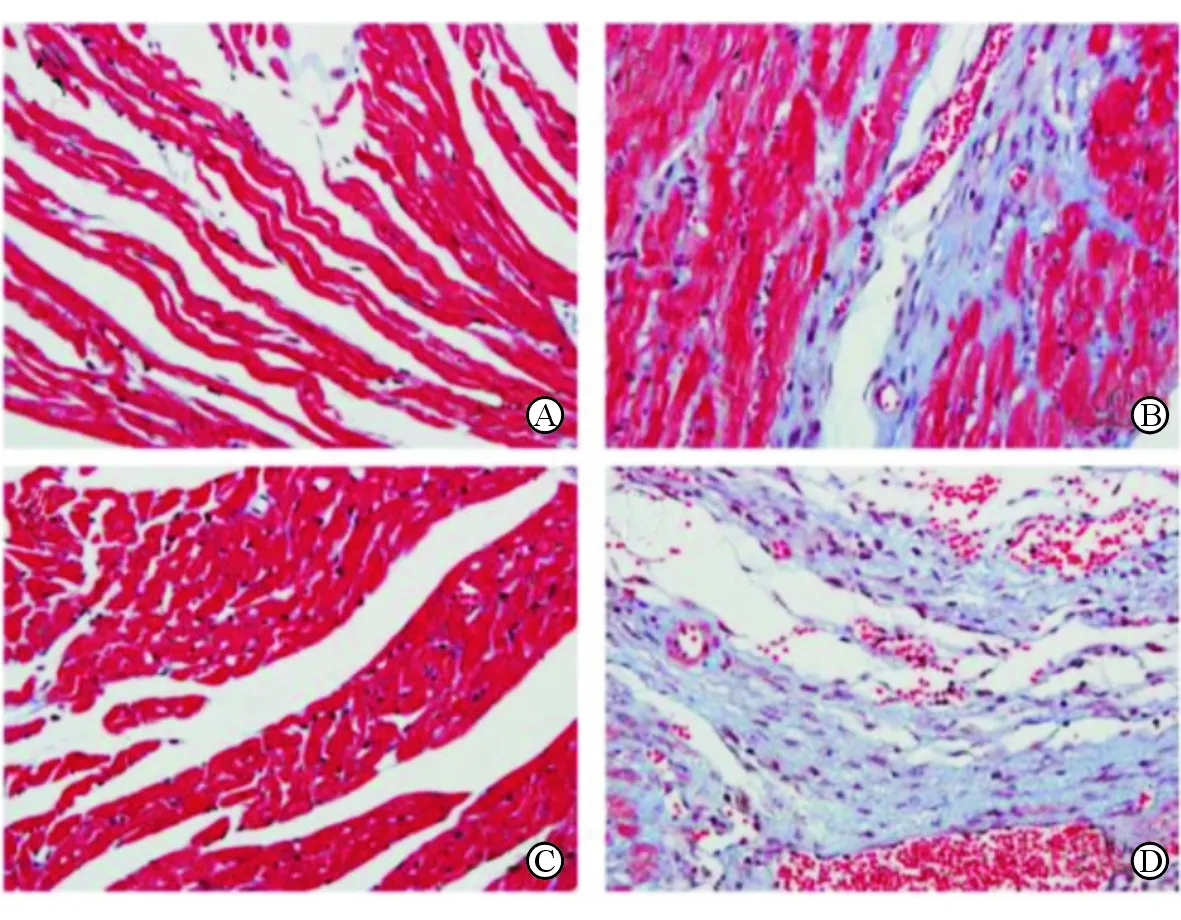
注: A为野生假手术组术后21 d的心肌组织;B为野生心肌梗死模型组术后21 d的心肌组织;C为敲除假手术组术后21 d的心肌组织;D为敲除心肌梗死模型组术后21 d的心肌组织;红色部分为正常肌纤维,蓝色部分为胶原纤维
2.2 心肌组织Ki-67染色结果
小鼠左室心肌Ki-67免疫组织化学染色结果显示,心肌梗死后第3天,C1ORF54基因敲除小鼠Ki-67阳性细胞数较野生型小鼠明显升高(P均<0.05),见图3。

注:A为敲除心肌梗死模型组术后3 d的Ki-67染色;B为敲除心肌梗死模型组术后3 d的Ki-67与DAPI共染色;C为野生心肌梗死模型组术后3 d的Ki-67染色;D为野生心肌梗死模型组术后3 d的Ki-67与DAPI共染色;图中绿色为Ki-67阳性细胞,蓝色为DAPI核染色
2.3 p38、STAT3、β-catenin、AKT通路蛋白的表达变化
Western blot检测结果表明,心肌梗死造模后第3天,敲除心肌梗死模型组小鼠的p38/p-P38、STAT3/p-STAT3、β-catenin的蛋白表达水平与野生型心肌梗死模型组相比,差异无统计学意义,但敲除心肌梗死模型组小鼠p-AKT通路蛋白的表达水平明显低于野生型心肌梗死模型组(P<0.01)。敲除假手术组与野生假手术组相比,各蛋白表达水平并无明显差异。见图4。

图 4 各组小鼠心脏信号通路蛋白的表达情况
3 讨论
分泌蛋白具有改善心肌梗死后组织再灌注以及舒缩功能的潜力,近年来受到广泛关注。在哺乳动物蛋白质组中,大约2 000种蛋白具有与分泌功能相关的结构[7],但至今大多数蛋白的生物学功能未被检测出。Jay 等[8]发现了两种具有分泌蛋白结构和潜在的促进组织修复功能的蛋白,包括C19ORF10(后命名为“骨髓来源生长因子”)和C1ORF54。之后的研究表明,C19ORF10可促进血管及心肌细胞再生。但是,C1ORF54的具体功能尚不清楚。本研究显示, C1ORF54基因的缺失可引起小鼠心肌梗死后左室收缩和舒张功能恶化,心肌纤维化程度上升,这种作用可能通过影响心肌纤维细胞的增殖来完成。这些研究结果提示,C1ORF54可能在心肌梗死后心脏重构中发挥一定作用。
既往研究发现,C1ORF54可能通过影响IGF-1/mTOR/AKT信号通路,参与先天性弥漫性高胰岛素血症的发生发展[9]。PI3K/AKT通路在细胞增殖、迁移、蛋白合成和血管生成中发挥着重要作用[10-11]。本研究显示,心肌梗死后C1ORF54敲除小鼠p-AKT的激活受到明显抑制,提示C1ORF54可能通过激活AKT通路而发挥抑制心肌纤维细胞增殖的功能。我们推测,心肌梗死后C1ORF54作为分泌蛋白,进入血液循环,进而影响心肌纤维细胞的增殖。然而,有关C1ORF54如何释放入血液循环,以及通过何种方式调控PI3K/AKT信号通路,仍需要进一步研究。此外,C1ORF54对心肌梗死后心肌纤维化的具体作用机制也需进一步论证。
本研究证明,C1ORF54可以通过调控PI3K/AKT信号通路,促进心肌梗死后心肌纤维细胞增殖,进而改善左心功能。C1ORF54有望成为心肌梗死治疗的新靶点。
