体外模拟胃肠消化过程中蒸汽爆破处理的苦荞麸皮的抗氧化及抗增殖活性
2019-03-01唐宇张小利何晓琴李苇舟李富华明建
唐宇,张小利,何晓琴,李苇舟,李富华,2,明建,2*
1(西南大学 食品科学学院,重庆,400715)2(重庆市特色食品工程技术研究中心,重庆,400715)
苦荞(Tartary buckwheat, TB),又称鞑靼荞麦(FagopyrumtartaricumL. Gaerth),是我国的特有品种资源,主要集中生长在我国西南地区[1-2]。苦荞中酚类物质含量丰富,比玉米、小麦、燕麦、大米等谷物高5~16倍[3]。全谷物的健康益处与集中在谷物外层的生物活性化合物有关[4]。研究发现,谷物中的酚类化合物具有抗氧化性,可防止DNA、蛋白质和膜脂等生物重要分子氧化损伤,并抑制HepG2细胞的增殖[5]。苦荞中的多酚主要存在于麸皮部位[6-7],然而,由于苦荞麸皮口感粗糙,不易消化,所以大部分被丢弃,利用率较低。
蒸汽爆破(简称汽爆)是一种新兴的预处理方式,在0.005 08~0.008 75 s迅速释放压力,从而导致复杂的机械反应[8-9],具有高效、经济、环保的优点。CHEN等[10]发现,蒸汽爆破处理后,漆树果实的黄酮得率比原样高8倍,西藏裸大麦的可溶性酚醛树脂产量是未处理样品的9倍[11],蒸汽爆破已经被证明是释放与细胞壁中多糖结合的酚类化合物的有效方法。
有研究表明,经胃肠道消化而释放的活性成分才有可能被人体利用吸收[12-13]。麦麸基质会阻碍多酚在人体胃肠道的释放[14-15]。BAUBLIS等[16]也发现,消化过程能够改变小麦基食品的抗氧化潜力。
本文以苦荞麸皮为原料,利用蒸汽爆破对其进行预处理,并结合体外模拟胃肠消化模型,研究蒸汽爆破前、后苦荞麸皮在模拟胃肠消化阶段多酚的释放量,抗氧化活性及抑制人肝癌细胞HepG2和结肠癌细胞Caco-2增殖情况,为科学评价苦荞麸皮的营养价值,综合开发利用苦荞麸皮资源提供参考。
1 材料与方法
1.1 试验材料与试剂
苦荞麸皮,来源于四川西昌苦荞品种苦荞3号,由西昌市三匠荞麦有限公司提供。
1.2 主要仪器与设备
QBS-80汽爆分析试验台,河南鹤壁正道生物能源有限公司;DK-8B型电热恒温水浴锅,上海精密实验设备有限公司;DK3B电热恒温水浴振荡摇床,上海一恒科学仪器有限公司;Spectra Max M2型多功能酶标仪,美国Molecular公司。
1.3 方法
1.3.1 苦荞麸皮预处理
未汽爆组苦荞麸皮的制备:将苦荞麸皮研磨成粉,过60目筛,备用。
汽爆组苦荞麸皮的制备:蒸汽爆破设备预热后,将一定量的苦荞麸皮原料放入汽爆罐(爆腔400 mL)中,关闭进气阀,待压力上升至1.5 MPa后,开始计时,维持压力60 s,离爆破终点还有3 s时,将气阀关闭,瞬间自动泄压。在物料回收窗收集荞麦麸皮,干燥磨粉,过60目筛,备用。
1.3.2 体外模拟消化
体外模拟消化包含体外模拟胃消化和体外模拟肠消化两部分。体外模拟肠消化是在胃消化的基础上,根据胃消化的最佳消化时间点(即在该时间点多酚释放量最高),在此基础上再进行肠消化。
1.3.2.1 模拟胃消化
参照赵旭[17]实验方法,取20 g(干重)样品,加入200 g 0.9%生理盐水,均质3 min使其溶解均匀,加热糊化使其内部中心温度达到80 ℃并保持10 min,流水冷却,添加少许去离子水至220 g;用1 mol/L HCl调pH至2.0,加入2.5 mL胃蛋白酶溶液(0.2 g胃蛋白酶溶于5 mL 0.01 mol/L HCl)。空白对照组用等体积的生理盐水替代盐酸和胃液,胃酸对照组用等体积0.01 mol/L HCl代替胃蛋白酶溶液。避光,通氮气,37 ℃恒温水浴摇床消化4 h。分别在消化0, 1, 2, 3, 4 h时取出一定质量悬浊液,12 000 r/min,4 ℃,离心15 min,取上清液,分装,-80 ℃贮存备用。
1.3.2.2 模拟肠消化
参照赵旭[17]实验方法,先模拟胃消化,步骤如1.3.2.1,达到最佳胃消化时间时终止胃消化,向消化液中加入1 mol/L NaHCO3调pH至6.9;加入5 mL胰酶-胆汁提取物(4 g胰酶、25 g胆汁提取液溶于1 L 0.1 mol/L NaHCO3缓冲溶液),混匀。空白组用等体积NaHCO3缓冲溶液代替胰酶-胆汁提取物。避光,通氮气,37 ℃恒温水浴摇床消化6 h。分别在肠消化0, 1, 2, 3, 4 h取出一定质量的悬浊液,12 000 r/min,4 ℃离心15 min,取上清液,分装,-80 ℃贮存备用。
1.3.3 多酚含量测定
采用福林酚法[3]。以没食子酸为标准品,得线性回归方程:y=0.002 5x+0.021 4;R2=0.998 3。测定结果以1 g苦荞麸皮粉样品中所含的没食子酸当量(mg GAE/g md)表示。
1.3.4 抗氧化活性测定
1.3.4.1 氧自由基清除能力(ORAC)
方法参照WOLFE等[18]。以Trolox为标准品,结果以1 g苦荞麸皮中所含的Trolox当量表示(μmol TE/ g md)。
1.3.4.2 细胞抗氧化活性测定
采用WOLFE等[19]建立的细胞模型,进行细胞内抗氧化活性的测定。HepG2单细胞悬液100 μL接种在96孔板上,每孔细胞数达到6×104个,于37 ℃,5%CO2条件下培养24 h后除去培养液,用PBS清洗每个接种孔。每孔添加100 μL不同浓度的样品消化液(含有25 μmol/L的DCFH-DA),在37 ℃,5%CO2条件下继续培养1 h。取出96孔板,用100 μL PBS清洗每个孔,除去溶液后加入100 μL HBSS(含有600 μmol/L的ABAP),将96孔板立即放入保持37 ℃恒温的酶标仪中,在激发波长538 nm,入射波长485 nm条件下测定荧光强度,每5 min测定1次,测定1 h。
1.3.5 抗增殖活性测定
细胞毒性参照WOLFE等[19]和FELICE等[20]的方法来测定。将100 μL HepG2单细胞悬液接于96孔板中,细胞个数为4×104/孔,在5%CO2,37 ℃培养24 h,待细胞生长贴壁后移除孔内培养基,无菌PBS清洗1次,将100 μL过滤除菌的含样品消化液的培养基加至96孔板中(空白对照组只加生长培养基),在5%CO2,37 ℃条件下培养24 h,移除上清液,PBS清洗每个孔后去除溶液,加50 μL/孔亚甲基蓝溶液(98%HBSS,0.67%戊二醛,0.6%亚甲基蓝)染色,5%CO2,37 ℃条件下培养1 h后,移除染料,并用去离子水清洗孔板至清洗液清澈透明,吸去板中多余水分,加100 μL/孔洗脱液(49%PBS,50%乙醇,1%醋酸),振荡器上振荡20 min,最后在酶标仪570 nm下测定吸光度。
苦荞麸皮多酚细胞增殖抑制实验参考FELICE等[20]和YOON等[21]的亚甲基蓝比色法。各样品消化液在使用前以0.22 μm的膜过滤除菌。将人肝癌细胞HepG2细胞,人结肠癌细胞Caco-2细胞悬液分别接种于96孔细胞培养板,并使每孔的细胞数量为2.5×104个,于37 ℃,5%CO2条件下培养一定时间使细胞完全贴壁生长(HepG2细胞一般培养4 h,Caco-2细胞一般需要培养6 h),将生长培养基移除,加入100 μL含不同浓度样品消化液的处理培养基。在37 ℃,5%CO2条件下培养细胞96 h,移去处理培养基,将细胞染色,清洗,洗脱,在酶标仪570 nm下测定吸光度,用空白孔去背景值。以半最大效应浓度(EC50)来判定细胞的抗增殖作用。
1.4 数据处理
每个样品重复测定3次,结果表示为平均值±标准偏差(Mean±SD),运用SPSS软件(Version 19.0)进行不同值之间的方差分析和Tukey’s检验,显著性差异值为P<0.05,图表制作采用Origin软件(Version 16.5)。
2 结果与分析
2.1 体外模拟消化过程苦荞麸皮中多酚释放量变化
体外模拟胃肠液消化过程中汽爆前后苦荞麸皮多酚释放量变化情况如图1所示,未汽爆组和汽爆组麸皮胃、肠消化组的多酚释放量明显高于相应的对照组(P<0.05),即胃胰蛋白酶能促进苦荞麸皮多酚释放,与HE等[22]的研究一致。模拟胃消化2 h后,未汽爆组麸皮的多酚释放量从(0.92±0.05) mg GAE/g md增加到(2.04±0.08) mg GAE/g md,而汽爆组从(3.52±0.36) mg GAE/g md增加到(5.18±0.38) mg GAE/g md。肠消化4 h后,未汽爆组多酚释放量从(2.15±0.01) mg GAE/g md增加到(3.19±0.16) mg GAE/g md,汽爆组从(5.61±0.01) mg GAE/g md增加到(10.23±0.18) mg GAE/g md。消化过程中多酚含量变化,可能是因为麸皮中多酚化合物相互作用,影响了它们的溶解度和潜在生物利用度[23]。汽爆组的多酚含量在消化前后均高于未汽爆组,证明汽爆处理能提高多酚的释放量。
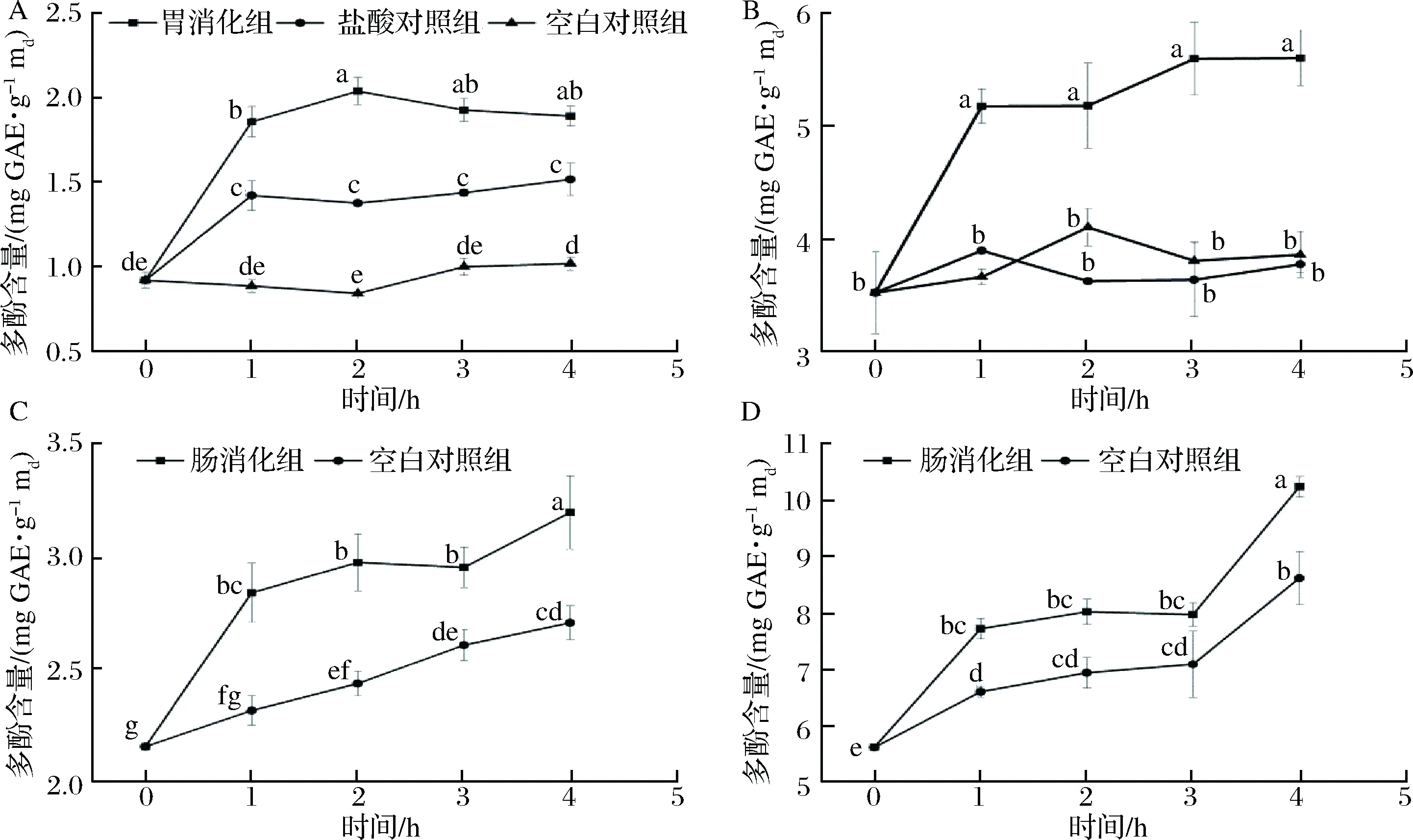
图1 汽爆前后苦荞麸皮模拟胃肠消化中多酚含量变化
Fig.1 The change of phenolics content of Tartary buckwheat braninvitrosimulated gastrointestinal digestion
before and after steam explosion
注:A、B是未汽爆组麸皮,C、D是汽爆组麸皮。折线图上不同字母表示差异显著(P<0.05)。
2.2 体外模拟消化对苦荞麸皮ORAC值影响
图2表示了汽爆苦荞麸皮和未处理麸皮胃肠消化液的ORAC值变化规律。与盐酸、空白对照组相比,汽爆前后的苦荞麸皮胃消化组的ORAC值均增加,与苦荞芽粉馒头体外消化后抗氧化能力研究中得到的结论一致[24]。酚类物质通常以糖苷配体或者酯的形式存在,经过胃液的酸性环境会水解释放大量的多酚,使得样品的多酚含量在模拟胃肠消化后显著增加[25-26],而ORAC值与多酚含量呈显著性正相关[27],所以模拟胃肠消化后苦荞麸皮的ORAC值增大。在模拟胃消化过程中,汽爆组的ORAC值在4 h时最高,为(192.43±7.38) μmol TE/g md,较0 h提高了2.18倍;未汽爆组的ORAC值在2 h时最高,为(99.82±8.71) μmol TE/g md,是0 h的2.52倍。模拟肠消化过程中,汽爆组的ORAC在4 h最高,为(310.57±15.87) μmol TE/g md,较0 h提高了2.33倍,未汽爆组在3 h时ORAC最高,为160.54 μmol TE/g md,是0 h的1.71倍。模拟胃、肠消化全阶段,汽爆组的ORAC值均高于未汽爆组,可能是因为蒸汽爆破处理促进黄酮糖苷去糖苷化制成苷元,去除糖基后的苷元生物活性优于糖苷[10]。
2.3 苦荞麸皮在体外模拟消化中细胞抗氧化活性变化
汽爆前、后麸皮多酚释放量分别在胃消化2、3 h达到最大,所以此处分别对未汽爆麸皮胃消化2 h、汽爆麸皮胃消化3 h消化液进行细胞抗氧化性评价。抗氧化剂能够猝灭过氧自由基,随着多酚浓度增加,多酚处理孔的荧光强度降低,且低于未处理孔,即多酚细胞抗氧化能力越强。如图3,未汽爆组胃0 h组,即胃消化初始液,在低质量浓度(20、40 mg/mL)时促氧化,随着浓度增加表现出抗氧化作用;胃消化2 h组和盐酸对照2 h组,有良好的抗氧化的作用,随浓度增加抗氧化效果增强。空白对照2 h组在低质量浓度(<80 mg/mL)时促氧化,高质量浓度(>80 mg/mL)时呈现抗氧化作用。汽爆组苦荞麸皮和空白对照组具有良好的抗氧化活性,且随消化液质量浓度的增加抗氧化活性越强。盐酸对照组在低质量浓度(20、40 mg/mL)表现出一定的促氧化作用,当浓度大于60 mg/mL,具有抗氧化作用,且随着质量浓度的增加而抗氧化作用增强。

图2 苦荞麸皮模拟胃肠消化ORAC值的变化
Fig.2 The change of ORAC value of the Tartary buckwheat braninvitrosimulated gastrointestinal digestion
注:A、C是未汽爆组苦荞麸皮;B、D是汽爆组苦荞麸皮;折线图上不同字母表示差异显著(P<0.05)。

图3 体外模拟胃消化过程中苦荞麸皮消化液细胞抗氧化动力学曲线
Fig.3 Cell antioxidant activity(CAA)kinetic curve of the Tartary buckwheat bran digestive fluidinvitrosimulated gastric digestion
注:A、C、E、G分别是未汽爆麸皮的胃消化0 h、胃消化2 h、盐酸对照2 h、胃空白对照2 h组;B、D、F、H分别是
汽爆麸皮的胃消化0 h、胃消化3 h、盐酸对照3 h、胃空白对照3 h组
汽爆前、后苦荞麸皮肠消化液的细胞抗氧化动力学曲线见图4,未汽爆组肠消化0、4 h,空白对照组4 h的荧光动力曲线均高于空白质量浓度,表现出促氧化效果,没有细胞抗氧化活性。而汽爆组肠消化0 h、4 h、空白对照组4 h在低质量浓度(20 mg/mL)时也促氧化,当质量浓度大于40 mg/mL时,其荧光动力曲线低于空白浓度,呈现抗氧化作用。由图3、图4可知,未汽爆组和汽爆组麸皮的胃消化组都有细胞抗氧化性,其抗氧化活性随这消化液质量浓度的增加而增强;未汽爆麸皮的肠消化组没有细胞抗氧化活性,汽爆麸皮的肠消化组在一定质量浓度(>40 mg/mL)有细胞抗氧化活性,即蒸汽爆破对麸皮的抗氧化能力有一定的影响。

图4 体外模拟肠消化过程中苦荞麸皮消化液细胞抗氧化动力学曲线
Fig.4 Cell antioxidant activity(CAA)kinetic curve of the Tartary buckwheat bran digestive fluidinvitro
simulated intestinal digestion
注:A、C、E分别是未汽爆麸皮的肠消化0 h、肠消化4 h、肠空白对照4 h组;B、D、F分别是汽爆麸皮的肠消化0 h、
肠消化4 h、肠空白对照4 h组
汽爆前、后苦荞麸皮胃肠消化液的细胞抗氧化EC50值如表1所示。汽爆前、后苦荞麸皮胃消化组的EC50均小于其他对照组,即麸皮胃消化后抗氧化活性增强,此结果与FALLER等[28]的结果一致,消化后八宝饭的细胞抗氧化性也比未消化样品强。模拟肠消化,只有汽爆麸皮肠消化组具有细胞抗氧化活性(EC50=(150.32±6.43) mg/mL),且强于肠空白对照组,说明胰酶对抗氧化物质的释放有增强的作用,也进一步说明汽爆后麸皮的肠消化液更容易被细胞吸收,而未汽爆麸皮的肠消化液未进入细胞内部而被PBS洗去。
2.4 苦荞麸皮体外模拟消化液抗增殖活性研究
2.4.1 苦荞麸皮体外模拟消化液抑制HepG2细胞增殖作用

表1 苦荞麸皮在体外模拟胃肠消化过程细胞抗氧化活性(EC50)Table 1 The EC50 values in CAA assay of the Tartarybuckwheat bran in vitro simulated gastrointestinal digestion
注:nd表示因无细胞抗氧化活性而未检测到EC50值。
图5显示汽爆前、后苦荞麸皮各消化组对HepG2细胞的抗增殖作用。表2列出了汽爆前、后苦荞麸皮体外模拟胃肠消化液抑制HepG2和Caco-2细胞的EC50值。EC50值越小,细胞抗增殖率越大。未汽爆麸皮胃消化2 h组对HepG2细胞的抑制作用(EC50=(12.89±0.97) mg/mL)弱于胃消化0 h组(EC50=(10.56±0.29) mg/mL),汽爆麸皮肠消化4 h组对HepG2细胞的抑制效果(EC50=(4.88±0.97) mg/mL)弱于空白对照组(EC50=(3.51±0.05) mg/mL),此结果与BOAVENTURA等[29]的研究结果类似。而汽爆麸皮胃消化2 h组和未汽爆麸皮肠消化4 h组对HepG2细胞抑制作用增强,所以此时并不能断定苦荞麸皮消化液不能抑制HepG2细胞的增殖,还需深入研究。

A-未汽爆组;B-汽爆组麸皮图5 苦荞麸皮体外模拟胃肠消化液对HepG2细胞的抗增殖作用Fig.5 The antiproliferative effects against human HepG2 liver cancer cells by the digestive fluid of the Tartary buckwheat branin vitro simulated gastrointestinal digestion
表2 苦荞麸皮体外模拟胃肠消化液对HepG2和Caco-2细胞的抗增殖活性(EC50)和细胞毒性(CC50)Table 2 The anti-proliferation (EC50) and cytotoxicity (CC50) of the Tartary buckwheat bran againsthuman HepG2 liver cancer cells and human Caco-2 colon cancer cells in vitro simulated gastrointestinal digestion

消化液HepG2细胞Caco-2细胞EC50/(mg·mL-1)CC50/(mg·mL-1)EC50/(mg·mL-1)CC50/(mg·mL-1)样1胃消化0 h11.70±0.12cd>10036.40±1.21e>15样1胃消化组2 h12.89±0.97c>1373.60±2.89b>13样1盐酸对照组2 h18.43±0.04a>1361.41±2.31c>15样1胃空白对照组2 h10.56±0.29de>12526.31±0.90f>5样1肠消化0 h6.95±0.09g>25132.20±5.78a>20样1肠消化组4 h3.01±0.17i>5024.06±0.99f>20样1肠空白对照组4 h8.57±1.45f>1339.16±3.38de>20样2胃消化0 h12.32±0.13c>10025.48±1.02f>20样2胃消化组2 h9.37±1.20ef>2041.20±0.22d>15样2盐酸对照组2 h16.31±0.31b>1525.40±1.79f>3样2胃空白对照组2 h12.48±0.99c>9517.97±0.67g>10样2肠消化0 h6.68±0.10g>10024.27±0.98f>20样2肠消化组4 h4.88±0.97h>10013.27±0.85h>15样2肠空白对照组4 h3.51±0.05i>10013.13±0.27h>19
注:样1、样2分别是未汽爆组苦荞麸皮、汽爆组苦荞麸皮。
2.4.2 苦荞麸皮体外模拟消化液抑制Caco-2细胞增殖作用
如图6,未汽爆和汽爆麸皮的胃肠消化组对Caco-2细胞的抑制作用并不显著。在麸皮质量浓度为20 mg/mL时,汽爆麸皮胃、肠消化组Caco-2细胞的增殖率分别为56.1%、26.9%,未汽爆麸皮胃、肠消化组Caco-2细胞的增殖率分别为85.9%、59.9%,汽爆麸皮胃、肠消化组对Caco-2细胞的抗增殖作用均高于未汽爆麸皮,蒸汽爆破促进了苦荞麸皮对Caco-2细胞的抑制。然而由表2可知汽爆前后的苦荞麸皮的EC50值均大于对应的毒性浓度,所以这种抗增殖作用可能是由于细胞毒性引起的。未汽爆组麸皮的胃消化组对Caco-2细胞的抗增殖作用弱于其胃消化0 h组,该结果与FRONTELA-SASETA等[30]的研究一致,消化后菠萝汁对Caco-2细胞的抑制作用也弱于新鲜样品。然而,汽爆组麸皮的胃消化组对Caco-2细胞的抗增殖作用强于其胃消化0 h组,有可能蒸汽爆破促进了麸皮活性成分的释放,因此,对Caco-2细胞的抗增殖作用增强。

A-未汽爆组;B-汽爆组麸皮图6 苦荞麸皮体外模拟胃肠消化液对Caco-2细胞的抗增殖作用Fig.6 The antiproliferative effects against human Caco-2 colon cancer cells by the digestive fluid of theTartary buckwheat bran in vitro simulated gastrointestinal digestion
3 结论
本文以苦荞麸皮为研究对象,利用蒸汽爆破对苦荞麸皮进行预处理,并结合体外模拟胃肠消化模型,通过测定消化过程中多酚的释放及ORAC值的变化,并对其细胞抗氧化活性、细胞抗增殖活性进行研究。结果表明,蒸汽爆破预处理、胃蛋白酶及胰酶都能促进苦荞麸皮多酚黄酮的释放,并且汽爆苦荞麸皮的ORAC值高于未汽爆苦荞麸皮。细胞抗氧化活性评价结果显示,汽爆前后苦荞麸皮的胃消化组都有细胞抗氧化活性,而模拟肠消化,只有汽爆组麸皮具有细胞抗氧化活性。同时,在细胞毒性浓度范围内,两种苦荞麸皮的胃肠消化液对HepG2细胞增殖均有抑制作用,抗增殖活性大小为:未汽爆麸皮肠消化组>汽爆麸皮肠消化组>汽爆麸皮胃消化组>未汽爆麸皮胃消化组。汽爆前、后麸皮的胃肠消化液对Caco-2细胞都有抑制作用,但这种抗增殖作用可能是由于细胞毒性引起的。综上所述,蒸汽爆破能促进苦荞麸皮多酚的释放,并且促进其在细胞的吸收,且仍保持其抗氧化活性。蒸汽爆破处理的苦荞麸皮具有一定的抗增殖活性,值得进一步在体内调查研究。
