窖泥中高产愈创木酚类功能菌的筛选与鉴定
2019-03-01周金虎李良方尚玲董孝元张超陈茂彬
周金虎,李良,方尚玲,董孝元,张超,陈茂彬*
1(发酵工程教育部重点实验室(湖北工业大学),湖北 武汉,430068) 2(黄鹤楼酒业(咸宁)有限公司,湖北 咸宁,437000)3(工业发酵湖北省协同创新中心,湖北 武汉,430068) 4(工业微生物湖北省重点实验室,湖北 武汉,430068)
白酒作为中国的国酒,有数千年的历史,很多重要的场合都离不开白酒的身影,白酒已成为我国文化的一部分[1]。近年来,越来越多的科研工作者投入到白酒中健康因子的研究中来。茅台、泸州老窖等白酒企业对白酒与人体健康的关系进行了详细调查,发现茅台酒有多种保健功效[2]。李大和等[3]报道了白酒中的一些微量活性成分对人体健康的影响。张金修等[4]报道4-乙基愈创木酚是优良的自由基清除剂,具有良好的活性氧消除功能,可抗氧和预防心血管等多种疾病的发生,具有预防疾病、抗衰老、促进人体健康的作用。
目前,产愈创木酚类物质主要是一些芽孢杆菌和圆酵母[5]。王霜等[6]报道从浓酱兼香型酒醅中筛选出2株高产4-乙烯基愈创木酚的菌株,分别是地衣芽孢杆菌LS9和枯草芽孢杆菌S10。王少磊等[7]报道从浓香型大曲中筛选到1株高产4-乙基愈创木酚的菌株,经鉴定为解淀粉芽孢杆菌EG06。
本试验旨在从窖泥中筛选出几株高产愈创木酚类物质的功能菌,为细菌麸曲制作提供菌株,以期为白酒生产实践提供参考,提高白酒中愈创木酚类物质的含量。
1 材料与方法
1.1 材料与试剂
样品:黄鹤楼酒浓香型窖泥。
菌种分离培养基[8]:肉汤固体培养基:牛肉膏质量浓度为3 g/L、蛋白胨质量浓度为10 g/L、氯化钠质量浓度为5 g/L,琼脂粉质量浓度为20 g/L,pH自然,121 ℃下灭菌20 min。
耐受性筛选基础培养基:肉汤液体培养基。
种子培养基:肉汤液体培养基。
发酵培养基(麸皮培养基)[7]:麸皮5 g,加水95 mL,混匀后分装于250 mL三角瓶121 ℃灭菌30 min。
1.2 仪器与设备
5977B—7890B气相色谱质谱联用仪(gas chromatography-mass spectrometer,GC-MS),美国安捷伦公司;SW-CJ-2FD型双人单面净化工作台,苏州净化设备有限公司;LRH-250生化培养箱,上海一恒科学仪器有限公司;LDZX-50KBS立式压力蒸汽灭菌锅,上海申安医疗器械厂;DYY-7B电泳仪,北京六一仪器厂;Millipore纯水仪等。
1.3 方法
1.3.1 菌种的初步分离纯化[8]
无菌条件下,取5 g窖泥于95 mL 0.9%无菌生理盐水中,稀释度为10-2,摇床中振荡30 min,然后用移液枪取1 mL稀释度为10-2的稀释液于9 mL 0.9%无菌生理盐水中,稀释度为10-3,依次类推,直至10-6,然后用移液枪吸取200 μL稀释液于肉汤固体培养基平板上涂布均匀,取10-4、10-5、10-6三个稀释度进行涂布,每个稀释度涂2块平板,于37 ℃恒温箱倒置培养24 h,观察菌落特征并进行编号。
无菌条件下,用接种环挑取稀释涂布生长后的各菌,于肉汤固体培养基平板上划线,于37 ℃恒温箱倒置培养24~36 h。
镜检:取平板划线长好的各编号单菌落进行镜检观察,确定细菌和酵母菌,对细菌采用革兰氏染色。
1.3.2 高产愈创木酚类物质功能菌的筛选[10-12]
试验组:将初步分离得到的各菌种按5%的接种量(v/m)接入发酵培养基中,于37 ℃、160 r/min条件下培养6 d。空白组:麸皮5 g,加水95 mL,混匀后分装于250 mL三角瓶,不接入菌种,于37 ℃、160 r/min条件下培养6 d。
样品处理:取100 mL麸皮发酵液于500 mL蒸馏烧瓶中,加100 mL 50%vol乙醇混匀后真空旋转浓缩,收集馏出液100 mL。
愈创木酚类物质的定量检测:用GC-MS进行检测,采用外标法定量。愈创木酚类标准溶液的配制:愈创木酚、4-甲基愈创木酚、4-乙基愈创木酚标品分别用无水乙醇配制10.0 mg/L的标准溶液(母液),取适量体积质量浓度为10.0 mg/L的愈创木酚、4-甲基愈创木酚、4-乙基愈创木酚混合制备系列标准工作溶液,使愈创木酚、4-甲基愈创木酚、4-乙基愈创木酚的质量浓度均为100.0~5 000.0 μg/L(即5 000.0、3 000.0、2 500.0、1 000.0、500.0、250.0、100.0 μg/L),将标准工作液储存于-4 ℃备用。
样品处理采用顶空固相微萃取法,气相色谱仪条件为:色谱柱型号DB-WAX,进样口温度260 ℃,采用不分流模式进样,初始柱温50 ℃,保持0 min;以20 ℃/min速度升温至150 ℃,保持0 min;以10 ℃/min速度升温至220 ℃,保持5 min;总分析时间为17 min。载气为氦气,恒定流速为1.0 mL/min。
质谱条件:电离方式:EI;扫描类型SIM扫描;电离能量:70 eV;离子源温度230 ℃;MS四级杆温度150 ℃;阈值100;扫描/s为2.67;扫描质量数50~500 amu。
根据7个不同浓度愈创木酚类标准溶液对应的气相色谱图,找到相对应色谱峰面积,作出色谱峰面积-浓度标准曲线。已知被测样品气相色谱图中愈创木酚类色谱峰面积,根据对应标准曲线线性方程计算出处理后的样品中愈创木酚类的浓度。
1.3.3 菌种的分子生物学鉴定[13]
对高产愈创木酚类物质的菌株进行鉴定。
菌体制备和裂解:在酒精灯火焰旁取培养基上的菌株于研钵,液氮研磨;将研磨好的菌至1.5 mL离心管中,标记菌名称,加入0.6 mL TE(pH 8.0),用枪头吸打均匀,使菌体充分悬浮;加入250 μL 10% SDS,轻轻倒转混匀;加入3 μL蛋白酶K(20 ng/μL),轻轻混匀,37 ℃水浴1 h;
DNA抽提:加入150 μL 5 mol/L NaCl,轻轻混匀;加入150 μL 2% CTAB,轻轻混匀,65 ℃水浴20 min;12 000 r/min常温离心20 min;
DNA沉淀:小心吸取上清至新的1.5 mL离心管,加入等体积异丙醇,充分混匀,室温放置30 min,12 000 r/min,4 ℃离心10 min;吸掉上清,在吸水纸上空干液体,加750 μL 70%乙醇,轻弹管壁,使沉淀悬浮并反复颠倒几次,12 000 r/min,4 ℃离心2 min;每管加入30 μL纯化水溶解沉淀(水中加Rnase,终浓度10 ng/μL),用手轻弹管壁,4 ℃溶解过夜;DNA电泳检测;PCR扩增。
16 s 引物序列:27F:AGAGTTTGATCMTGGCTCAG;1492R:TACGGYTACCTTGTTACGACT。
PCR反应体系(30 μL):H2O 17.8 μL;Buffer 3 μL,d NTP 2 μL,Primer1 3 μL,Primer2 3 μL,DNA模板1 μL,酶0.2 μL。

PCR产物电泳鉴定,上机测序,输出峰图。
1.3.4 菌种耐受性分析[9]
耐酒精能力测定:制备初始酒精浓度分别为0、4、8、10、12、14%vol的液体培养基,将平板纯化后的各单菌种按2%的接种量接到各培养基中,于37 ℃、160 r/min培养24 h,然后于600 nm分别测定吸光度,每个样品测3次取平均值。
耐酸性能力测定:制备初始pH值分别为3.0、3.5、4.0、4.5、5.0、5.5的液体培养基,将平板纯化后的各单菌种按2%的接种量接到各培养基中,于37 ℃、160 r/min培养24 h,然后于600 nm分别测定吸光度,每个样品测3次取平均值。
耐糖性能力测定:制备初始葡萄糖质量分数分别为5%、10%、15%、20%、30%的液体培养基,将平板纯化后的各单菌种按2%的接种量接到各培养基中,于37 ℃、160 r/min培养24 h,然后于600 nm分别测定吸光度,每个样品测3次取平均值。
2 结果与分析
2.1 菌种的初步分离纯化
通过对窖泥稀释涂布、平板划线纯化、镜检共初步分离得到3株酵母菌,14株细菌,细菌分别编号为B-1、B-2、B-3、B-4、B-5、B-6、B-7、B-8、B-9、B-10、B-11、B-12、B-13、B-14。14株菌镜检图见图1,菌落形态及显微形态见表1。

图1 14株菌镜检图(10×100)
Fig.1 Microscopic examination of 14 strains (10×100)
表1菌落形态及显微形态
Table1Colonymorphologyandmicroscopicmorphology

菌株菌落形态显微形态B-1不透明、表面干燥、边缘整齐规则、扁平杆状,芽孢杆菌,革兰氏阳性菌B-2半透明、表面光滑湿润、边缘整齐规则、脐状杆状,芽孢杆菌,革兰氏阳性菌B-3淡黄色、不透明、表面光滑湿润、圆形、边缘整齐规则、扁平杆状,芽孢杆菌,革兰氏阳性菌B-4乳白色、不透明、边缘不整齐、表面干燥、隆起杆状,芽孢杆菌,革兰氏阳性菌B-5乳白色、半透明、边缘不整齐、表面干燥、低凸起杆状,芽孢杆菌,革兰氏阳性菌B-6透明、边缘整齐规则、表面干燥、扁平杆状,革兰氏阴性菌B-7半透明、颗粒状不规则、表面黏稠湿润、扁平杆状,芽孢杆菌,革兰氏阴性菌B-8半透明、边缘齿状规则、表面黏稠湿润、隆起杆状,芽孢杆菌,革兰氏阳性菌B-9透明、边缘整齐规则、表面干燥、草帽状杆状,芽孢杆菌,革兰氏阳性菌B-10半透明、边缘波浪状不规则、表面湿润、扁平杆状,革兰氏阳性菌B-11透明、边缘整齐不规则、表面湿润、隆起杆状,革兰氏阳性菌B-12圆形、不透明、边缘整齐、表面干燥、隆起杆状,芽孢杆菌,革兰氏阳性菌B-13圆形、透明、边缘整齐、表面湿润、扁平杆状,革兰氏阳性菌B-14微黄色、边缘整齐不规则、表面湿润黏稠、隆起杆状,革兰氏阳性菌
2.2 高产愈创木酚类物质功能菌的筛选
对初步分离得到的14株菌进行单菌发酵。通过GC-MS分别对不同浓度混标和样品进行测定,得出3种愈创木酚类物质的标准曲线(见图2),3种愈创木酚类物质的SIM参数见表2,3种愈创木酚类物质标准曲线见表3,14株菌单菌发酵样品中愈创木酚类物质含量见表4,部分菌株单菌发酵色谱图见图3、图4。
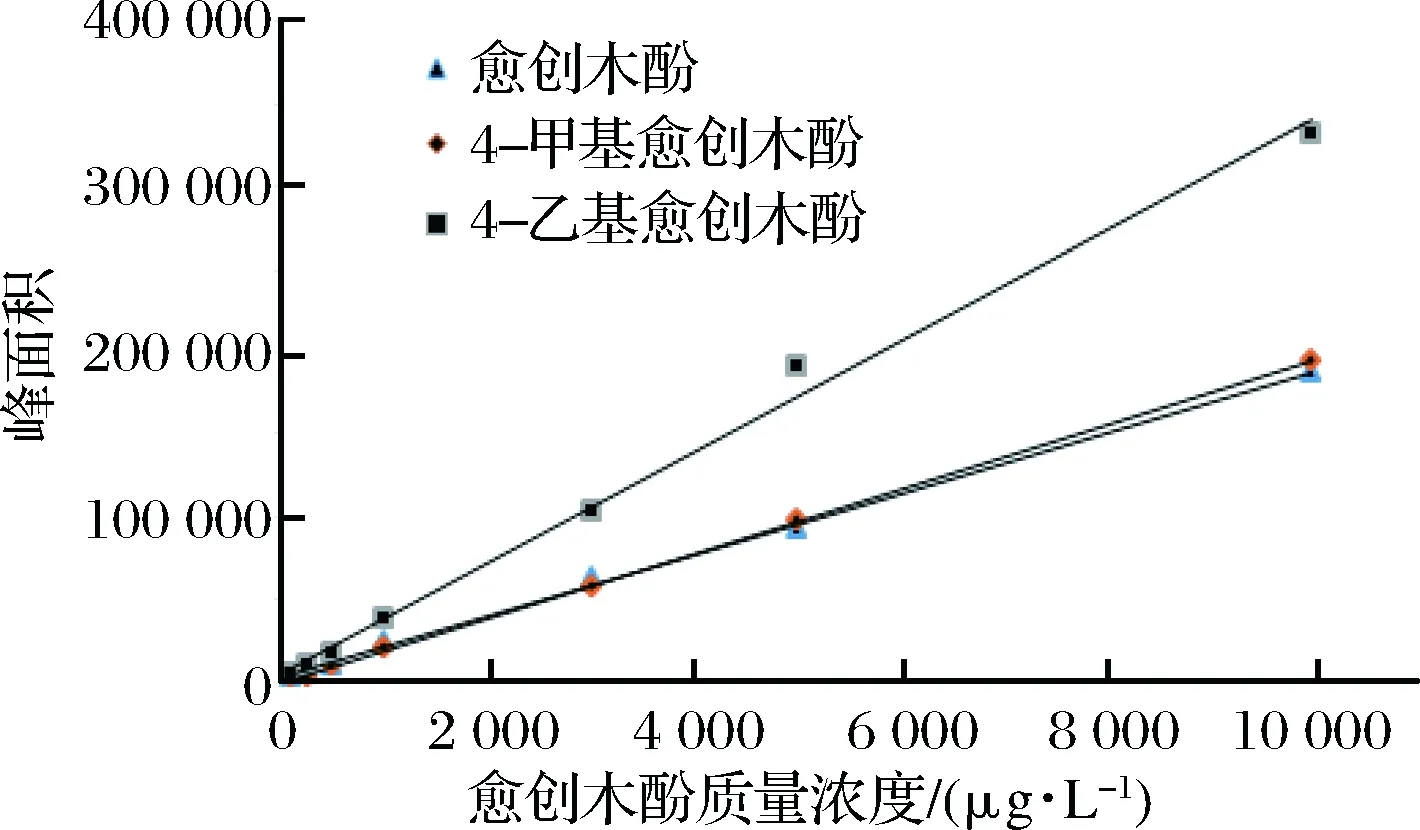
图2 三种愈创木酚类物质色谱峰面积-浓度标准曲线图
Fig.2 Chromatographic peak area-concentration
standard curve of three guaiacols
表23种愈创木酚类物质的SIM参数
Table2SIMparametersofthreeguaiacols

序号保留时间名称定性、定量离子18.420愈创木酚81.0、109.0、124.029.2404-甲基愈创木酚95.0、123.0、138.039.8694-乙基愈创木酚122.0、137.0、152.0

表3 3种愈创木酚类物质标准曲线表Table 3 Standard curve of three guaiacols
表414株菌发酵液中愈创木酚类物质含量单位:μg/L
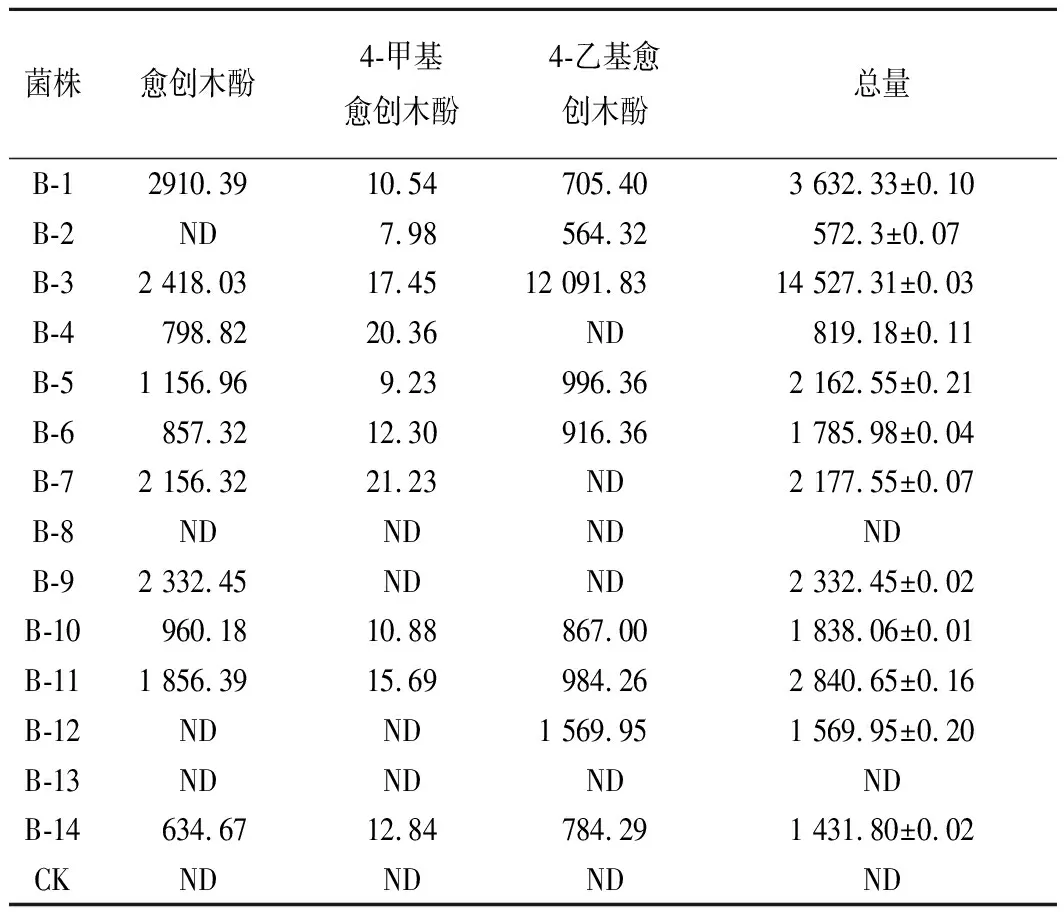
Table 4 Contents of guaiacols in the fermentation brothof 4 strains
注:愈创木酚类物质含量总量为平均值±标准偏差(n=3)。
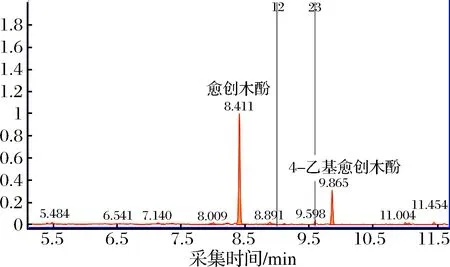
图3 B-1单菌发酵气相色谱图
Fig.3 Gas chromatogram of B-1 bran single bacteria
fermentation

图4 B-3单菌发酵气相色谱图
Fig.4 Gas chromatogram of B-3 bran single fermentation
由表2可以看出,愈创木酚、4-甲基愈创木酚、4-乙基愈创木酚的保留时间分别为8.420、9.240、9.869,由表3可以看出3种愈创木酚类物质标准样品的线性相关系数均在0.99以上,可以用于准确定量,根据线性方程可分别计算出各样品中对应愈创木酚类物质的含量。表4可以看出菌株B-8、B-13未检出愈创木酚类物质,菌株B-1发酵液中愈创木酚类物质含量总量为3 632.33μg/L,菌株B-3发酵液中愈创木酚类物质含量总量为14 527.31μg/L,高于另外12株菌发酵液中愈创木酚类物质含量总量,同时空白组未检出愈创木酚类物质,所以选择菌株B-1、B-3进行分子生物学鉴定。王少磊等[7]从中高温大曲中筛选到1株产4-乙基愈创木酚的菌株,经鉴定为Bacillusamyloliquefaciens,产量为32.89 μg/g。
2.3 菌种分子生物学鉴定
提取菌株B-1、B-3基因组DNA,然后以基因组DNA为模板经PCR扩增出16S rDNA序列,其琼脂糖凝胶电泳检测图见图5。

图5 菌种基因组DNA PCR产物电泳图
Fig.5 Electrophoresis map of strain genomic DNA PCR
products
将菌株B-1的16S rDNA(长度1 458 bp)序列输入美国国家生物技术信息中心(NCBI)数据库中Nucleotide BLAST与GenBank数据库中同源性最高的已知分类菌株序列进行比较,菌株B-1与Bacillusamyloliquefaciens(KP686226.1)同源性最高为99%,因此可以鉴定菌株B-1为Bacillusamyloliquefaciens[14]。
将菌株B-3的16S rDNA(长度1 416 bp)序列输入美国国家生物技术信息中心(NCBI)数据库中Nucleotide BLAST与GenBank数据库中同源性最高的已知分类菌株序列进行比较,菌株B-3与Delftiasp.X-a12(JX997845.1)同源性最高为99%,因此可以鉴定菌株B-3为Delftiasp.X-a12[15]。
2.4 菌种耐受性分析
2.4.1 耐酒精能力测定
菌株B-1、B-3耐酒精能力测定见图6、图7。
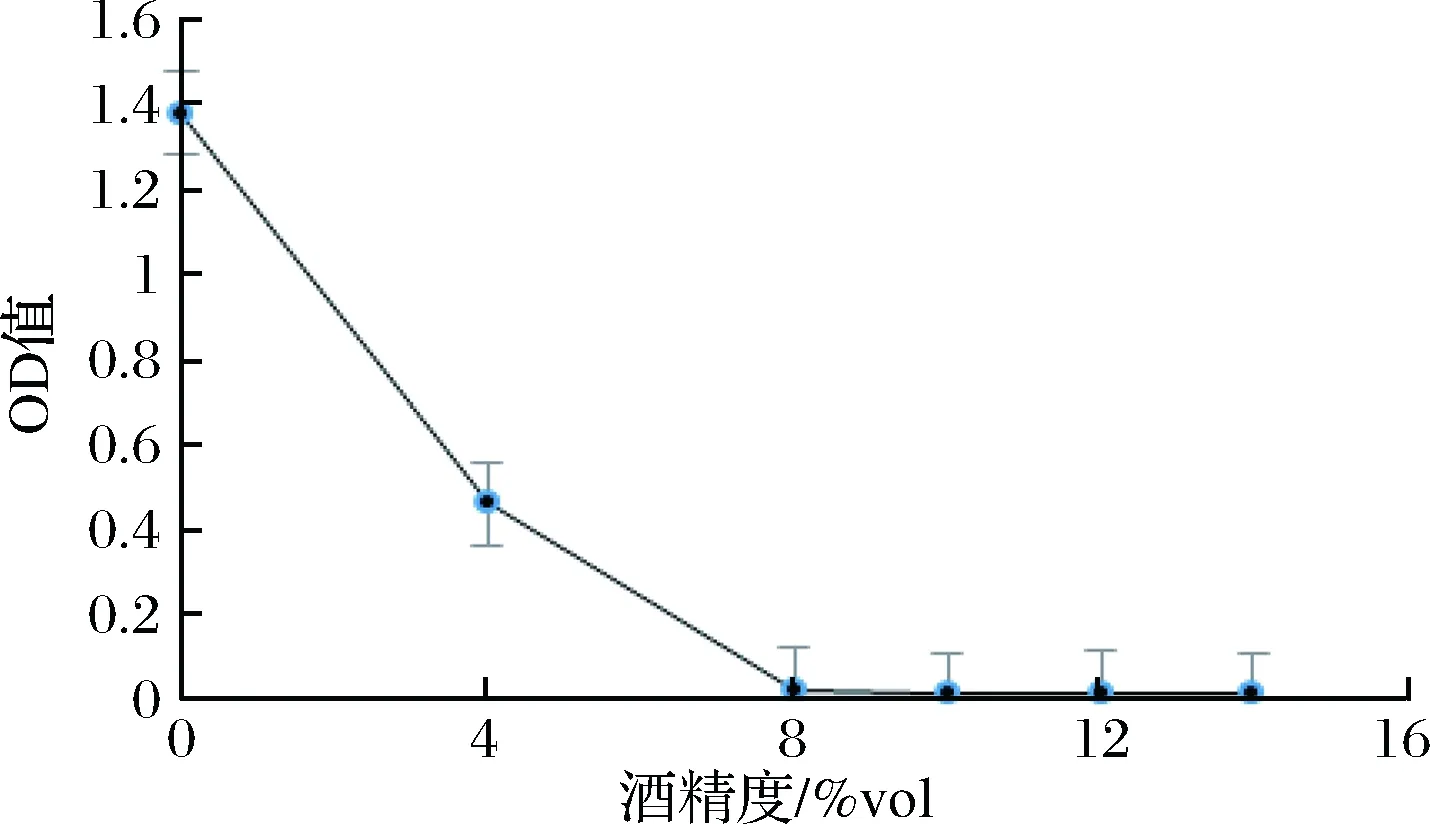
图6 B-1耐酒精能力测定
Fig.6 B-1 determination of alcohol resistance

图7 B-3耐酒精能力测定
Fig.7 B-3 determination of alcohol resistance
通过对筛选到的高产愈创木酚类物质菌株B-1、B-3进行耐酒精能力测定,由图6、图7可以看出,随着酒精浓度的增加,OD值均呈不断下降趋势,当酒精度达8%vol时,基本上不能生长,OD值接近0,此时菌株生长受到明显抑制,当酒精度为4%vol时,菌株B-1 OD值为0.462,菌株B-3 OD值为1.659,说明菌株B-1、B-3耐4%vol酒精度能力较强,但B-3比B-1更耐4%vol酒精度。
2.4.2 耐酸能力测定
菌株B-1、B-3耐酸能力测定图见图8、图9。

图8 B-1耐酸能力侧定
Fig.8 B-1 acid resistance ability side

图9 B-3耐酸能力测定
Fig.9 B-3 acid resistance test
通过对筛选到的高产愈创木酚类物质菌株B-1、B-3进行耐酸能力测定,由图8、图9可以看出,随着pH值的不断增加,OD值均呈不断上升趋势,当pH值小于4时,菌株生长均收到明显的抑制,OD值接近于0。当pH为4.5时,基本上均能正常生长,B-1 OD值为1.345,B-3 OD值为1.815,说明B-3耐酸能力相对较强。
2.4.3 耐糖能力测定
菌株B-1、B-3耐糖能力测定见图10、图11。
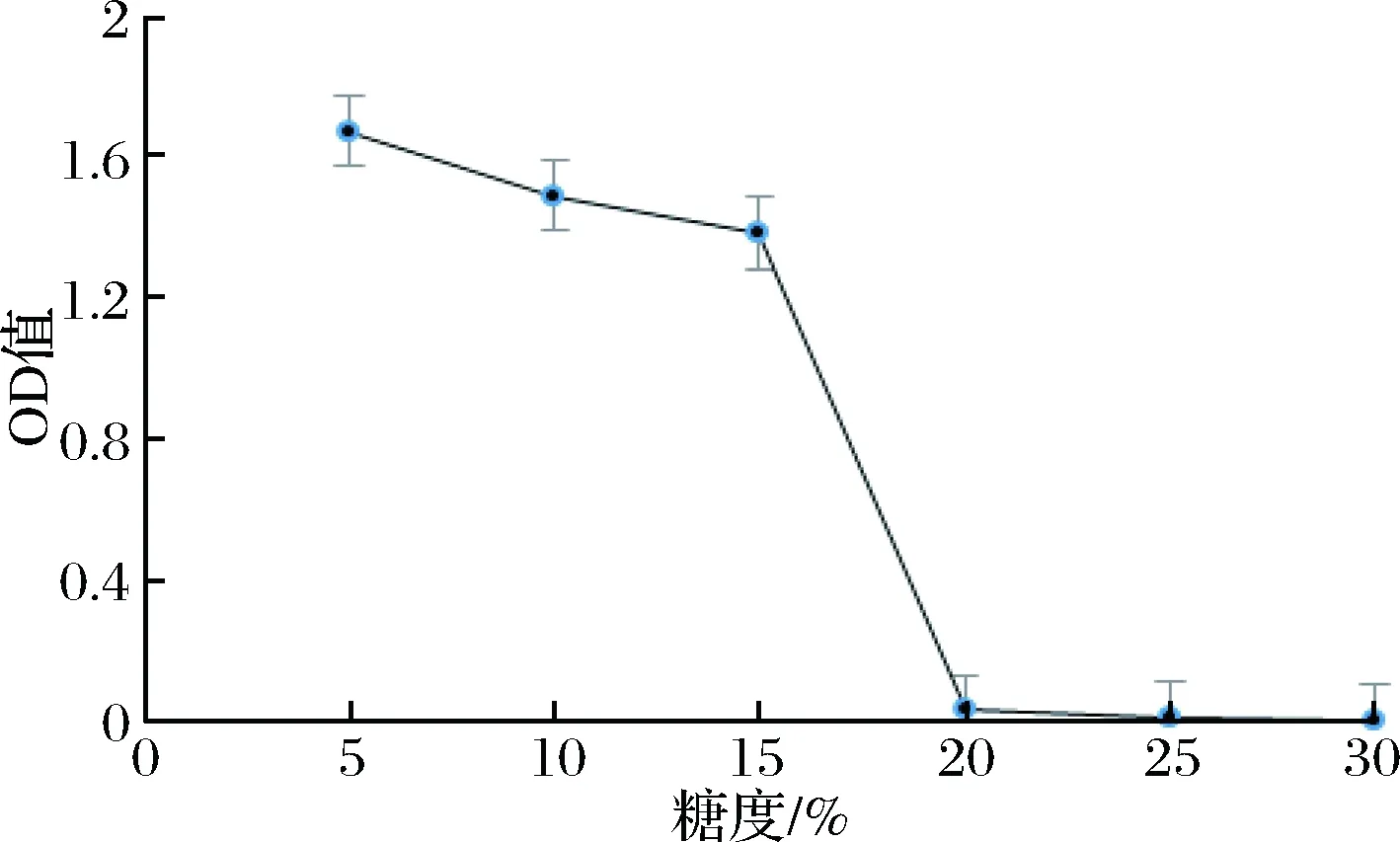
图10 B-1耐糖能力测定
Fig.10 B-1 sugar tolerance test

图11 B-3耐糖能力测定
Fig.11 B-3 sugar tolerance test
通过对筛选到的高产愈创木酚类物质菌株B-1、B-3进行耐糖能力测定,由图10、图11可以看出,随着糖度的不断增加,菌株B-3 OD值呈先上升后下降趋势,B-1 OD值呈不断下降趋势。原因可能为随着糖度的增加,B-3利用糖的能力较强,在糖度为15%时为菌株提供了充足的碳源,菌株可以良好的生长,当糖度达20%时由于受高渗透压的影响菌株生长受到抑制,超过了菌株所需要碳源的量,所以又呈下降趋势。而B-1在糖度15%以下时利用碳源的能力相对较弱,受高糖渗透压的影响较大,当糖度为20%时,OD值基本接近于0。
3 结论
白酒作为我国的国酒,历史悠久,源远流长,不仅因为能起到助兴的作用,更重要的是具有重要的保健功效。愈创木酚类物质作为白酒中重要的健康因子之一,近年来越来越受到科研工作者的关注。本试验以窖泥为样品,通过稀释涂布、平板划线纯化、镜检、单菌发酵筛选出高产愈创木酚类物质的功能菌株,然后进行菌种鉴定,最后进行菌种的耐受性分析,最终筛选出2株高产愈创木酚类物质的功能菌B-1、B-3,分别为Bacillusamyloliquefaciens、Delftiasp.X-a12,总产量分别为3632.33和14527.31μg/L,耐受性分析结果为菌株B-1、B-3均耐4%vol酒精度、pH 4.5、15%糖度,为细菌麸曲制作提供菌株和条件,以期为白酒生产实践提供参考,提高白酒中愈创木酚类物质的含量,提高黄鹤楼浓香型白酒的营养健康保健的功效。蔡瑞[11]报道愈创木酚含量过高会产生一种类似于苯酚类化合物的“药味”和“消毒水味”,给酒的香气带来不愉快的气味,所以白酒中愈创木酚类物质含
量应恰到好处,不应要求越高越好,含量过高反而会破坏酒的风味上的平衡协调,产生欠缺,需要考虑的是如何使其在白酒中保持一个适当的含量,这也是以后研究的重点。
