鲁氏不动杆菌Acinetobacter lwoffii UL产类胡萝卜素的纯化与鉴定及其抗氧化活性检测
2019-03-01盛冉孙志高张震方明于奉生张群琳李甜
盛冉,孙志高,张震,方明,于奉生,张群琳,李甜
(西南大学 柑桔研究所,重庆,400712)
类胡萝卜素是普遍存在于自然界的萜类化合物,在动物和人体内可发挥抗氧化,调节免疫系统、生长因子和细胞内信号通路,调节细胞分化、细胞周期和细胞凋亡,还具有抵抗紫外辐射功能,也是维生素A的前体物质[1]。由于人体自身不能合成类胡萝卜素,故必须从食物中获取。目前,已有600多种类胡萝卜素被发现,主要分为两类:一是叶黄素类,具有含氧的功能性基团,如虾青素,叶黄素和玉米黄素等;二是胡萝卜素类,由无官能团的烃链构成,如β-胡萝卜素和番茄红素等。目前,国内外广泛采用藻类发酵生产类胡萝卜素,且其他微生物发酵类胡萝卜素极具发展潜力,如三孢布拉氏霉发酵番茄红素和β-胡萝卜素[2]、粘红酵母发酵虾青素[3]等。但因微生物源类胡萝卜素存在纯度低、杂质多等缺陷,所以其纯化必不可少[4]。
鲁氏不动杆菌(Acinetobacterlwoffii)又称洛菲不动杆菌,是革兰氏阴性、好氧、杆菌,广泛分布于正常人体的皮肤和口咽,占人体正常菌群的20%~25%。不动杆菌不需要复杂的营养成分,能够以多种物质作为单一的能量来源,因此,不动杆菌广泛分布于土壤、水体以及干燥的环境中[2-5]。鲁氏不动杆菌发酵产类胡萝卜素鲜有报道,因此探明其所产类胡萝卜素种类极有必要性。
目前,微生物源类胡萝卜素的纯化主要通过薄层层析(TLC)、硅胶柱层析、制备柱色谱等手段分离纯化类胡萝卜素各组分。依据类胡萝卜素的结构特性采用紫外-可见光谱扫描、高效液相色谱(HPLC)、高效液相色谱-质谱联用、傅里叶红外光谱扫描、核磁共振氢谱以及核磁共振碳谱等方法进行鉴定。
现代许多研究已证实癌症、衰老和大多数疾病的产生都与体内过量自由基的产生相关,所以抗氧化的研究具有很大潜力[5-6]。抗氧化研究有体内和体外两大类方法,通常广泛采用的是体外抗氧化测定方法[7-8]。本试验先用TLC和柱层析对类胡萝卜素进行纯化,再将纯化后的色素利用HPLC、1H-NMR、FRIT和Q-TOF-HPLC-MS-MS进行鉴定。类胡萝卜素生理活性的发挥依赖其抗氧化活性,故本试验采用ABTS、DPPH、FRAP三种方法对色素粗提液和纯化后的组分1、组分2进行了抗氧化活性的评价和对比。以期为鲁氏不动杆菌(AcinetobacterlwoffiiUL)类胡萝卜素在食品、医药及化工产业的应用提供一定的指导。
1 材料与方法
1.1 材料
鲁氏不动杆菌UL(AcinetobacterlwoffiiUL),保藏于中国典型培养物保藏中心,保藏号CCTCC M 2017776。
R2A液体培养基:酵母粉0.5 g、胰蛋白胨0.5 g、鱼蛋白胨0.5 g、葡萄糖0.5 g、可溶性淀粉0.5 g、K2HPO40.3 g、MgSO4·7H2O 0.05 g、丙酮酸钠0.3 g,加蒸馏水至1 L,调节pH值至6.5。
1.2 试剂与仪器
1.2.1 试验试剂
柱层析硅胶200~300目,青岛海洋化工厂;薄层层析板F254,德国默克;DPPH、TPTZ、ABTS、乙腈,色谱纯,Sigma公司;甲醇、乙醇、丙酮、乙酸乙酯、石油醚(沸程60~90℃)、正庚烷、二氯甲烷、醋酸,纯度均为分析纯,购自重庆川东化工(集团)有限公司;溴化钾、过硫酸钾、醋酸钠,成都市科龙化工试剂厂。酵母粉、胰蛋白胨、鱼蛋白胨,北京奥博星生物技术有限责任公司;可溶性淀粉、K2HPO4、MgSO4·7H2O,成都市科龙化工试剂厂;丙酮酸钠,Bio Basic Inc。
1.2.2 试验仪器
台式低速大容量离心机(L-550),长沙湘仪离心机仪器有限公司;恒温培养箱(SPX-150-Z),上海博泰实验设备有限公司;超净工作台(SW-CJ-1F),苏泰集团苏州安泰空气技术有限公司;双光束紫外可见分光光度计(TU-1901),北京普析通用仪器有限责任公司;电子分析天平(FAZO04B),上海精科仪器有限公司;立式压力蒸汽灭菌锅(YXQ-LS-50S Ⅱ),上海博迅实业有限公司医疗设备厂;旋转蒸发仪(R1001-VN),郑州长城科工贸有限公司;旋转蒸发器(SY-5000),上海亚荣生化仪器厂;循环水式多用真空泵(SHB-Ⅲ),郑州长城科工贸有限公司;恒流泵(BT100-2J),保定兰格;电脑全自动部分收集器(DBS-100),上海沪西仪器分析厂有限公司;核磁共振波谱仪(AVANCEⅢ-400MHz),瑞士布鲁克;傅里叶光谱扫描仪(Prestige-21),日本岛津公司;高效液相色谱仪(UltiMate3000),戴安中国有限公司;液相色谱质谱联用仪(H-CLASS,G2XS),Waters;氮吹仪(TTL-DCI),北京同泰联科技发展有限公司。
1.3 试验方法
1.3.1 类胡萝卜素发酵液的制备
将0.4%种子发酵液接种于100 mL R2A培养基中,调pH值至6.5、摇床转速100 r/min、温度28 ℃,培养96 h。
1.3.2 类胡萝卜素的提取
采用有机溶剂提取法,1 L发酵液于8 000 r/min离心10 min后搜集菌体沉淀。以90%乙醇为提取剂、料液比7∶50(g∶mL)、室温下提取30 min后,8 000 r/min离心10 min,以获得上清色素提取液。随后采用减压真空法将红色素在45 ℃的水浴中浓缩至干,再将色素复溶于4 mL甲醇溶液中,以8 000 r/min离心10 min以近一步除去菌体,从而得到色素粗提液。
1.3.3 类胡萝卜素的纯化
1.3.3.1 薄层层析(TLC)
将色素粗提液点样于薄层层析板上,后将其放置于装有展开剂的层析缸中进行展开,当展开剂展开至距层析板2 cm处取出,此时样品组分会因移动速度不同而发生分离[9]。由于样品本身有颜色故无需喷显色剂可直接通过颜色判断分离情况,最终用比移值Rf来表示被分离物质在薄层板上的位置,Rf=物质本身移动距离/溶剂前沿移动距离。展开剂体系的选择如表1所示。
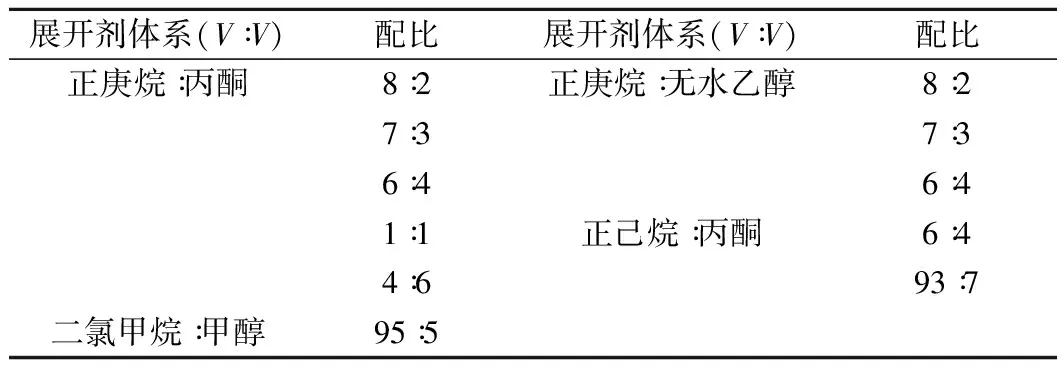
表1 类胡萝卜素粗提液TLC展开剂的选择Table 1 Selection of TLC expansion agent for carotenoidcrude extract
1.3.3.2 柱层析
称取50 g柱层析硅胶于110 ℃活化2 h,加入展开体系中极性较低的溶剂,体积约为干硅胶体积的1倍,用玻璃棒充分搅拌后浸泡沉淀12 h,再用玻璃棒混合成硅胶匀浆装入60×3 cm的层析柱中,利用层析系统中低极性溶剂平衡柱子,待柱中硅胶沉淀紧实、且无气泡后再用层析溶剂平衡柱子1~2个体积,最后进行上样(4 mL类胡萝卜素粗提液),流速1 mL/min,以自动接收器每4 min接收1管,最后以颜色区别各洗脱液,以组分管数为X、吸光度值OD478为Y轴作图,以及对含色素管进行TLC检验来判断其是否良好分开[10]。依据TLC所选展开剂进行柱层析洗脱剂的选择,洗脱剂试验体系如表2所示。
1.3.4 类胡萝卜素的鉴定
1.3.4.1 类胡萝卜素溶解性
取少量被纯化后氮吹干的类胡萝卜素固体,分别溶于1 mL的水、甲醇、乙醇、丙酮、正庚烷、石油醚、乙酸乙酯中,观察其溶解情况。

表2 类胡萝卜素粗提液柱层析洗脱剂的选择Table 2 Selection of column chromatograph eluent forcarotenoid crude extract
1.3.4.2 HPLC
经过预实验确定HPLC条件为:PDA检测器、反向C18柱(4.6 mm×250 mm,5 μm)、流动相为A(甲醇)∶B(水)=95∶5(V∶V);检测波长478 nm;流速1 mL/min;柱温30 ℃;进样量20 μL。
1.3.4.3 傅里叶红外光谱扫描
将KBr与氮吹干的10 mg样品进行混合压片,并以KBr空白压片作为参比进行傅里叶红外光谱扫描。
1.3.4.4 核磁共振氢谱
称取5 mg样品溶解于CDCL3,并立即转移至核磁管中,将核磁共振管擦拭干净,置于核磁共振波谱仪中进行测定。
1.3.4.5 Q-TOF-HPLC-MS-MS
色谱仪WATERS UPLC-Q-TOF-MS,检测器ACQUITY的ESI的正离子模式,分析柱:ACQUITY BEH C18柱(100 mm×2.1 mm,1.7 μm),流动相A水(0.1%甲酸)∶B乙腈,梯度洗脱,0~0.5 min 40%B、0.5~3.0 min 50%B、3~4.5 min 55%B、4.5~8.5 min 70%B、8.5~13.8 min 100%B,进样量1 μL,流速0.2 mL/min,毛细管电压3 000 V,锥孔电压40 V,脱溶剂气温度400 ℃,离子源温度120 ℃,脱溶剂气流速800 L/h,锥孔气体流量50 L/h,质量范围m/z100~1 000。
1.3.5 类胡萝卜素抗氧化活性检测
1.3.5.1 ABTS法
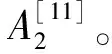

1.3.5.2 FRAP法
取0.1 mL 20 μg/mL的色素-80%甲醇溶液加入4.9 mL FRAP试剂,避光反应10 min后在波长593 nm测定吸光度值,空白加0.1 mL 80%甲醇替代提取液,吸光度值越大表示抗氧化能力越强。FRAP溶液配制:0.1 mol/L醋酸-醋酸钠缓冲溶液(pH=3.6)∶10 mmol/L TPTZ(溶于40 mmol/L HCl)∶20 mmol/L FeCl3.6H2O=10∶1∶1(V∶V∶V)[11]。
1.3.5.3 DPPH法
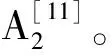
1.4 数据分析
采用Microsoft Office Excel 2013进行数据统计,将平行3次的实验结果以平均值±标准差的形式表示,以Origin 8.6专业函数绘图软件绘制实验结果。
2 结果与分析
2.1 类胡萝卜素的纯化
薄层层析(TLC)是根据相似相溶原理发展起来的色谱分离技术,通过某一物质的吸附、溶解或亲和性能的不同,随着展开剂的不断迁移混合物在不断吸附和分配等作用下而分离,是快速分离和定性分离少量物质的重要技术[12]。一般认为合适的TLC展开系统是被分离物质的Rf不宜过大或过小,且展开后可较好判断各成分的分离情况。
从表3可知,以正庚烷和丙酮为展开剂时效果较好,当配比为7∶3、6∶4、1∶1、4∶6时色素均可分离为2条条带,其中当配比为1∶1时Rf分别是0.428和0.500,更适宜作展开剂;当展开剂为正己烷∶丙酮=6∶4时,Rf分别是0.692和0.615,但2条色素带呈现拖尾现象,当其配比为3∶7时,Rf值过大不适合作为展开体系;二氯甲烷∶甲醇系统虽也有合适的Rf值,但条带变为黄色且极易消失。因此,综合选取正庚烷∶丙酮=1∶1为展开剂,Rf分别为0.428和0.500(如图1)。

表3 TCL展开剂筛选结果表Table 3 TCL expansion agent screening result
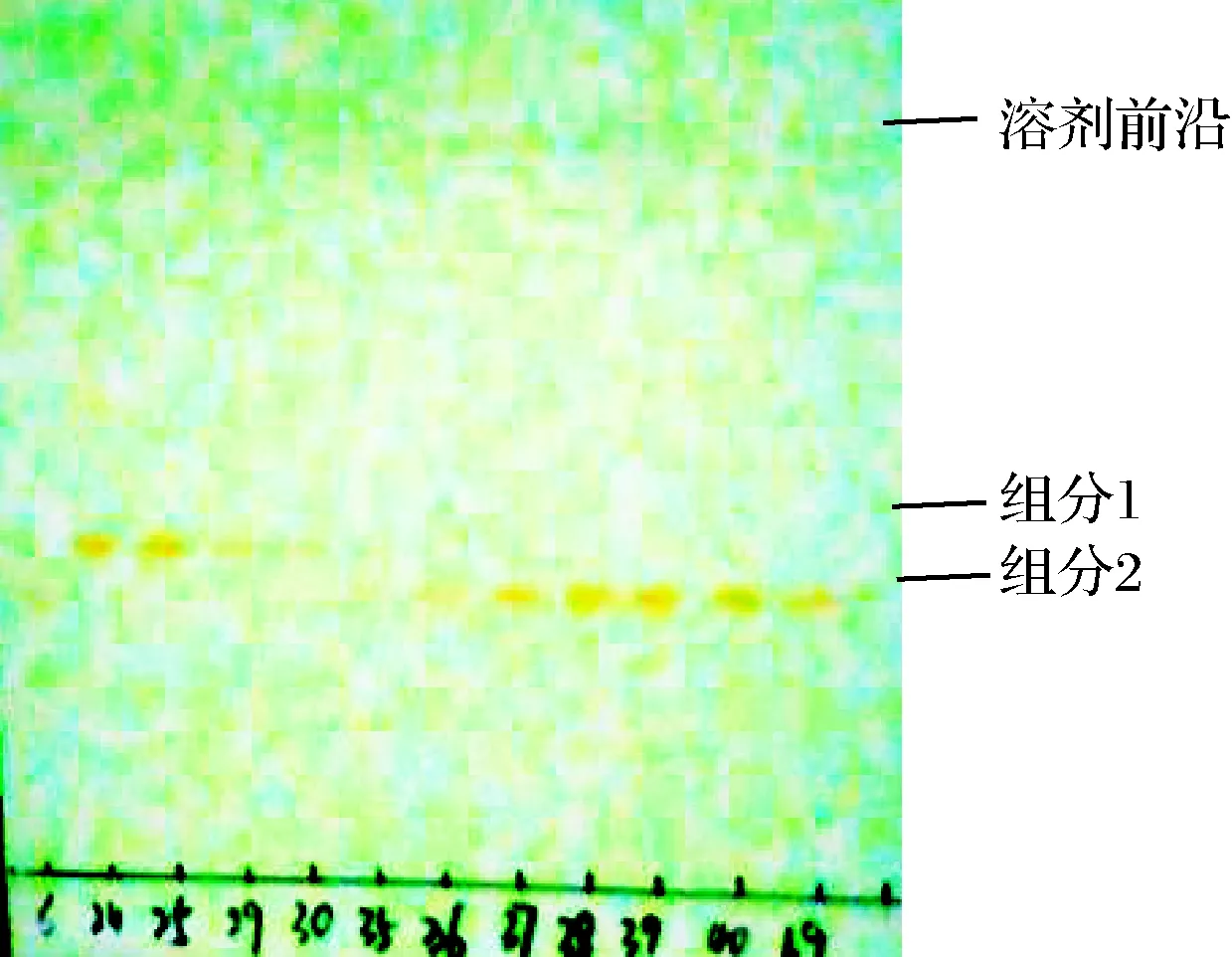
图1 TLC展开图
Fig.1 TLC expansion diagram
硅胶层析法是根据不同物质在硅胶上的吸附力不同而将其分离,一般情况下极性较大的物质易被硅胶吸附,极性较弱的物质不易被硅胶吸附,整个层析过程即是吸附、解吸、再吸附、再解吸过程[13]。柱层析的洗脱剂是依据薄层层析展开剂的配比和极性进行筛选,由表4可知,正庚烷∶丙酮=1∶1的体系可将类胡萝卜素分为2条条带,由图2可知色素形成2个峰,23~31管和36~53管,其中36~53管之间的色素含量多,在波长478 nm其吸光度值最大,可以达到1.0左右,经过TLC验证可以看出2种色素组分被良好地分开了(如图3)。
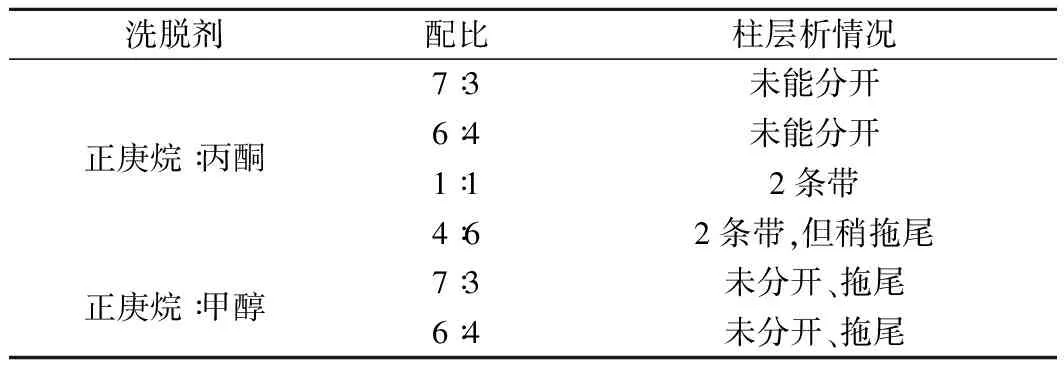
表4 类胡萝卜素柱层析洗脱剂筛选结果Table 4 Screening results of carotenoid columnchromatography eluant
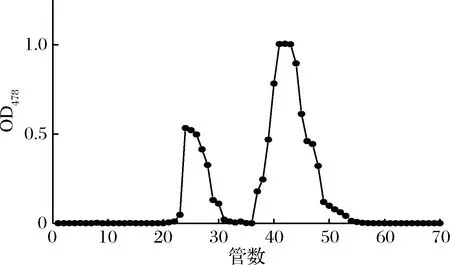
图2 类胡萝卜素柱层析洗脱液紫外-可见
光谱检测值
Fig.2 Carotenoid column chromatograph eluent UV
visible spectrum detection value
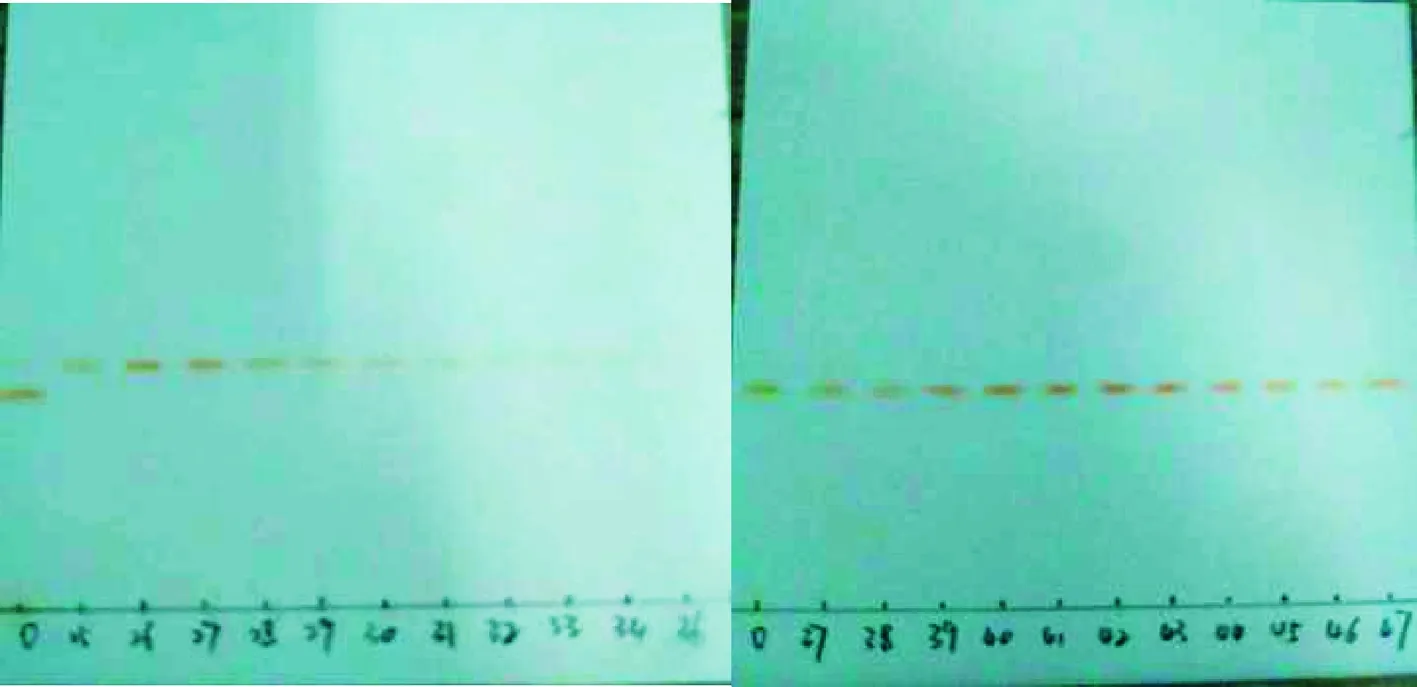
图3 柱层析后TLC展开图
Fig.3 TLC expansion after column chromatography
2.2 类胡萝卜素组分的鉴定
类胡萝卜素粗提液经纯化后获得2种组分,即组分1和组分2。由于组分1含量较少,因此只对组分2进行结构鉴定。
2.2.1 纯化后类胡萝卜素溶解性
从表5可知,该色素不溶于水、微溶于丙酮、甲醇、乙醇,易溶于正庚烷、石油醚、乙酸乙酯,表明该色素为脂溶性色素,且极性相对较小。这与黄水英报道的雨生红球藻中虾青素溶解性基本一致[14]。

表5 纯化后类胡萝卜素溶解性表Table 5 Purified carotenoid solubility
注:“-”表示不溶解;“+”表示易溶解。
2.2.2 纯化后类胡萝卜素HPLC检测
由图4可知,虽已对色素进行纯化处理,但类胡萝卜素中依旧至少存在4种成分,4种类胡萝卜素的极性相差不大,应该为结构类似的一类物质。造成这一现象的原因,一方面可能是几种极性和结构类似的物质构成了这一组分,另一方面可能是类胡萝卜素不稳定而产生的降解产物,类胡萝卜素分子中含有很长的不饱和双键,末端可能还存在不饱和的酮基或羟基,故分子较为活泼易氧化分解[15]。
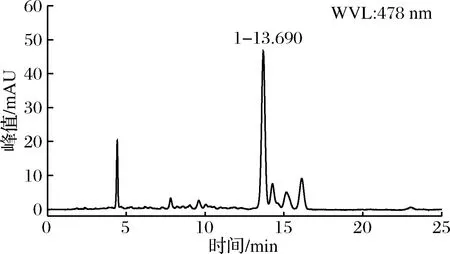
图4 纯化后类胡萝卜素的HPLC检测图
Fig.4 HPLC detection of carotenoid after purification
2.2.3 纯化后类胡萝卜素的傅里叶红外光谱扫描


图5 纯化后类胡萝卜素的傅里叶红外光谱扫描图
Fig.5 Fourier infrared spectrogram of carotenoid after purification
2.2.4 纯化后类胡萝卜素的核磁共振氢谱


图6 纯化后色素的核磁共振氢谱检测图
Fig.6 Nuclear magnetic resonance hydrogen spectrum of
purified pigment after purification
2.2.5 纯化后类胡萝卜素的UPLC-Q-TOF-MS-MS检测
依据UPLC-Q-TOF-MS的色谱图选取出峰较高、吸光度值为478 nm的色谱峰进行质谱分析。结果如图7所示。
由图7-A可知,其中一种成分(即成分1)的一级质谱MS出现了m/z615.583 1、309.299 5、308.300 1的特征离子,其中m/z615.583 1为基峰,推测m/z615.583 1离子为[M+Na]+的离子峰,即M为592,而没有看到其准分子离子峰m/z593[M+H]+。二级质谱MS-MS出现了m/z309.295 9、308.296 5等主要的离子碎片峰,m/z309.295 9离子峰来源可能是该物质裂解产生的C21H25O2·碎片,m/z308.300 1是其失去1个H而产生的碎片。由图7-B可知,另一种组分(即成分2)的基峰为m/z619.614 6[M+Na]+,即该物质的分子量M为596,m/z310.311 3为该物质裂解产生的C21H26O2·碎片。结合溶解性、最大吸收波长、FRIT和1H-NMR,可知组分2的物质中含有多烯长链、多个甲基和亚甲基、苯环、羰基等特征结构,查阅文献可知,图7-A物质的分子式可能是C40H48O4,可能为虾红素(astacen),其结构式如图8所示。图7-B的分子式为C40H52O4,可能为虾青素(astaxanthin),结构式如图9所示[16]。
据程红艳等[17]研究表明,采用反相高效液相色谱-电喷雾电离质谱法(RP-HPLC-DAD-ESI-MS)测定含氧类胡萝卜素叶黄素分子量和裂解规律时发现,其电喷雾一级质谱特征离子为m/z589、306,其中m/z589 为其基峰,根据质量数确定m/z589 离子是[M+Na-2H]+离子峰,而叶黄素分子离子峰m/z568[M]+信号十分微弱,没有看到准分子离子峰m/z569[M+H]+,说明采用电喷雾质谱分析叶黄素不易产生分子离子峰和准分子离子峰,易产生[M+Na-2H]+离子峰。另外,二级质谱特征离子确定m/z306([M+Na -C20H28O -H]+)峰为m/z589([M+Na-2H]+)离子峰的碎片峰。本试验所得的含氧类胡萝卜素在电喷雾电离质谱(ESI)下也基本符合RITA FRASSANITO所报道的虾青素裂解规律[16]和程红艳报道的叶黄素裂解规律[17]。
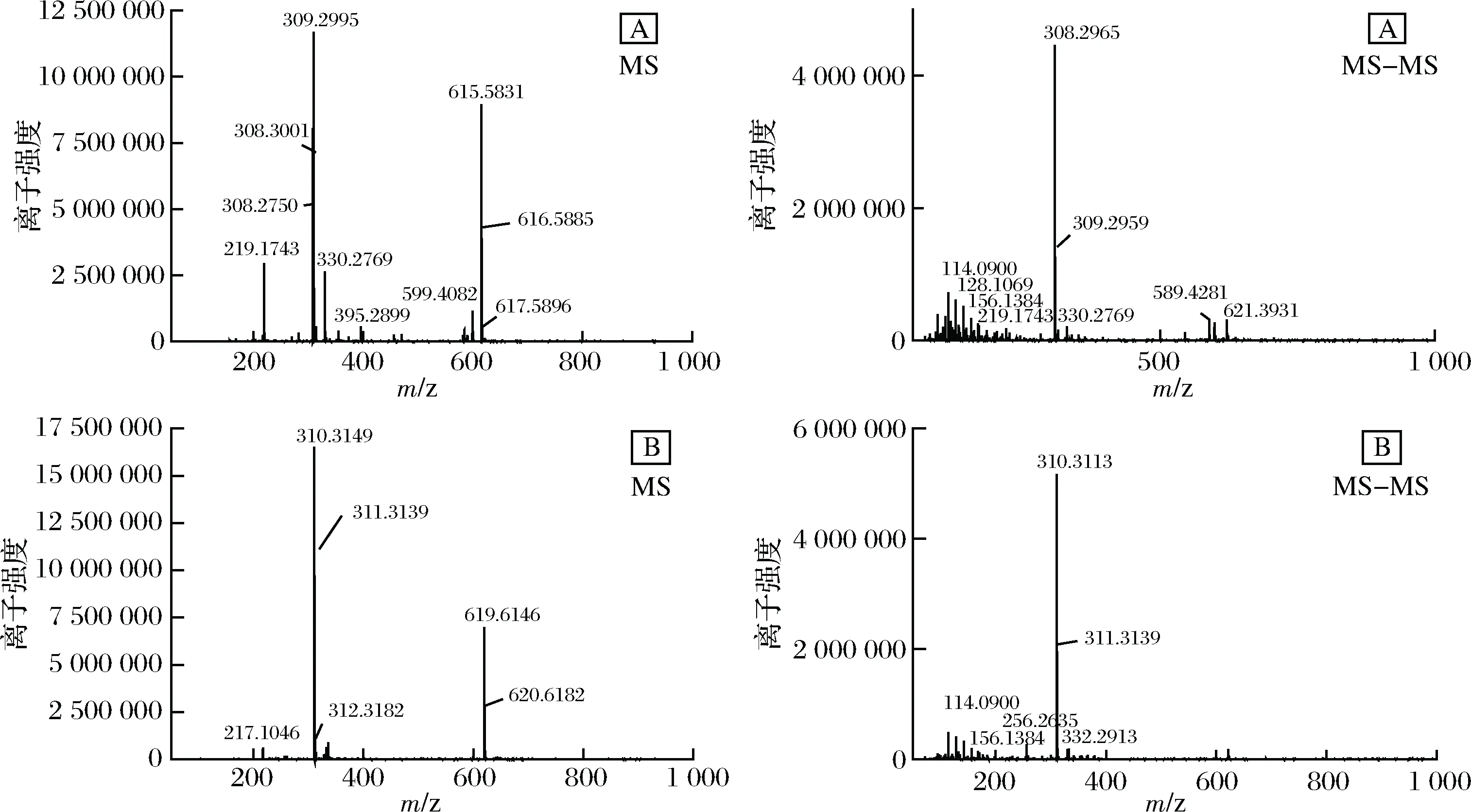
A-组分二中成分1;B-组分二中成分2图7 纯化后类胡萝卜素的UPLC-Q-TOF-MS-MS检测图Fig.7 UPLC-Q-TOF-MS-MS detection of carotenoids after purification

图8 Astacen的结构式
Fig.8 Structure of Astacen

图9 虾青素的结构式
Fig.9 Structure of astaxanthin
2.3 类胡萝卜素抗氧化活性的检测
体内抗氧化的研究即动物实验不仅昂贵、耗时,且不适合初期大量筛选,但体外抗氧化测定具有简单快速的特点而被广泛使用[11]。体外评价抗氧化活性时若仅用1种方法不具有代表性和说服力,而常常选用3种方法进行评价[18]。因此,本文选取ABTS(评价自由基清除率)、FRAP(评价总还原力)、DPPH(评价自由基清除率)3种方法进行色素抗氧化活性评价,ABTS和DPPH方法中吸光度值越小抗氧化活性越强,但FRAP法是吸光度值越大抗氧化活性越强。从表7可以看出类胡萝卜素粗提液以ABTS法和DPPH测定的吸光度值(0.300 5和1.174 0)均低于CK(0.627 0和1.324 5),自由基清除率分别为55.32%和11.36%,表明色素具有抗氧化活性;FRAP法检测色素粗提液的吸光度值(0.210 0)高于CK(0.085 0),也表明色素具有抗氧化活性。
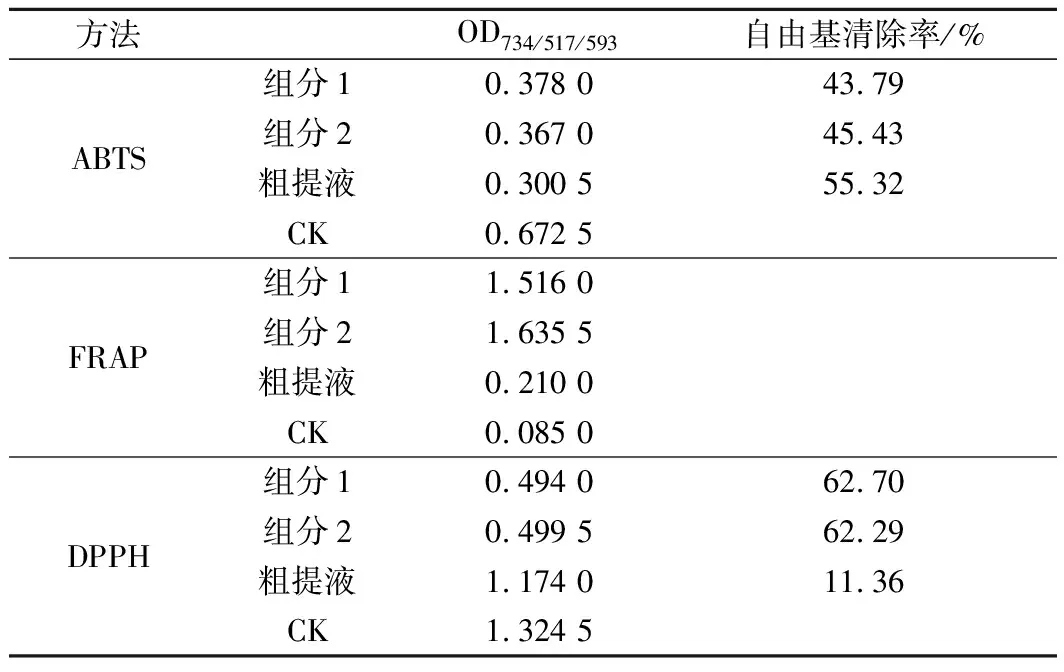
表7 类胡萝卜素抗氧化活性检测Table 7 Carotenoid antioxidant activity detection
因此。经过3种方法检测评价类胡萝卜素粗提液均具有抗氧化性。由表7可知,除ABTS法测定外,经纯化后的类胡萝卜素抗氧化活性显著提高,以FRAP法评价时,类胡萝卜素组分1抗氧化活性较类胡萝卜素为粗提液的7.23倍,类胡萝卜素组分2抗氧化活性为粗提液的7.79倍;以DPPH法评价时,类胡萝卜素组分1抗氧化活性为粗提液的5.52倍,类胡萝卜素组分2抗氧化活性为粗提液的5.48倍,表明经过柱层析纯化后类胡萝卜素的纯度大大提高,其抗氧化活性也显著提高。据报道,由于虾青素结构中存在很长的不饱和双键,末端还存在不饱和的酮基和羟基,因而具有较强的抗氧化活性[15]。
3 结论与讨论
本试验以鲁氏不动杆菌UL所产类胡萝卜素为原料,采用TLC和柱层析对类胡萝卜素粗提液进行纯化,试验得出TLC最佳展开条件为正庚烷∶丙酮=1∶1,得到2条红色条带,其Rf分别为0.428和0.500;柱层析最佳的洗脱条件为流速1 mL/min、上样量4 mL、洗脱剂正庚烷∶丙酮=1∶1、每隔4 min接收1管,该体系可将类胡萝卜素分为2种组分,分别为组分1和组分2。将纯化后的组分2进行溶解性、HPLC、FRIT、1H-NMR以及UPLC-Q-TOF-MS-MS等检测和分析,结果表明组分2中含有多烯长链、多个甲基和亚甲基、苯环、羰基等类胡萝卜素特征结构,查阅文献推断其是虾红素(astacen),分子式C40H48O4,分子量592,以及含量相对较少的虾青素,分子式C40H52O4,分子量596。试验采用ABTS、FRAP、DPPH 3种方法评价了类胡萝卜素粗提液和纯化后类胡萝卜素组分1、组分2的抗氧化活性,试验结果表明类胡萝卜素粗提液具有抗氧化性,纯化后类胡萝卜素的抗氧化活性显著提高。
本试验虽已对类胡萝卜素进行了纯化,但纯度还能进一步提高。下一步研究可采用制备柱色谱对类胡萝卜素进行纯化,以获得纯度更高的类胡萝卜素。类胡萝卜素具有极高的经济价值,若能实现其工业化生产,不仅能为类胡萝卜素的应用提供新的思路和前提条件,而且能够增加类胡萝卜素的应用价值,更好地创造经济效益。因此,认为鲁氏不动杆菌(AcinetobacterlwoffiiUL)产类胡萝卜素能否或如何应用于工业化生产亟待研究。
