Streptococcus thermophilus S10复合Lactobacillus plantarum P-8在发酵豆乳中的应用
2019-03-01郭帅韩之皓黄天郑岩王月娇白梅王记成孙天松张和平
郭帅,韩之皓,黄天,郑岩,王月娇,白梅,王记成,孙天松,张和平*
1 (乳品生物技术与工程教育部重点实验室(内蒙古农业大学),内蒙古 呼和浩特,010018)2 (农业农村部奶制品加工重点实验室(内蒙古农业大学),内蒙古 呼和浩特,010018)
大豆中含有丰富的蛋白质、多不饱和脂肪酸、膳食纤维、矿物质和维生素[1],在《中国居民膳食指南(2016版)》中建议经常食用大豆制品[2]。发酵豆乳是豆制品的重要组成部分,是在豆浆基础上接种乳酸菌发酵而成的植物性发酵食品。经乳酸菌发酵作用,发酵豆乳可提高脂质代谢,不会引起肥胖[3];发酵后的大豆蛋白质更容易消化吸收,且能提高机体免疫力并有效降低血清中总胆固醇含量[4];被分解的大豆低聚糖能促进益生菌增殖,保持肠道健康[5];此外,还可有效降解大豆中的抗营养因子和消除豆腥味[6]。本研究菌种StreptococcusthermophilusS10(S.thermophilusS10)是在乳品生物技术与工程教育部重点实验室乳酸菌菌种资源库的406株S.thermophilus中筛选得到的1株具有良好发酵大豆乳特性和弱化后酸能力较好的S.thermophilus[7]。LactobacillusplantarumP-8(L.plantarumP-8)是本实验室于2005年分离自内蒙古巴彦淖尔市乌拉特中旗草原上牧民家庭自然发酵酸牛乳样品中的1株具有优良益生特性的L.plantarum,在消化系统中具有优异的耐受胃酸、肠液和胆盐能力[8-9],在单菌发酵大豆乳实验中证明可显著提高其活性大豆异黄酮含量[10]。本研究应用S10+P-8发酵豆乳,为开发一款符合现代生活要求的新型产品提供理论研究基础和一定的技术参考。
1 材料与方法
1.1 实验材料
1.1.1 实验菌种及培养基
本研究所用S.thermophilusS10和L.plantarumP-8直投式发酵剂由乳品生物技术与工程教育部重点实验室乳酸菌菌种资源库提供,商业发酵剂A和B分别购自科汉森(中国)有限公司、丹尼斯克(中国)有限公司;所用培养基为合成MRS-V(万古霉素 10 mg/L)固体培养基和合成ST固体培养基。
1.1.2 主要实验材料
全脂大豆粉,蛋白质含量≥39%,黑龙江农垦龙王食品有限公司。
1.1.3 主要仪器与设备
NSC-II A-1200型无菌工作台;雷磁PHS-3C 型pH计,上海精密科学仪器有限公司;TA-XT plus型质构仪,英国SMS公司;SRH 60-70型高压均质机,上海申鹿均质机有限公司;Brookfield DV-1型黏度计,上海君翼仪器设备有限公司;SA 402B型味觉感应系统,日本Insent公司;Waters Acquity UPLC-QTOF MS超高效液相色谱-四级杆飞行时间质谱仪,沃特世科技(上海)有限公司。
1.2 实验方法
1.2.1 发酵豆乳样品制备
将全脂豆粉(6.6%)与蔗糖(8%)混合后加入到60 ℃蒸馏水(85.4%)搅拌均匀,然后于65℃、30 MPa条件下均质,95℃杀菌5 min,冷却至(42±0.5)℃接种发酵剂[6]。样品置于42 ℃恒温发酵至pH接近4.50后,转至4℃过夜后熟,4℃贮藏28 d。发酵过程中每隔2 h取样检测,贮藏期间每隔7 d取样检测;接种量依据商业发酵剂产品说明0.03 g‰添加,实验组按照S.thermophilusS10∶L.plantarumP8=1 000∶1添加,其中S.thermophilusS10添加量为2×106CFU/mL。
1.2.2 实验组样品活菌数测定
实验组S.thermophilusS10采用ST固体培养基进行选择培养[11];L.plantarumP8采用固体培养基MRS-V(万古霉素10 mg/L)进行选择培养[12]。37 ℃恒温厌氧培养(72±6)h,记录菌落数变化。
1.2.3 发酵豆乳样品酸度测定
pH值测定:采用雷磁PHS-3C 型pH计直接测定;
滴定酸度测定:发酵豆乳的滴定酸度按照国家标准GB5009. 239 — 2016中规定的“酚酞指示剂法”进行检测[13]。
1.2.4 发酵豆乳样品黏度、持水性测定
黏度测定:发酵豆乳样品放至室温后,采用Brookfield DV-1型黏度仪4#转子进行测定,转子转速为100 r/min,扭矩为10%~100%,测定时间为30 s。
持水性测定:准确称取发酵豆乳样品20.00 g,置于有滤纸的漏斗中,室温放置90 min后收集滤液并称重[14]。计算方法如下:

(1)
1.2.5 发酵豆乳样品游离大豆异黄酮含量测定
样品处理:取4 mL发酵豆乳上清液于10 mL EP管中,加4 mL乙醇,加HCl至浓度为1 mol/L,混匀,80℃孵育60 min,9000×g高速离心10 min,取1 mL上清液经0.22 μm膜过滤于样品瓶中备用,色谱条件按照米智慧等[15]进行设定。
1.2.6 发酵豆乳样品质构特性测定[16]
将样品温度恢复至室温,应用质构分析仪测定其质构特性,检测指标有坚实度、稠度、黏性、黏滞指数。TPA测定参数如下:测定前探头速度、测定时探头速度、测定后探头速度均为1.00 mm/s;测定距离20 mm;探头柱型AEC,盘径35 mm;感应力Auto-5 g;数据攫取速度200 pps。
1.2.7 发酵豆乳样品基本味觉特征评价
将后熟完成且恢复常温的样品3 000×g离心10 min后过滤上清液,所得滤液于4℃、8 000×g离心10 min,除去上层油脂后留滤液备用[17]。样品测定具体操作以KOBAYASHI Y等[18]进行样品的测定。
1.2.8 发酵豆乳样品感官品鉴
贮藏期间,发酵豆乳样品每7 d进行1次感官品鉴。感官品鉴小组由5名女性、5名男性共10名品鉴人员组成,10名品鉴人员经常饮用发酵乳(豆乳和牛乳),并接受2次时间为2 h的感官鉴评培训[19]。评鉴指标有表观指标、气味指标、风味指标和质地指标,评分采用100分制[20]。
1.2.9 数据分析
实验至少重复3次,各指标均为3组平行,结果表示为(X±s。采用SPSS 21.0软件对实验数据进行统计学分析,2组数据间的比较采用独立样本T检验(independent-samples T-test)进行分析,显著性水平设定为0.05;3组或多于3组数据间的比较采用单因素方差分析(One-way ANOVA)的Duncan’s法进行两两比较分析,显著性水平同样设定为0.05。作图采用Origin lab 2017软件。
2 结果与分析
2.1 实验组样品在贮藏期间活菌数变化情况
本实验研究内容为活菌型益生菌发酵豆乳,欧盟规定在货架期内益生菌产品益生菌活菌数须保持在106CFU/mL以上[21]。将4 ℃贮藏的样品进行发酵完成、后熟、7、14、21和28 d活菌数统计,作为衡量本样品贮藏稳定性的重要评定标准。

表1 实验组样品在贮藏期间活菌数变化情况Table 1 Changes of viable bacterial counts of fermentedsoymilk experimental group with storage time
注:不同小写字母代表差异显著性,P<0.05。
由表1可知:贮藏期间,S.thermophilusS10活菌数在14 d后有下降趋势(P<0.05);益生菌L.plantarumP-8活菌数在21 d时有下降趋势(P<0.05);贮藏结束时,S.thermophilusS10维持在4.00×107CFU/mL以上;益生菌L.plantarumP-8的活菌数维持在1.0×109CFU/mL以上。本实验证明应用S10+P-8发酵豆乳,益生菌L.plantarumP-8具有很好的贮藏稳定性。
2.2 发酵豆乳在发酵、贮藏期间酸度变化情况
由图1可知:添加不同发酵剂分别发酵豆乳,发酵期间酸度均有显著变化(P<0.05)。发酵过程中,添加发酵剂A的样品在0~4 h期间pH值、滴定酸度变化显著(P<0.05);添加S10+P-8、发酵剂B的样品在2~6 h期间pH值、滴定酸度变化显著(P<0.05);3种样品到达发酵终点所需时间约9 h,pH分别是4.48、4.48和4.47,滴定酸度分别是60.64、58.40和58.21 °T,差异不显著。在贮藏期间,3种发酵豆乳样品酸度有显著变化(P<0.05)。贮藏结束时pH在4.30左右,组间差异不显著,滴定酸度在74.00 °T以下,S10+P-8组与发酵剂A组之间差异不显著,分别是68.78 °T和68.51 °T,低于发酵剂B组,差异显著(P<0.05)。发酵豆乳在贮藏期间酸度保持是体现高品质的重要标准,一般商业发酵乳的pH值4.2~4.4[22]。
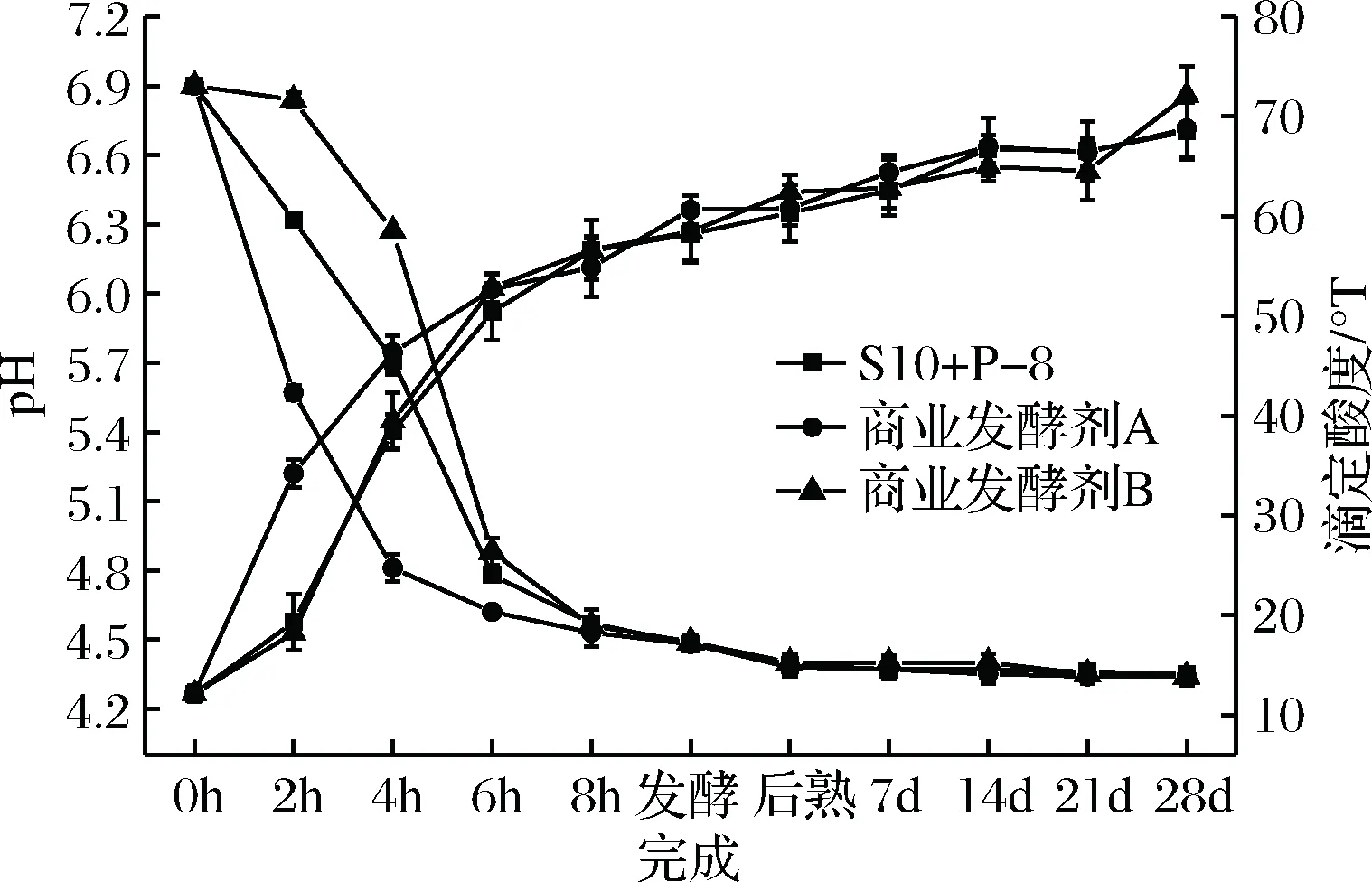
图1 发酵过程及贮藏期间3种发酵豆乳样品
酸度变化情况
Fig.1 The acidity of three groups of fermented soymilk
samples during fermentation and storage period
2.3 发酵豆乳在发酵、贮藏期间黏度变化情况
添加不同发酵剂分别发酵豆乳,发酵过程和贮藏期间黏度测定结果如图2所示:发酵过程中各组样品黏度均显著升高(P<0.05),发酵剂A组样品约4 h达到凝乳状态,与S10+P-8组和发酵剂B组样品有显著差异(P<0.05);S10+P-8组和发酵剂B组样品约6 h凝乳。发酵结束时,样品组间黏度无显著差异。有研究者认为黏度无显著差异可能是由于菌体增殖产生乳酸,导致发酵豆乳中乳酸的含量增加到足够浓度时,大豆蛋白凝固形成酸凝胶使黏度迅速增加,使菌体代谢受到抑制,乳酸的生成速度下降,限制了黏度继续上升,致使最终黏度保持相对稳定状态[23]。3组样品经4 ℃过夜后熟黏度显著升高,其中S10+P-8组黏度较高,差异显著(P<0.05)。这是由于完成发酵后乳酸菌依旧保持较高活力活性,胞外多糖继续积累,相比之前黏度变化显著(P<0.05)。在4 ℃、28 d贮藏期间,组内黏度变化差异不显著,其中S10+P-8组黏度较高,差异显著(P<0.05),因实验组L.plantarumP-8一直保持较高活菌数,乳酸菌代谢产生乳酸,大豆蛋白凝固作用形成酸凝胶使黏度较高。
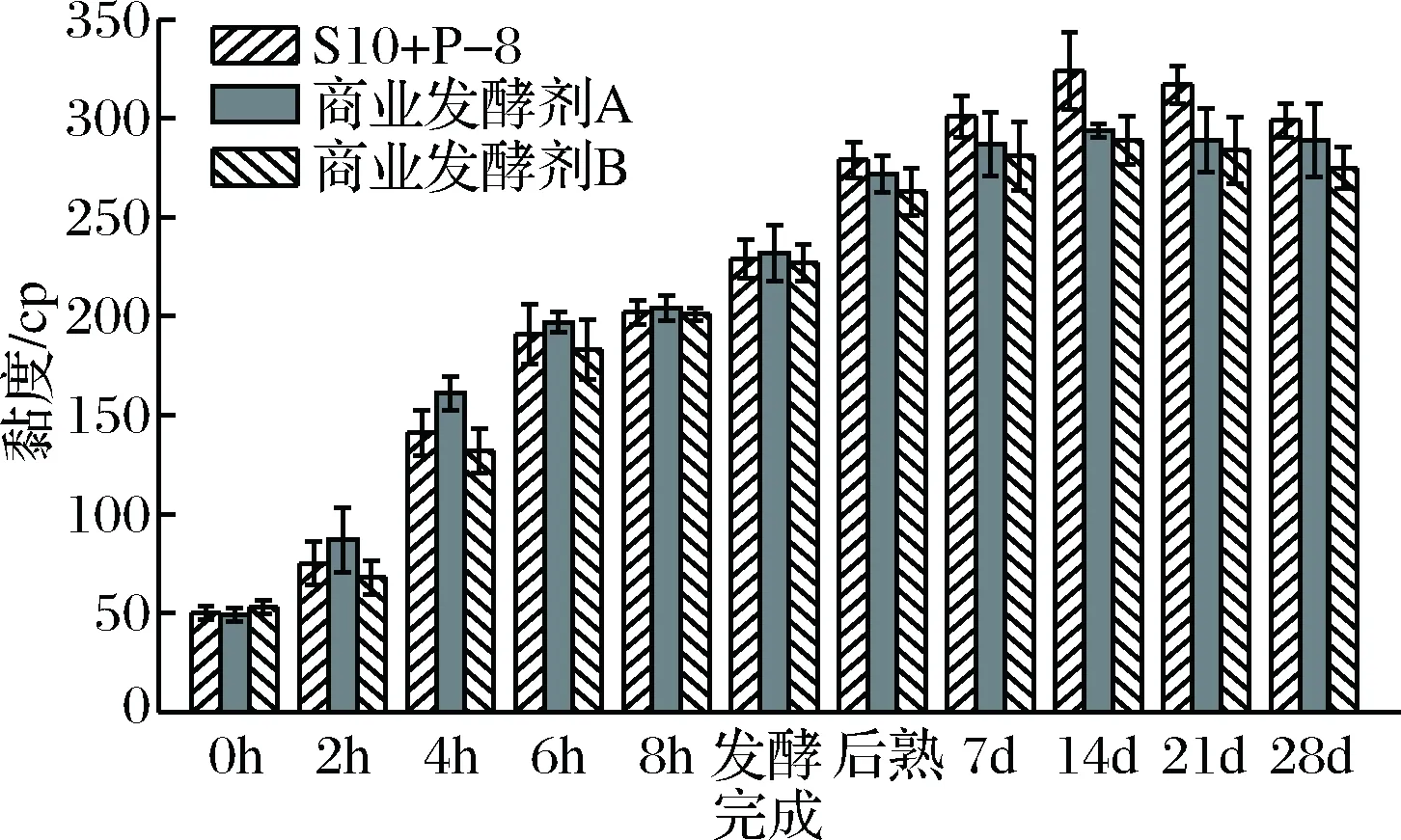
图2 发酵过程及贮藏期间3种发酵豆乳样品
黏度变化情况
Fig.2 The viscosity of three groups of fermented soymilk
samples during fermented and storage period
2.4 发酵豆乳样品在发酵过程、贮藏期间持水性变化情况
发酵豆乳持水性变化是由蛋白质三维网状结构的凝胶状态所形成的,蛋白质是将流动性较好的豆乳转化为半固态发酵豆乳的微观物质基础。接种发酵剂不同,乳酸菌代谢产物也会有差异,致使蛋白质会发生不同程度地变性凝集,进而影响发酵豆乳持水性[24]。
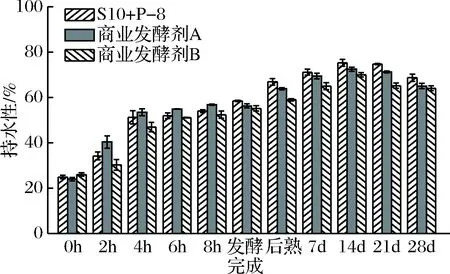
图3 发酵过程及贮藏期间3种发酵豆乳样品
持水性变化情况
Fig.3 The water holding capacity of three groups of ferm-
ented soymilk samples during fermented and storage period
由图3可知:3种发酵豆乳样品在发酵过程中持水性均有显著变化(P<0.05)。发酵结束时持水性较低,后熟完成后持水性显著增强(P<0.05);3组样品在14 d前持水性呈一直上升趋势,之后有小幅下降。贮藏期间S10+P-8组持水性较高,与对照组相比具有显著差异(P<0.05)。这可能与样品在贮藏期间活菌数、pH值和黏度变化有关,有利于产品贮藏及风味保留。
2.5 发酵豆乳样品大豆异黄酮含量变化情况
关于大豆异黄酮成分,一般认为大豆苷(daidzin)、大豆素(daidzein)、染料木苷(genistin)、染料木素(genistein)是大豆异黄酮的主要成分,大豆黄苷(glycitin)和大豆黄素(glycitein)生理活性的报道较少,其中大豆苷(daidzin)、大豆黄苷(glycitin)、染料木苷(genistin)属于糖苷型大豆异黄酮;大豆素(daidzein)、大豆黄素(glycitein)、染料木素(genistein)属于游离型大豆异黄酮[25]。在4 ℃贮藏期间大豆异黄酮含量变化不显著,具有一定稳定性,所以本实验选择原豆乳、发酵结束和后熟完成进行大豆苷、大豆素、染料木苷、染料木素含量测定。
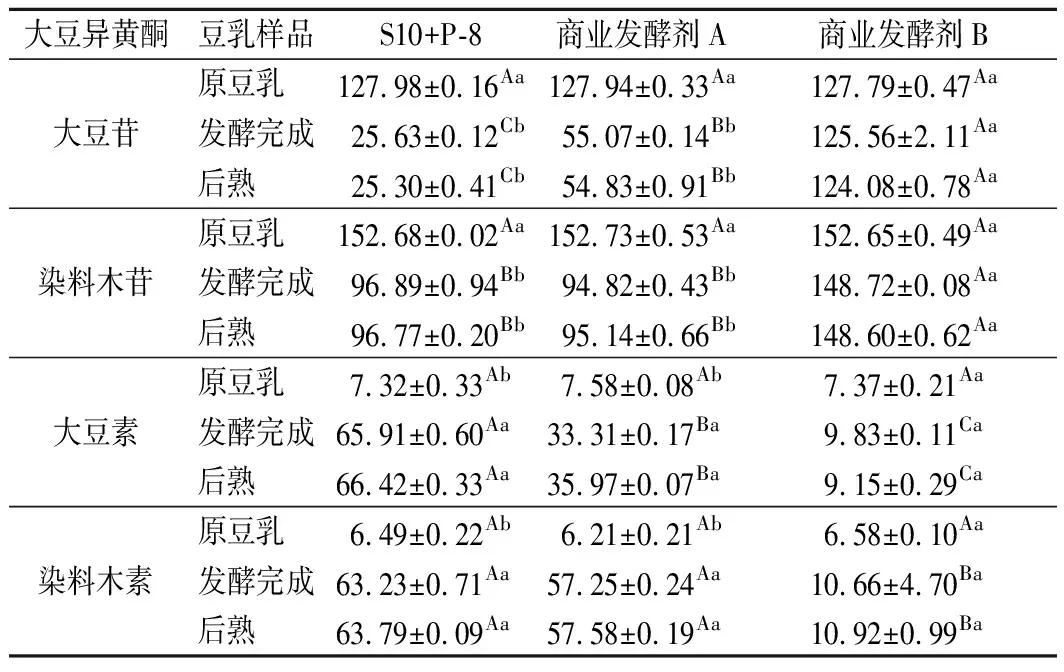
表2 三种发酵豆乳中大豆异黄酮含量变化情况 单位:μg/mL
注:数据肩不同大写字母代表组间变化差异性,不同小写字母代表组内变化差异性。P<0.05。下同。
由表2可知:发酵剂B组样品4种大豆异黄酮含量变化不显著。S10+P-8组和发酵剂A组样品中4种大豆异黄酮含量变化显著(P<0.05):大豆苷和大豆素含量测定结果表明,S10+P-8组与发酵剂A组相比变化量更大,差异显著(P<0.05)。染料木苷和染料木素含量测定结果表明,S10+P-8组与发酵剂A组样品相比差异不显著。BAO等[10]研究表明,接种L.plantarumP-8于豆乳中,经发酵作用可促使无生物活性异黄酮转化为有生物活性的异黄酮,这可能是实验组比对照组样品的活性异黄酮转化量更大原因。
2.6 发酵豆乳样品质构特性测定结果
利用质构仪检测3种样品在贮藏期间质构特性变化,结果如表3所示:在贮藏期间,对照组样品的4种质构指标变化差异不显著;S10+P-8组样品的稠度和黏性与对照组相比具有更高的数值,差异显著(P<0.05),其中稠度在1~14 d略有上升,之后有小幅下降。这可能与样品活菌数和黏度变化有关;S10+P-8组样品其余3种质构指标在贮藏期间变化不显著。
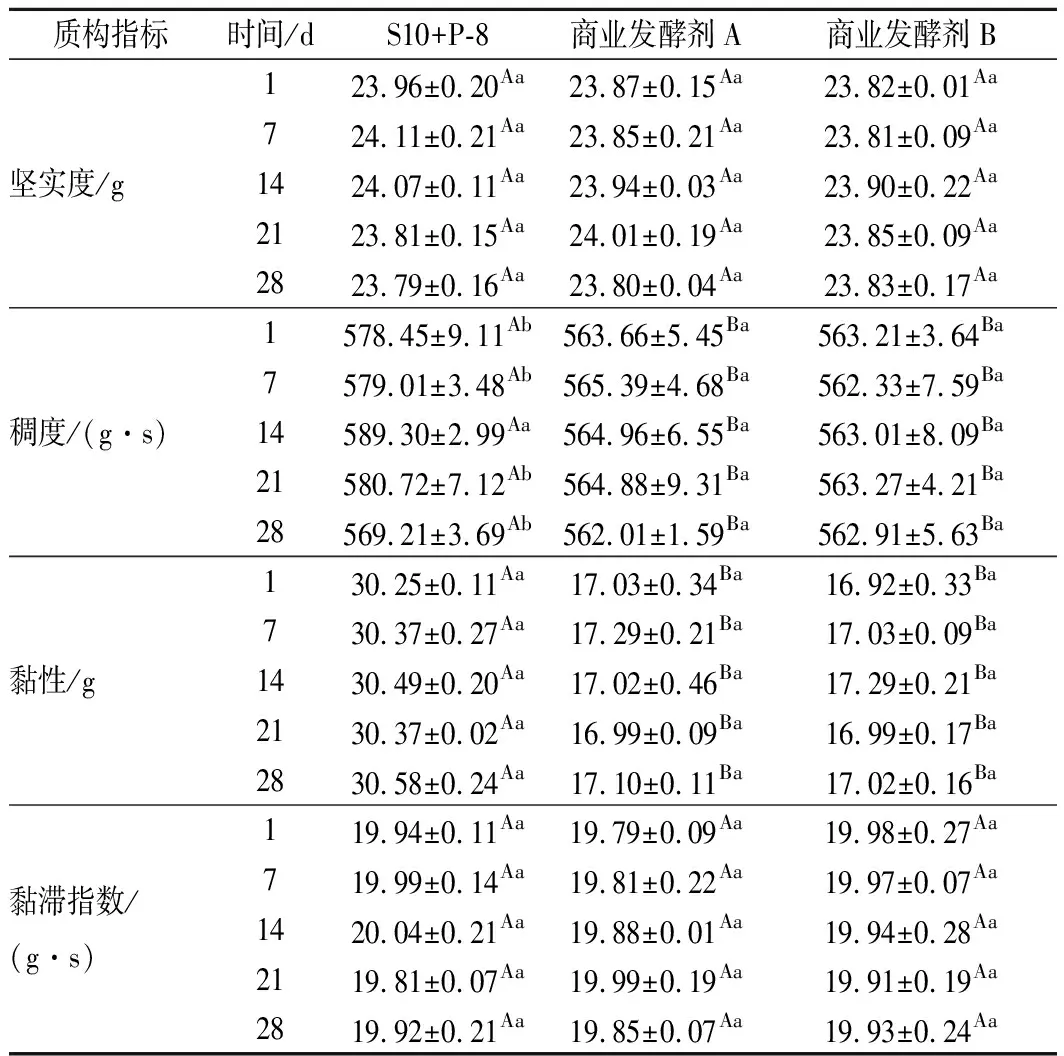
表3 贮藏期间3种发酵豆乳样品质构特性测定结果Table 3 The texture parameters of three groups offermented soymilk samples during fermented andstorage period
2.7 发酵豆乳样品基本味觉特征总体评价
国外已开始应用电子舌技术进行酸奶品质评价及在线生产监测,国内相关研究仍处于起步阶段[26]。本实验应用电子舌系统检测经4℃过夜后熟的发酵豆乳样品的6种基本滋味和3种回味,各滋味指标相对强度分析结果如图4所示:3种发酵豆乳样品的基本滋味差异较小,KOBAYASHI等[27]研究发现,使用SA 402B电子舌对食品进行测定时,若2个样品在某1个滋味指标的相对强度值之差<1,则其差异通过感官品鉴方法不能识别。方差分析结果如表4所示:3种发酵豆乳样品的鲜味和3个回味无显著差异;发酵剂B组样品苦味与其余2组有显著差异(P<0.05),有更高滋味强度;S10+P-8组样品涩味和咸味与对照组相比有显著差异(P<0.05),滋味强度更弱;S10+P-8组样品酸味和甜味与对照组相比有显著差异(P<0.05),有更高滋味强度。

图4 三种发酵豆乳样品各滋味指标相对强度值的
箱形图(n=18)
Fig.4 The box plot of relative intensity of each taste index
in three groups of fermented soymilk samples (n=18)
表4三种发酵豆乳样品各滋味指标相对强度差异性分析
Table4Significantanalysisofeachindexofthreegroups
offermentedsoymilksampleswithstoragetime
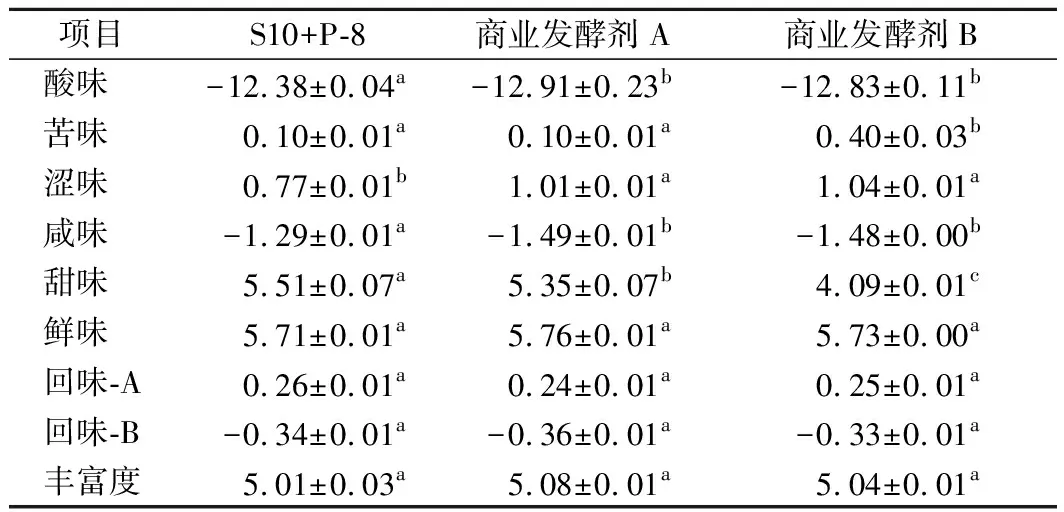
项目S10+P-8商业发酵剂A商业发酵剂B酸味-12.38±0.04a-12.91±0.23b-12.83±0.11b苦味0.10±0.01a0.10±0.01a0.40±0.03b涩味0.77±0.01b1.01±0.01a1.04±0.01a咸味-1.29±0.01a-1.49±0.01b-1.48±0.00b甜味5.51±0.07a5.35±0.07b4.09±0.01c鲜味5.71±0.01a5.76±0.01a5.73±0.00a回味-A0.26±0.01a0.24±0.01a0.25±0.01a回味-B-0.34±0.01a-0.36±0.01a-0.33±0.01a丰富度5.01±0.03a5.08±0.01a5.04±0.01a
注:同行不同字母表示差异显著,P<0.05。
2.8 发酵豆乳样品感官品鉴
取发酵完成、后熟、7、14、21、28 d时的3种发酵豆乳样品,进行感官品鉴,评分结果如图5所示。
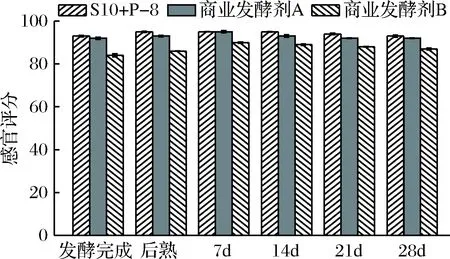
图5 贮藏期间3种发酵豆乳样品感官品鉴得分情况
Fig.5 The comprehensive score of three fermented soymilk
samples in sensory quality evaluated during storage period
在4 ℃、28 d贮藏期间,各组样品得分变化差异不显著,但样品组间得分存在差异(P<0.05)。其中S10+P-8组和发酵剂A组样品差异不显著,高于发酵剂B组。S10+P-8组样品在贮藏期间黏度较高,有良好的拉丝性,且表面光滑、无臭味及不良异味,酸甜适中,口感平滑细腻。本研究表明:与对照组相比,添加益生菌L.plantarumP8后对发酵产品外观、气味、质地等指标有所改善,SAARELA等[28]研究也表明在产品中添加益生菌有助于提高产品感官品质,这与本研究结果相吻合。
3 结论
本研究对复合发酵剂S10+P-8在豆乳发酵期间及贮藏过程的时间、活菌数、酸度、黏度、持水性、活性大豆异黄酮转化量、质构特性、基本味觉特性进行测定,对感官进行品鉴。与2种商业豆乳发酵剂相比,发酵剂S10+P-8具有良好的发酵特性及贮藏稳定性,且具有更好的活性大豆异黄酮转化能力,在贮藏期间能提供较高的益生菌活菌数,在发酵豆乳制品开发中具有良好应用潜力。
