木豆素对慢性不可预见温和应激小鼠的抗抑郁作用
2019-03-01张梦荻王丽莎李晨晨陶雪周云丰刘新民潘瑞乐常琪
张梦荻,王丽莎,李晨晨,陶雪,周云丰,刘新民,2,潘瑞乐,常琪*
(1. 中国医学科学院北京协和医学院药用植物研究所,北京 100193; 2. 中国航天员科研训练中心人因工程重点实验室,北京 100094)
抑郁症是一种情绪、睡眠、食欲、体育、动机、兴趣、思考力普遍紊乱的情感性精神疾病,严重影响人体的健康。当今社会快节奏的生活和高强度的压力下,抑郁症的发病率逐年上升,给病人自身和家庭甚至整个社会带来巨大的影响,已经逐渐成为全球性的健康难题[1]。目前运用于临床的抗抑郁药物在治疗时仍存在许多不足,如起效缓慢、不良反应大、抗抑郁谱窄等,所以仍然需要我们进一步研究可以防治抑郁症的药物。
木豆(Cajanuscajan(Linn.) Millsp.)是一种分布于热带和亚热带地区的豆科植物,为世界第六大食用豆类,也是唯一的木本食用豆类[2]。木豆作为传统民族药物被广泛使用,具有清热解毒消肿、利湿止血、止痛、杀虫等作用。现代药理研究表明,木豆叶的水或乙醇提取物具有抗骨质疏松、降血脂、抗脑缺血缺氧损伤的作用。木豆素(cajaninstilbene acid,CSA)是木豆叶中含量较高且活性较强的一芪类化合物,具有抗炎、镇痛、抗肿瘤、抗疱疹病毒及降血糖的药理活性[3]。我们的前期研究表明,木豆素对皮质酮诱导的PC12细胞的损伤具有明显的保护作用,认为木豆素能够通过抑制氧化应激和内质网应激等途径保护神经元。根据木豆素的神经保护作用,我们首次利用动物模型对木豆素进行了抗抑郁活性的相关研究,并对其可能的作用机制进行初步探讨。
1 材料与方法
1.1 材料
1.1.1 实验动物
SPF级雄性BALB/c 小鼠72只,体重 20 ~ 22 g,购自维通利华实验动物公司【SCXK(京)2016-0011】。饲养于中国医学科学院药用植物研究所屏障动物实验设施内【SYXK(京)2014-0023】。自由供给标准饲料和清洁水,维持 12 h光照:12 h黑暗昼夜节律,室温(24 ± 1)℃,相对湿度为(55 ± 10)%。所有操作均符合实验动物伦理学要求(伦理审批号:SLXD-2018053017)。
1.1.2 药品与试剂
木豆素为本实验室自制[4],其纯度经HPLC法测定为98%;5-羟色胺(5-hydroxytryptamine,5-HT,BCBM9925 V)、多巴胺(dopamine,DA,BCBR4608 V)、γ-氨基丁酸(γ-aminobutyric acid,GABA,A2129)、4-对乙酰氨基酚(4-acetamidophenol,05615EEV)均购自美国Sigma公司;盐酸帕罗西汀(paroxetine hydrochloride,Par,100357-201102)、谷氨酸(glutamate,Glu,140690-200401)、去甲肾上腺素(norepinephrine,NE,100169-201404)购自中国食品药品检定研究院;三氟乙酸(trifluoroacetic acid,TFA,3099812)购自美国Dikma公司;乙酰胆碱(acetylcholine,Ach)购自中国Biotopped公司;质谱级乙腈和甲酸购自美国Fisher公司;小鼠皮质酮酶联免疫吸附检测试剂盒(南京建成生物工程研究所,20180307)。
1.1.3 主要仪器设备
Prominence UFLC 液相色谱系统(日本 岛津);Q-Trap5500 型质谱分析仪(美国AB SCIEX);Vibra-Cell 型超声波破碎仪(美国 Sonics 公司);M1000型多功能连续波长酶标仪(瑞士 Tecan)。
1.2 方法
1.2.1 CUMS模型建立及给药
动物适应性饲养1周后,根据造模前进行的糖水偏爱基线测试结果将小鼠随机分为6组,每组12只,即正常组、CUMS模型组、阳性药帕罗西汀组(10 mg/kg)、CSA低剂量组(7.5 mg/kg)、CSA中剂量组(15 mg/kg)、CSA高剂量组(30 mg/kg)。除正常组外,其余各组动物单笼饲养且在6周内接受CUMS造模[5],应激因素包括:禁水(12 h)、禁食(12 h)、昼夜颠倒(24 h)、夹尾(2 ~ 3 min)、4℃冰水游泳(5 min)、动物叫声(30 min)、束缚(4 h)、湿笼(300 mL水/笼,12 h)、45℃倾笼(7 h)、配对饲养(12 h)等。每日应激刺激2~3种,并尽量使应激过程符合不可预测的特点,避免动物产生适应性。造模同时开始给药,每日1次,直到检测结束。各组均按10 mL/kg灌胃给药。各组药物均以0.5%羧甲基纤维素钠溶液为溶剂,正常组和模型组给予溶剂。
1.2.2 糖水偏爱实验
参照文献报道[6], 糖水偏爱实验分为训练期和测试期。首先进入训练期,给予动物一瓶2%蔗糖水和一瓶纯水48 h,中间交换水瓶位置,让小鼠适应饮用糖水。随后进入测试期,动物禁食8 h(9:00-17:00)后进行16 h(17:00-第2天9:00)的糖水偏爱测试,给予动物一瓶2%蔗糖水和一瓶纯水,中间交换水瓶位置,测试前后分别称量每个水瓶的重量,并计算糖水偏爱指数(糖水偏爱指数=糖水消耗量/总液体消耗量×100%)。造模结束后第2天进行糖水偏爱实验,评价快感缺失的症状。
1.2.3 生物样品采集
行为学检测后的第2天下午,小鼠给药1 h后从每组随机选取8只眼球取血并脱颈处死,迅速分离出海马和皮层组织并精密称重。血样在4℃离心(3500 r/min,10 min),取上层血清,并于-80℃保存待测。
1.2.4 皮质酮和神经递质的含量检测
血清皮质酮的含量测定依据试剂盒所提供的说明书进行;皮层和海马中的神经递质水平测定按如下方法进行。
取小鼠全部皮层和海马组织,分别精密加入100 μL和50 μL超纯水,冰浴中超声匀浆。经预先测得1 g脑组织匀浆后体积为1 mL,故脑组织匀浆液的体积应计算为所加入的匀浆液体积与脑组织重量之和。精密吸取50 μL组织匀浆液,加入20 μL内标液4-对乙酰氨基酚80%甲醇溶液(500 ng/mL),涡旋混匀后加入10 μL TFA以沉淀蛋白,涡旋,于4℃低温离心(20 000 g,15 min),吸取上清液于进样瓶中,取3 μL注入液相色谱-质谱联用(LC-MS/MS)仪进行分析。
色谱柱为Restek Ultra AQ C18(100 mm ×2.1 mm,3 μm),柱温35℃,流动相为乙腈(A)- 0.1%甲酸水溶液,流速0.4 mL/min。梯度洗脱程序为:0- 0.5 min,5% A;0.5- 5 min,5- 80% A;5- 6 min,80% A;6- 6.1 min,80-5% A;6.1- 8 min,5% A。采用ESI电离方式进行离子化,以正离子模式下的多反应检测(MRM)对流出液体进行分析。离子源参数优化为:喷雾电压4500 V;加热温度500 ℃;气帘气30 psi;雾化气60 psi和辅助气40 psi。检测离子对分别为177.0/160.0(5-HT)、170.0/152.0(NE)、148.2/84.0(Glu)、104.1/87.0(GABA)、154.0/136.6(DA)、146.0/87.4(Ach)和152.0/109.9(IS)。
1.3 统计学方法
采用 SPSS 23.0 统计软件进行分析。数据采用one-way ANOVA 进行多组间比较, 两两比较采用 Fisher’s LSD post hoc 多重比较方法或者曼-惠特尼U检验。P< 0.05认为差异有显著性。
2 结果
2.1 CSA对CUMS模型小鼠糖水偏爱指数的影响
如图 1所示,对小鼠CUMS刺激6周造模后,与正常组相比,模型组动物糖水偏爱指数显著性降低(P< 0.05),给药各组较模型组糖水偏爱指数均上升,且CSA中、高剂量组与模型组比较有显著性差异(P< 0.05)。
2.2 CSA对CUMS模型小鼠血清皮质酮的影响
如图2所示,对小鼠CUMS刺激6周造模后,与正常组相比,模型组动物血清皮质酮含量显著性升高(P< 0.05),给药各组较模型组血清皮质酮含量均有所下降,且帕罗西汀组和CSA 15 mg/kg剂量组与模型组比较有显著性差异(P< 0.05)。
2.3 CSA对CUMS模型小鼠皮层和海马中神经递质含量的影响
如表 1所示,与正常组相比,模型组皮层中GABA、NE、DA和Glu含量显著减少(P< 0.05)。与模型组相比,帕罗西汀组动物皮层内NE和DA含量显著性升高(P< 0.05)。 CSA低剂量组动物皮层内NE、GABA和Glu含量与模型组相比显著性升高(P< 0.05)。CSA中剂量组动物皮层 DA、NE和Glu含量显著高于模型组(P< 0.05),木豆素高剂量组皮层5-HT含量较模型组显著升高(P< 0.05)。
如表2所示,与正常组相比,模型组海马中Ach含量显著减少(P< 0.05)。帕罗西汀组及CSA低、中剂量组动物海马内Ach含量与模型组相比显著性升高(P< 0.05)。
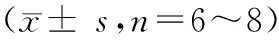
表1 CSA对CUMS小鼠皮层内神经递质浓度的影响Table 1 Effect of CSA on concentration of neurotransmitters in cerebral cortex of the CUMS mice s,n=6~8)
注:与对照组比较,#P< 0.05,##P< 0.01;与模型组比较,*P< 0.05,**P< 0.01。
Note.#P< 0.05,##P< 0.01,vs. the control group.*P< 0.05,**P< 0.01,vs. the CUMS group.
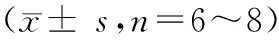
表2 CSA对CUMS小鼠海马内神经递质浓度的影响Table 2 Effect of CSA on concentration of neurotransmitters in hippocampus of the CUMS mice s,n=6~8)
注:与对照组比较,#P< 0.05,##P< 0.01;与模型组比较,*P< 0.05,**P< 0.01。
Note.#P< 0.05,##P< 0.01,vs. the control group.*P< 0.05,**P< 0.01,vs. the CUMS group.
3 讨论
目前,我们可以将抑郁症模型分为环境刺激模型、社会刺激模型、药物诱导模型、转基因模型、手术制备模型和产后抑郁模型六大类。本研究所选取的CUMS模型就属于环境刺激模型,是抑郁症的经典慢性模型之一,利用长期的相对温和的不可预测的人为刺激使得动物产生抑郁样行为,其病因和病理机制接近于人类抑郁症,目前已经被广泛接受并运用于抑郁动物模型的建立。本实验中经CUMS造模后,动物产生快感缺失现象,表现在CUMS小鼠其糖水偏爱指数显著下降,而给予帕罗西汀和CSA后指数均有所上升,其中CSA 15 mg/kg 和30 mg/kg与模型组比较具有显著性差异,这说明CSA可能具有抗抑郁作用。
抑郁症的发病与神经内分泌系统失调十分相关,研究表明长期的应激状态会导致糖皮质激素水平持续升高,对神经元造成损伤,破坏HPA轴的负反馈调节机制,从而导致HPA轴功能的持续亢进,进一步损伤神经可塑性。本实验中CUMS造模引起了小鼠血清皮质酮水平的显著升高,反映了HPA轴功能的亢进,而给予CSA后可以减少CUMS小鼠血清皮质酮的水平,且CSA 15 mg/kg剂量组与模型组比较具有显著性差异,说明CSA可能通过抑制HPA轴功能而产生抗抑郁作用。
除此之外,神经递质在抑郁症的发病中也起着重要作用。研究表明,抑郁患者体内的神经递质水平发生了明显的改变[7-8],其中单胺类神经递质的减少是抑郁症发病机制的假说之一。本研究发现CUMS小鼠皮层中NE和DA含量显著减少且CSA可以显著逆转这一趋势。与正常组比较,模型组海马中未见有单胺类神经递质的显著性改变。这说明CSA可能通过提高小鼠皮层中NE和DA的含量来产生抗抑郁作用。
GABA是脑内重要的抑制性神经递质,研究表明,在抑郁患者血浆及脑脊液中GABA水平下降[9-10],并且用于合成GABA的谷氨酸脱羧酶(GAD)表达也减少[11-12],说明GABA功能的缺陷可能参与了抑郁症的发生。本研究中,CUMS小鼠皮层中GABA含量显著减少且CSA可以逆转这一趋势,但在海马中未发现这一显著趋势。这表明CSA可能通过提高小鼠皮层中GABA的含量来产生抗抑郁作用。
谷氨酸是脑内重要的兴奋性神经递质,它既能触发短期的兴奋性突触后电位,也能诱导长期的突触传递强度和神经可塑性的变化,对于信息加工、记忆等十分重要。谷氨酸浓度的变化与抑郁的产生有一定关系。大部分研究认为抑郁与谷氨酸水平大量升高有关。有研究表明谷氨酸过度释放会导致兴奋性毒性,造成神经元的损伤和死亡,其堆积可能是引起抑郁的原因之一[13-14]。但是针对抑郁症患者体内谷氨酸水平变化的研究仍有不同的发现。有研究发现抑郁病人血液、脑脊液及脑内谷氨酸水平不变或升高[15-17],还有研究发现抑郁病人脑脊液和抑郁模型动物皮层中谷氨酸水平降低[11,18],并且谷氨酸能神经元代谢活动和其神经递质的传递都减少。除此之外,有研究通过定量脑内的神经相关代谢物发现,重度抑郁症患者前额叶皮层内Glx(谷氨酸和谷氨酰胺的总信号强度)水平下降[19]。在本研究中发现CUMS小鼠皮层中Glu含量显著减少且CSA可以逆转这一趋势;而海马中CUMS小鼠Glu含量有所上升,木豆素给药后有所下降,但其中的差异未见显著性。Glu在抑郁模型小鼠皮层组织中的显著下降与部分文献的报道相一致[11],表示出现了谷氨酸能系统的异常。并且,木豆素的抗抑郁作用可能与提高皮层内Glu的含量有关。
认知功能障碍常常会伴随着抑郁产生,影响注意力、记忆力及执行力等各个方面。研究表明胆碱能系统与学习记忆功能密切相关,认知功能障碍患者海马等部位的胆碱能神经元数量和乙酰胆碱水平显著减少[20-21],本研究中,CUMS小鼠海马中ACh含量显著减少且CSA可以逆转这一趋势,说明CSA具有改善抑郁模型动物认知功能损伤的可能性。
另外,我们的实验结果表明CUMS模型动物血清中的5-HT水平是显著下降的(未在文中显示),但是皮层和海马部位没有显著性差异,我们认为CUMS对于脑组织中5-HT的影响可能有限。虽然很多研究结果显示CUMS小鼠脑内5-HT水平下降,但是也有部分文献报道,CUMS造模后,皮层或者多个脑区(包括海马和扣带皮层)内5-HT含量没有显著改变[22-23]。除此之外我们可以看出帕罗西汀给药后相比正常组5-HT的含量显著下降,这与预期的结果不一致,但有研究发现,慢性应激小鼠只有在良好的外界环境下给予氟西汀会产生良好的抗抑郁效果,而在应激条件下给予氟西汀并不能改善抑郁症状,甚至会有所恶化[24],帕罗西汀同样作为选择性5-羟色胺再摄取抑制剂可能也会有类似的情况,从而导致5-HT水平异常下降,但这仍需进一步探究。
实验中木豆素各剂量组的药效作用未见明显的量效关系,这可能与其作用于神经系统的特性有关。作用于神经系统的药物其作用通常具有两面性,即神经的兴奋作用和抑制作用。例如,氯胺酮作为一种新型的抗抑郁药其在高剂量下具有麻醉作用,然而在低剂量下却具有明显的抗抑郁的作用。不同剂量下产生这两种不同的作用说明神经药物的量效关系其实更为复杂,其作用并不一定会随着剂量的升高而持续升高。并且有时高剂量、高频率或者长时间的给药也可能导致神经毒性的产生,从而无法产生良好的药效[25]。所以木豆素对于神经系统的作用也许也存在这样的特性,在不同的剂量下对于一些生化指标的影响也不同,但这需要进一步的研究确认。
值得注意的是模型组皮层和海马中各神经递质的变化有一定差别,并且CSA对于两个部位代谢物的影响也不相同,说明不同部位在CUMS的影响下可能会有不一样的反应,且相对于海马,CUMS对于小鼠皮层中神经递质的影响更大。
综上,我们认为CSA可能具有抗抑郁作用,并且是通过调节HPA轴功能及皮层神经递质水平来实现的,除此之外CSA还具有改善抑郁模型动物认知功能损伤的可能性,但是其作用的深层机制未能被深刻阐明, 仍需要我们进一步的研究和探索。
参考文献
[1] 刘佳莉,苑玉和,陈乃宏. 抑郁症的治疗研究进展[J]. 中国药理学通报,2011,27(9): 1193 - 1196.
Liu JL, Yuan YH, Chen NH. Progress in the treatment of depression [J]. Chin Pharmacol Bull, 2011, 27 (9): 1193-1196.
[2] 李正红, 周朝鸿, 谷勇,等. 中国木豆研究利用现状及开发前景 [J]. 林业科学研究, 2001, 14 (6): 674 - 681.
Li ZH, Zhou CH, Gu Y, et al. The present situation and development prospect of the research and utilization of pigeon pea in China [J]. Fore Res, 2001, 14 (6): 674-681.
[3] 季兴跃, 薛司徒, 李卓荣. 木豆叶主要活性成分及其药理作用的研究进展 [C]. 中国药学大会暨中国药师周大会. 2010.
Ji XY, Xue ST, Li ZR. The main active constituents of the leaves of pigeon pea and their pharmacological effects [C]. Chinese Pharmacy Conference and Chinese Pharmacist Conference, 2010.
[4] 刘亚旻, 姜保平, 沈胜楠,等. 木豆叶的化学成分研究 [J]. 中草药, 2014, 45(4): 466-470.
Liu YM, Jiang BP, Shen SN, et al. Chemical constituents study of the leaves of pigeon pea. [J]. Chin Tradit Herbal Drug, 2014, 45 (4): 466-470.
[5] Willner P. Validity, reliability and utility of the chronic mild stress model of depression: a 10-year review and evaluation [J]. Psychopharmacology (Berl), 1997, 134(4): 319-329.
[6] Strekalova T, Spanagel R, Bartsch D, et al. Stress-induced anhedonia in mice is associated with deficits in forced swimming and exploration [J]. Neuropsychopharmacology, 2004, 29(11): 2007-2017.
[7] Lechin F, van der Dijs B, Lechin ME, et al. Plasma neurotransmitters, blood pressure and heart rate during supine-resting, orthostasis, and moderate exercise conditions in two types of hypertensive patients [J]. Res Commun Psychol Psychiatry Behav, 1997, 22(3): 111-145.
[8] Price RB, Shungu DC, Mao X, et al. Amino acid neurotransmitters assessed by proton magnetic resonance spectroscopy: relationship to treatment resistance in major depressive disorder [J]. Biol Psychiatry, 2009, 65(9): 792-800.
[9] Petty F, Kramer GL, Fulton M, et al. Stability of plasma GABA at four-year follow-up in patients with primary unipolar depression [J]. Biol Psychiatry, 1995, 37(11): 806-810.
[10] Vieira DS, Naffah-Mazacoratti MG, Zukerman E, et al. Cerebrospinal fluid GABA levels in chronic migraine with and without depression [J]. Brain Res, 2006, 1090(1): 197-201.
[11] Veeraiah P, Noronha JM, Maitra S, et al. Dysfunctional glutamatergic and γ-aminobutyric acidergic activities in prefrontal cortex of mice in social defeat model of depression [J]. Biol Psychiatry, 2014, 76(3): 231-238.
[12] Karolewicz B, Maciag DG, Stockmeier CA, et al. Reduced level of glutamic acid decarboxylase-67 kDa in the prefrontal cortex in major depression [J]. Int J Neuropsychopharmacol, 2010, 13(4): 411-420.
[13] Soriano FX, Hardingham GE. Compartmentalized NMDA receptor signalling to survival and death [J]. J Physiol, 2007, 584(2): 381-387.
[14] Hardingham GE. Pro-survival signalling from the NMDA receptor [J]. Biochem Soc Trans, 2006, 34(Pt 5): 936-938.
[15] Sanacora G, Zarate CA, Krystal JH, et al. Targeting the glutamatergic system to develop novel, improved therapeutics for mood disorders [J]. Nat Rev Drug Discov, 2008, 7(5): 426-437.
[16] Francis PT, Poynton A, Lowe SL, et al. Brain amino acid concentrations and Ca2+-dependent release in intractable depression assessed antemortem [J]. Brain Res, 1989, 494(2): 315-24.
[17] Hashimoto K, Sawa A, Iyo M. Increased levels of glutamate in brains from patients with mood disorders [J]. Biol Psychiatry, 2007, 62(11):1310-1316.
[18] Frye MA, Tsai GE, Huggins T, et al. Low cerebrospinal fluid glutamate and glycine in refractory affective disorder [J]. Biol Psychiatry, 2007, 61(2): 162-166.
[19] Hasler G, van der Veen JW, Tumonis T, et al. Reduced prefrontal glutamate/glutamine and gamma-aminobutyric acid levels in major depression determined using proton magnetic resonance spectroscopy [J]. Arch Gen Psychiatry, 2007, 64(2): 193-200.
[20] Mufson EJ, Counts SE, Perez SE, et al. Cholinergic system during the progression of Alzheimer’s disease: therapeutic implications [J]. Expert Rev Neurother, 2008, 8(11): 1703-1718.
[21] Desmarais JE, Gauthier S. Alzheimer disease: clinical use of cholinergic drugs in Alzheimer disease [J]. Nat Rev Neurol, 2010, 6(8): 418-420.
[22] Laugeray A, Launay JM, Callebert J, et al. Peripheral and cerebral metabolic abnormalities of the tryptophan-kynurenine pathway in a murine model of major depression [J]. Behav Brain Res, 2010, 210(1): 84-91.
[23] Ding L, Zhang X, Guo H, et al. The functional study of a Chinese herbal compounded antidepressant medicine-Jie Yu Chu Fan Capsule on chronic unpredictable mild stress mouse model [J]. PLoS One, 2015, 10(7): 0133405.
[24] Alboni S, van Dijk RM, Poggini S, et al. Fluoxetine effects on molecular, cellular and behavioral endophenotypes of depression are driven by the living environment [J]. Mol Psychiatry, 2015, 22(4): 552-561.
[25] Murrough JW, Abdallah CG, Mathew SJ. Targeting glutamate signalling in depression: progress and prospects [J]. Nat Rev Drug Discov, 2017, 16(7): 472-486.
