足底电击法诱导大鼠内脏高敏感模型的建立和评价
2019-03-01赵磊李希袁建业林江
赵磊,李希,袁建业,林江,*
(1. 上海中医药大学,上海 201203; 2. 上海中医药大学附属龙华医院消化科,上海 200032; 3. 上海中医药大学脾胃病研究所,上海 200032)
肠易激综合征(irritable bowel syndrome,IBS)是一种常见的功能性肠病,主要表现为腹痛伴有排便习惯和大便性状的改变,并缺少足以解释其症状的肠道结构改变和生化异常[1]。IBS的发病机制尚未完全明了。目前认为,包括在生活早期遭受创伤[2]和恐惧、焦虑、紧张等负面心理因素[3]在内的各种应激作用于脑肠轴[4],可引起神经、内分泌、肠道动力和内脏敏感性的异常[5]。其中内脏高敏感(visceral hypersensitivity,VH)是引起IBS临床症状的重要病理生理机制之一[6]。因此,用应激方法建立VH模型,对于进一步探索IBS发病机制和研发治疗IBS的药物具有重要意义。但是,现有的应激方法如避水、束缚、母婴分离等,存在刺激可控性差、容易产生应激耐受、个体差异大等缺陷,影响研究的结果。足底电击是建立大鼠焦虑、抑郁模型常用的一种应激刺激[7-8],具有可量化和稳定的特点。而焦虑、抑郁也是引起VH的重要因素。因此,本研究尝试采用足底电击应激法建立大鼠VH的模型,并与经典的避水应激法相比较,以期建立一种简便而有效的VH造模方法,为相关研究提供更多的模型选择。
1 材料与方法
1.1 材料
1.1.1 实验动物
清洁级雌性SD大鼠24只,体重160 ~ 180 g,购于上海斯莱克实验动物有限责任公司【SCXK(沪)2017-0005】。大鼠饲养于上海中医药大学动物实验中心【SYXK(沪)2014-0008】,温度20 ~ 26℃,湿度40% ~ 70%,自由进水进食,适应性饲养3 d后开始造模实验。所有实验经上海中医药大学伦理委员会审批【SZY201712005】,操作均符合实验动物伦理要求。
1.1.2 仪器和试剂
大鼠ELISA检测试剂盒:促肾上腺皮质激素释放因子(corticotrophin-releasing factor,CRF),货号mL037302;促肾上腺皮质激素(adrenocorticotrophic hormone,ACTH),货号mL002875;皮质酮(corticosterone,CORT),货号mL002893;五羟色胺(5-hydroxytryptamine,5-HT),货号mL028308,均购自上海酶联生物。避水应激箱、恒压电击箱、压力检测气囊均为自制。
1.2 方法
将实验大鼠随机分为正常对照(normal control,NC)组、足底电击(foot shock stress,FSS)组和避水应激(water avoidance stress,WAS)组,每组8只,合笼饲养。NC组大鼠每日放入足底电击箱内1 h,不予刺激。FSS组和WAS组分别置于足底电击箱和避水应激箱予以相应刺激。
1.2.1 避水应激
参考Bradesi等[9]文献中的方法,装置为避水应激箱(45 cm × 25 cm × 25 cm),箱体中央设置一岛型方台(10 cm × 8 cm × 8 cm),箱体注入室温水(25℃),水面距平台表面下1 cm,大鼠放置于方台上,每天1 h,连续10 d。
1.2.2 足底电击
造模装置为足底电击箱,大小与避水应激箱相同,在电击箱底部平行铺设直径2.0 mm的不锈钢丝,钢丝长度超出箱底两侧各3.0 cm,钢丝间隔0.5 cm,以大鼠足趾可同时接触相邻的至少2条钢丝为准,绝缘固定。将不相邻的钢丝分别在两端用导丝连接,一端串联自复位开关(LA38按钮式自锁点动开关,深圳汇君科技有限公司),接入可控硅电子恒压器(WBT.4000 W,上海稳伏电器有限公司)负极,另一端串联15 W白炽灯(E27型钨丝灯,佛山电器照明股份有限公司,常温电阻R1=100 Ω,发热电阻R2=3200 Ω),接入恒压器正极。将大鼠置于电击箱中自由活动1 h,后接通电源,施加足底电击刺激。具体操作如下:刺激电压为40 V,刺激频率为20次/min,每次1 s,共5 min。为消除昼夜节律影响,刺激时间固定于每天8:00—10:00进行,连续10 d。
1.2.3 排便量和粪便含水量检测
造模期间隔日采集大鼠在应激箱1 h内的粪便,记录颗粒数并称重,质量记为M1。然后置于70℃烘箱内烘烤6 h,再次称干重,质量记为M2。粪便含水量计算公式为:
粪便含水量=(M1-M2)/M1×100%
1.2.4 直肠扩张气囊组装
将8号儿童导尿管顶端剪除,在剪口处加热使其钝化,将定制的橡胶气囊套于导尿管顶部,0号手术线扎紧。导尿管用三通阀与50 mL注射器和便携式血压计的导气管相连,连接处严格密封。用注射器推注空气,观察记录气囊形变的压力值为P0,注射器刻度值N0。
1.2.5 腹壁回缩反射(abdominal withdrawal reflex)测定
造模结束后第1天,大鼠禁食12 h,将直肠扩张气囊用石蜡油润滑,轻柔插入肛门,末端距肛门约1 cm,用胶布将导尿管固定于鼠尾根部。将大鼠置入透明有机玻璃盒中,适应10 min后,用注射器以2 mL/s速度向气囊内注气。当注射器刻度接近N0时推注速度降为0.5 mL/s,同时观察大鼠腹壁。当腹部肌肉收缩时,标记为疼痛压力阈值。所得压力值减去球囊形变压力P0为真实压力阈值。每只大鼠重复操作3次,每次操作间隔2 min,取平均值。
1.2.6 动物取材
在造模第4天、第7天、第10天以及造模结束后第1天,待大鼠于造模箱内应激1 h后,分别抽取尾静脉血0.5 mL置于1.5 mL离心管中。所有血液标本4℃静置过夜后,3000 r/min匀速离心15 min,取血清备用,用于血清CRF、ACTH、CORT、5-HT等检测。造模结束后第1天尾静脉取血后,用2%戊巴比妥钠腹腔注射麻醉大鼠,颈椎脱臼处死。剖腹,剪取距肛门5 cm以上的结肠组织4 cm,沿肠系膜纵向剖开,用磷酸盐缓冲液漂洗,分成2等分,一段置入4%甲醛溶液中固定,用于病理检查;另一段称量50 mg,匀浆后用于ELISA检测肠组织5-HT。
1.3 统计学方法
2 结果
2.1 大鼠一般行为和体重比较
造模期间各组大鼠毛发光泽浓密,饮食及体重增加稳定。三组大鼠体重比较见表 1,差异无显著性(P> 0.05)。NC组大鼠活动自如,FSS组和WAS组大鼠受水环境和电击应激环境影响,均表现出精神紧张,活动谨慎及异常排便等应激行为。
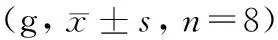
表1 大鼠体重变化Table 1 Changes of body weight in the rats
注:三组间体重比较采用重复测量方差分析。
Note. Repeated measures. ANOVA is used to compare the changes of body weight among the three groups.
2.2 粪便颗粒数和含水量比较
造模期间大鼠排便颗粒数和粪便含水量结果见表2和表3。FSS组和WAS组大鼠经过应激刺激后,排便量明显增多,组间比较,差异有显著性(P< 0.05)。NC组大鼠对应激箱环境能较好地适应,粪便颗粒数稳定,组内不同时间点比较,差异无显著性(P> 0.05)。WAS组组内不同时间点比较,粪便颗粒数逐渐减少,差异有显著性(P< 0.05),在相同时间点避水组与正常组比较,从第7天起排便量相当,差异无显著性(P> 0.05)。FSS组排便颗粒数和粪便含水量增加明显而稳定,组内比较差异无显著性(P> 0.05),排便颗粒数在相同时间点与NC组和WAS组比较,差异有显著性(P< 0.05)。WAS组因排便颗粒沾水,无法有效获取粪便及测量其含水量。
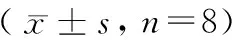
表2 大鼠排便颗粒数比较Table 2 Comparison of the number of stool particles (n) in the rats
注:与正常对照组比较,*P< 0.05;与避水应激组比较,#P< 0.05。(下表同)
Note. Compared with the NC group,*P< 0.05. Compared with the WAS group,#P< 0.05.(The same in the following tables.)
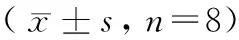
表3 大鼠粪便含水量(%)比较Table 3 Comparison of water content(%)in feces of the
2.3 大鼠直肠疼痛压力阈值比较
造模结束后第1天,检测大鼠直肠敏感性。用自制气囊刺激直肠诱发腹壁回缩反射,记录引起腹部肌肉收缩的气囊压力值,减去气囊形变压力P0,作为疼痛压力阈值。结果FSS组与WAS组的大鼠疼痛阈值较正常组均明显降低,差异有显著性(120.0 ± 7.6 mmHgvs.160± 2.1 mmHg; 148.3 ± 11.7 mmHgvs. 160.2 ± 2.1 mmHg,P< 0.05),且FSS组比WAS组的降低更为明显,存在显著性差异 (120.0 ± 7.6 mmHgvs. 148.3 ± 11.7 mmHg,P< 0.05)。
2.4 大鼠血清CRF、ACTH和CORT浓度比较
大鼠经过应激刺激后,分别在第4天、第7天、第10天检测其血清中CRF、ACTH及CORT激素浓度,结果见表4。WAS组和FSS组大鼠血清CRF、ACTH和CORT在造模第4、第7和第10天均较NC组明显升高,差异有显著性(P< 0.05)。WAS组大鼠血清CRF、ACTH、CORT浓度在第4天升高明显,后逐渐降低,并从7 d起稳定在一定水平,与第10天比较差异无显著性(P> 0.05)。FSS组血清CRF、ACTH浓度逐渐升高,第7天起稳定在较高浓度,与第10天比较,差异无显著性(P> 0.05),但CORT浓度持续升高,第4天、第7天、第10天差异均有显著性(P< 0.05)。
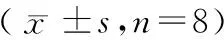
表4 大鼠血清CRF(pg/mL)、ACTH(pg/mL)和CORT(ng/mL)浓度比较Table 4 Comparison of serum concentrations of CRF, ACTH and CORT in the rats
2.5 大鼠血清和组织5-HT浓度比较
造模结束后第1天,检测大鼠血清和结肠组织中5-HT浓度,结果见表5。与NC组比较,FSS组和WAS组大鼠血清和组织5-HT浓度均明显升高,差异有显著性(P< 0.05)。FSS组5-HT浓度较WAS组升高明显,差异有显著性(P< 0.05)。
2.6 结肠黏膜病理表现
三组大鼠结肠黏膜HE染色均未见明显结构异常和炎性细胞浸润,可排除模型动物存在肠道炎症和肠黏膜损伤。(见图1)
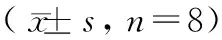

组别Groups结肠Colon血清Serum对照组 NC10.1 ± 0.69.1 ± 0.4电击组 FSS14.9 ± 0.5*#13.1 ± 0.5*#避水组 WAS13.7 ± 0.8*12.4 ± 0.4*

图1 各组大鼠结肠黏膜组织切片(伊红-苏木素染色)Figure 1 Histopathological changes of colon tissue in different groups of the rats (HE staining)
3 讨论
应激诱导法如避水应激[10]、束缚应激[11]、母婴分离[12]等通过人为的生理或心理刺激,间接诱导出肠道痛阈降低等VH表现。这些造模方法所建立的VH模型符合应激可以诱导或者加重VH症状的IBS病理生理机制,且所建立模型的肠道无病理性损伤,因此一直作为经典的造模方法被应用于IBS内脏高敏感性的研究中[13-14]。但是这些应激方法尚存在一些不足之处:如母婴分离法,幼鼠在成年后体长和体重等均一性差,导致其内脏敏感性也存在较大的差异;又如避水应激法,随着应激延长,大鼠会对其产生耐受。还有研究采用不可预知性慢性应激刺激干预大鼠,以求避免应激耐受,但是实验过程复杂,可操作性低[15]。
本研究采用足底电击作为应激刺激构建VH模型。将大鼠放置于特制的足底电击箱内,大鼠足趾作为导体形成回路,电击发生后大鼠跳起,电路瞬间断开。如果大鼠不能躲避,则白炽灯亮起,灯丝发热后电阻迅速增加,电击笼内电压降至安全范围,可使大鼠避免发生电击损伤。实验中的电击条件参照了有关文献[7,16]的报道。在足底电击造模期间大鼠足底皮肤微红,1 h左右可恢复正常,无明显皮损、肿胀等电击伤,符合实验动物福利的3R原则。在造模结束后检测大鼠结肠黏膜并未出现病理损伤表现。本研究中内脏敏感性的评价采取常用的直肠扩张法[6]。造模结束后直肠扩张刺激引发大鼠疼痛的压力阈值明显低于正常对照组。与经典的避水应激法相比,足底电击法模型大鼠肠道疼痛压力阈值降低存在更好的一致性,其指标参数能更好地反映大鼠的VH。
本研究还观察到,在避水应激法造模中,部分大鼠多次落水后对溺水的恐惧感骤减,大鼠的排便数会随造模天数的增加而逐渐减少。避水应激法造模大鼠从第5天起排便粒数明显减少,到第10天已接近于正常组。而足底电击法造模大鼠3 d后可出现排便粒数增多和粪便含水量增加,明显高于正常对照组,而且这一现象可稳定持续到造模结束,更符合IBS大便性状和排便习惯改变的临床特点。
目前认为,应激引起的VH可能与下丘脑-垂体-肾上腺轴(hypothalamic-pituitary-adrenal axis,HPA)密切相关。大脑中枢接收应激刺激信号,引起下丘脑分泌CRF,CRF通过垂体束的门脉系统进入脑垂体前叶,引起ACTH的分泌,ACTH由血液循环运送至肾上腺皮质,引起糖皮质激素的释放[17]。啮齿类动物的糖皮质激素主要成分是CORT。有研究[ 18-19]表明CRF和CORT可分别激活中枢及外周的CRF受体和糖皮质激素受体,直接引起VH。因此CRF、ACTH、CORT等可作为评价大鼠应激水平的重要指标。本研究在造模期间动态检测了各组大鼠血清中CRF、ACTH、CORT等指标,结果显示避水和足底电击两种造模方法均可升高这些指标的血清浓度。但避水组各指标均一性较差,部分结果在造模结束时已接近正常值,提示大鼠对其应激存在一定的耐受。电击组各指标的升高较避水组和正常对照组持久且稳定,不存在应激耐受现象。
5-HT是一种与VH形成密切相关的单胺类神经递质。其约90%由肠嗜铬细胞(enterochromaffin cells,EC)合成,并以旁分泌形式进入肠黏膜中。5-HT既可激活肠道初级神经元,引起肠道蠕动和分泌活动的增强,也可兴奋内脏传入神经,进而引起下游降钙素基因相关肽、P物质等多种神经活性物质的释放,使传入中枢的化学信号异常,引起不适感受,在IBS内脏高敏感性形成过程中发挥重要作用[20]。因此,5-HT也是目前研究IBS治疗药物的重要靶点之一[21]。本研究检测了各组大鼠结肠和血清中5-HT浓度,发现模型大鼠结肠组织和血清中5-HT浓度明显升高,且与内脏敏感性升高一致,与目前已知的研究结果相吻合。应激如何引起EC释放5-HT仍未知。但已有研究[22]发现,EC表面存在肾上腺素受体α2 A,激活后可引起5-HT的释放。应激是否通过增加肾上腺素的释放,进而刺激EC分泌5-HT,最终引起VH,可能是以后研究的新方向。
综上所述,足底电击具有很好的可控性,可成功诱导模型大鼠VH,模型参数均一性和稳定性好,造模成功率高,不易出现应激耐受,并可诱导大鼠排便量和粪便含水量的稳定增加。该应激造模法为研究应激、VH和IBS之间的联系提供了新的造模选择。
参考文献
[1] Drossman DA. Functional gastrointestinal disorders: history, pathophysiology, clinical features and Rome IV [J]. Gastroenterology, 2016,150:1262-1279.
[2] Bradford K, Shih W, Videlock EJ, et al. Association between early adverse life events and irritable bowel syndrome [J].Clin Gastroenterol Hepatol, 2012, 10(4): 385-390.
[3] Van Oudenhove L, Crowell MD, Drossman DA, et al. Biopsychosocial aspects of functional gastrointestinal disorders :How central and environmental processes contribute to the development and expression of functional gastrointestinal disorders[J]. Gastroenterology, 2016,150(6):1355-1367.
[4] Tsang SW, Auyeung KK, Bian ZX, et al. Pathogenesis, experimental models and contemporary pharmacotherapy of irritable bowel syndrome: story about the brain-gut axis [J]. Curr Neuropharmacol, 2016,14(8): 842-856.
[5] Hungin AP, Becher A, Cayley B, et al. Irritable bowel syndrome: an integrated explanatory model for clinical practice [J]. Neurogastroenterol Motil, 2015, 27(6): 750-763.
[6] Keszthelyi D, Troost FJ, Masclee AA. Irritable bowel syndrome: methods, mechanisms, and pathophysiology. Methods to assess visceral hypersensitivity in irritable bowel syndrome [J]. Am J Physiol Gastrointest Liver Physiol, 2012, 303(2):G141-154.
[7] 耿婷婷,汪婷婷,姜劲峰,等,足底电击应激时程对大鼠焦虑样行为的影响[J]. 中国比较医学杂志,2016(01):69-72.
Geng TT, Wang TT, Jiang JF, et al. The influence of footshock stress duration on anxiety-like behavior in rats [J]. Chin J Comp Med, 2016(01): 69-72.
[8] 汤球, 刘志学, 崔淑芳,等.大鼠抑郁症模型的建立与评价[J]. 实验动物科学, 2011, 28(1):6-9.
Tao Q,Liu ZM,Cui SF,et al,Establishment and evaluation of rat model of depression [J]. Lab Anim Sci, 2011, 28(1):6-9.
[9] Bradesi S, Schwetz I, Ennes HS, et al. Repeated exposure to water avoidance stress in rats: a new model for sustained visceral hyperalgesia [J]. Am J Physiol Gastrointest Liver Physiol, 2005, 289(1): G42-53.
[10] Nozu T, Miyagishi S, Nozu R, et al. Water avoidance stress induces visceral hyposensitivity through peripheral corticotropin releasing factor receptor type 2 and central dopamine D2 receptor in rats [J]. Neurogastroenterol Motil, 2016, 28(4): 522-531.
[11] 张北华,王微,王凤云,等,基于不同精神心理应激建立IBS-D大鼠模型的比较研究[J]. 世界中医药,2017(09):2128-2133.
Zhang BH, Wang W, Wang FY, et al. Comparative study of establishment of a rat model of IBS-D based on different psychological stress [J]. World Chin Med. 2017(09): 2128-2133.
[12] O’Mahony SM, Hyland NP, Dinan TG, et al. Maternal separation as a model of brain-gut axis dysfunction [J]. Psychopharmacology (Berl), 2011, 214(1): 71-88.
[13] Jia M, Lu X, Wang Z, et al. Effects of Fengliao-Changweikang in diarrhea-predominant irritable bowel syndrome rats and its mechanism involving colonic motility [J]. J Neurogastroenterol Motil, 2018, 24(3): 479-489.
[14] Kanada Y, Katayama A, Ikemoto H, et al. Inhibitory effect of the Kampo medicinal formula Yokukansan on acute stress-induced defecation in rats [J]. Neuropsychiatr Dis Treat, 2018, 14: 937-944.
[15] 刘晓萌,张荣,董世芬,等.乌灵菌粉贯叶连翘复方制剂干预对慢性不可预知应激大鼠模型抗抑郁作用及机制的研究[J]. 中国比较医学杂志,2016, 26(05):81-86.
Liu XM,,Zhang R, Dong SF, et al. Effects of mixture of Wuling powder and Hypericum perforatum L. on depressed model rats induced by chronic unpredictable stress [J]. Chin J Comp Med, 2016, 26(05): 81-86.
[16] 郭维,孙琪,桂牧微,等.慢性应激损伤对消化系统相关血清肿瘤标志物的影响 [J]. 广东医学,2017(23):3558-3560.
Guo W,Sun Q,Gui MW,et al. Experimental study on the effect of chronic stress damage on serum tumor markers [J].Guangdong Med J 2017(23): 3558-3560.
[17] Smith SM, Vale WW. The role of the hypothalamic-pituitary-adrenal axis in neuroendocrine responses to stress [J]. Dialogues Clin Neurosci, 2006, 8(4): 383-395.
[18] Nozu T, Okumura T. Corticotropin-releasing factor receptor type 1 and type 2 interaction in irritable bowel syndrome [J]. J Gastroenterol, 2015, 50(8): 819-830.
[19] Zhou XP, Sha J, Huang L, et al. Nesfatin-1/NUCB2 in the amygdala influences visceral sensitivity via glucocorticoid and mineralocorticoid receptors in male maternal separation rats [J]. Neurogastroenterol Motil, 2016, 28(10): 1545-1553.
[20] Mawe GM, Coates MD, Moses PL. Review article: Intestinal serotonin signalling in irritable bowel syndrome [J]. Aliment Pharmacol Ther, 2010, 23(8): 1067-1076.
[21] Gershon MD, Tack J. The serotonin signaling system: from basic understanding to drug development for functional GI disorders [J]. Gastroenterology, 2007, 132(1): 397-414.
[22] Bellono NW, Bayrer JR, Leitch DB, et al. Enterochromaffin cells are gut chemosensors that couple to sensory neural pathways [J]. Cell, 2017, 170(1): 185-198.
