白脉软膏含药血浆对大鼠退变滑膜细胞和软骨细胞共培养体系的作用及机制研究
2019-02-28蒋鼎丁道芳韩大鹏翟伟韬欧阳桂林薛艳薛乔曹月龙
蒋鼎, 丁道芳, 韩大鹏, 翟伟韬, 欧阳桂林, 薛艳, 薛乔, 曹月龙
(1.上海中医药大学,上海 201203;2.上海中医药大学附属曙光医院骨伤研究所,上海 201203;3.上海中医药大学康复学院,上海 201203;4.上海中医药研究院光华关节炎研究所,上海 200052;5.西藏奇正藏药股份有限公司,西藏 860000)
骨关节炎是一种以关节软骨退行性变和继发性骨质增生为特征的慢性关节疾病,累及关节软骨乃至整个关节,包括软骨下骨、关节囊、滑膜和关节周围肌肉。骨关节炎病程所涉及的结构中,究竟是何处最早出现病变并导致骨关节炎的问题一直存在争议。近年有不少研究[1-4]表明,滑膜炎症在骨关节炎中起到了重要的作用,滑膜炎在不同程度的骨关节炎患者中皆存在,包括一些仅有前期症状的患者,且滑膜炎与骨关节炎患者疼痛程度以及病情进展有着密切关系。根据不断出现的新的证据,有学者提出滑膜的病变在骨关节炎中也许是病起源头而非以往所认知的病发结果[5]。
奇正白脉软膏根据传统藏医理论研制而成,具有舒筋活络功效,含姜黄、肉豆蔻、甘松、阳起石、甘草、人工麝香、干姜、藏茴香、藏菖蒲、花椒、碱花等成分,常用于白脉病、瘫痪、偏瘫、筋腱强直、外伤引起的经络及筋腱断伤、手足挛急、跛行等病症。既往有研究显示,白脉软膏对骨折愈合、关节扭伤、筋膜炎等疾病有肯定的疗效[6-9],但其对关节炎的治疗作用则需进一步研究。探究退变滑膜细胞对软骨细胞形态、基因表达变化的影响,有助于了解关节炎病程,因此,本研究应用滑膜—软骨共培养体系探讨骨关节炎病理过程以及白脉软膏对其干预作用,以期为其临床防治骨关节炎提供可靠的实验依据,现将研究结果报道如下。
1 材料与方法
1.1实验动物新生SD大鼠8只,体质量(200±20)g,雄性,SPF级,购自上海西普尔—必凯实验动物有限公司,动物质量合格证号:SCXK(沪2013-0016)。
1.2主要药物、试剂与仪器奇正白脉软膏(西藏奇正藏药股份有限公司,批号:151036);扶他林软膏(北京诺华制药有限公司,批号:VP0756)。脂多糖(LPS)(美国Sigma公司);胎牛血清、1640培养基、青链霉素混合液(100×)、2.5 g/L胰蛋白酶-EDTA消化液(法国Biowest公司);白细胞介素1β(IL-1β)、肿瘤坏死因子α(TNF-α)酶联免疫吸附分析(ELISA)试剂盒(台湾Arigo公司);PCR试剂盒(美国Selleck公司);基质金属蛋白酶13(MMP13)、磷酸化核因子κBp65(p-NF-κBp65)、Ⅱ型胶原(COL2A1)抗体(美国 MP Biomedicals公司)。SIGMA离心机(德国Sigma公司);多功能酶标仪(美国BioTek公司);TDZ4-WS离心机(上海卢湘仪离心机仪器有限公司);CO2恒温培养箱(Thermo scientific);IX41显微镜(日本Olympus公司)。
1.3白脉软膏、扶他林软膏含药血浆的制备方法给予大鼠背部剃光毛,将药膏涂于大鼠背部,大鼠每日药量依据文献[10]按照体表面积折算公式进行换算:大鼠每日药量=成人(70 kg)每日药量×0.018=200 g,每日2次,连续3 d。第3 d第2次涂完1 h后,按每100 g大鼠体质量注射0.15 mL(45 μg/g)的戊巴比妥钠,深度麻醉后沿腹部正中线打开腹腔,暴露腹主动脉;应用10 mL一次性注射器缓慢抽吸腹主动脉血,转移到15 mL无菌一次性抗凝离心管中室温静置2 h,3 000 r/min离心20 min,吸取上层血浆,-80℃保存备用[11]。
1.4滑膜细胞与软骨细胞的分离与培养将8只新生24 h SD大鼠用体积分数75%乙醇浸泡5 min后麻醉处死,取出四肢关节处滑膜、软骨组织。将滑膜组织剔除脂肪、血块,磷酸盐缓冲液(PBS)漂洗3次;将标本移入另一新的培养皿中,剪碎滑膜组织,大小不超过1 mm3,吸取滑膜组织点状接种于25 cm2培养瓶底壁,均匀排列,将培养瓶竖立放置;加入5 mL完全培养基,盖上瓶盖,竖立放于37℃、体积分数5%CO2的培养箱中培养4 h,翻转培养瓶,水平放置培养;每3 d更换1次培养基,待细胞单层长满70%~80%后,2.5 g/L胰酶消化,传代。取3~5代生长较好的细胞用于后续实验。软骨组织采用本研究所已成熟的软骨细胞培养方法[12],0.1%的Ⅱ型胶原酶消化1 h,重复3~4次,收集消化的细胞悬液,1 000 r/min,离心10 min后取细胞沉淀,培养于含体积分数10%胎牛血清的培养基中。
1.5 LPS诱导滑膜细胞退变及滑膜细胞形态观察打开大鼠膝关节腔,取出滑膜组织,Ⅰ型胶原酶消化2~3 h,1 000 r/min离心10 min,培养于含体积分数10%胎牛血清的培养基中。待细胞铺满皿底,胰酶消化传代培养,取第1代(P1)细胞进行实验。加入LPS(质量浓度为1 μg/mL)诱导滑膜细胞退变,24 h后在倒置显微镜下观察滑膜细胞的密度与形态。
1.6ELISA检测滑膜细胞上清IL-1β、TNF-α表达分别设立空白组、模型组、西药组、白脉组。空白组:正常滑膜细胞(无LPS诱导);模型组:退变滑膜细胞(LPS诱导);西药组:退变滑膜细胞(LPS诱导)+扶他林软膏血浆干预;白脉组:退变滑膜细胞(LPS诱导)+白脉软膏血浆干预。收集各组细胞上清液,ELISA检测IL-1β和TNF-α表达。具体操作步骤:将样品和配制好的标准品加入96孔板中,标准品及样品均做复孔,每组设3个复孔,重复1次;36℃温育1.5 h;Wash Buffer洗涤5次;标准品和样品孔中分别加入抗体结合物,36℃温育1 h;重复洗涤5次;加入链酶亲和素—HRP,36℃温育30 min;重复洗涤5次;加入TMB试剂,36℃避光温育15 min;加入终止液,终止反应(孔中溶液由蓝色转为黄色);立即以450 nm波长依序测量各孔的吸光度;根据标准品浓度计算出各样本浓度。
1.7退变滑膜细胞和软骨细胞共培养体系及软骨细胞形态学观察LPS诱导滑膜细胞24 h后,撤掉LPS;按常规细胞共培养技术方法将诱导后的大鼠滑膜细胞与大鼠软骨细胞分别接种于Transwell小室的上室和下室,再于细胞培养箱中常规培养。分别设立空白组、模型组、西药组、白脉组。空白组:正常滑膜细胞(无LPS诱导)+正常软骨细胞+正常大鼠血浆干预;模型组:退变滑膜细胞(LPS诱导)+正常软骨细胞组+正常大鼠血浆干预;西药组:退变滑膜细胞(LPS诱导)+正常软骨细胞+西药(扶他林软膏)血浆组干预;白脉组:退变滑膜细胞(LPS诱导)+正常软骨细胞+白脉血浆干预。培养24 h后,观察软骨细胞形态。
1.8实时定量PCR(qPCR)检测共培养体系中MMP3、TNF-α、ADAMTS4、Sox9基因表达退变的滑膜细胞和软骨细胞共培养24 h后,抽提各组共培养体系中的软骨细胞总RNA及浓度测定,取2 μg RNA逆转录,进行qPCR检测。每个样品设置3个复孔,实验重复3次。以甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)作为内参基因,2-△△CT方法可用于定量PCR实验来计算基因表达的相对变化(p),见表1。

表1 引物序列Table 1 Primer sequence
1.9Western blot法检测各组共培养体系中软骨细胞MMP13、p-NF-κBp65、COL2A1的表达情况首先收集蛋白样品:原代细胞培养24 h后裂解细胞和蛋白浓度测定,蛋白变性后备用。蛋白样品电泳和转膜;体积分数10%BSA室温封闭1 h;一抗(1∶1 000稀释)4℃孵育过夜,TBST洗膜4次,每次10 min;二抗(1∶20 000稀释)室温孵育1 h,TBST洗膜4次,每次10 min;化学发光法检测,X胶片曝光显影,采用Image J图像分析管理系统对蛋白条带灰度值进行分析。
1.10统计方法采用SPSS 18.0软件进行数据分析,所有数据以均数±标准差(±s)表示,多组比较采用单因素方差分析,进一步两两比较采用LSD-t检验,以P<0.05为差异有统计学意义。
2 结果
2.1退变滑膜培养及指标检测
2.1.1 滑膜细胞形态观察 培养24 h后,正常滑膜细胞呈多角形(见图1-A),经LPS诱导后滑膜细胞形态明显变细长,呈长梭形(见图1-B)。
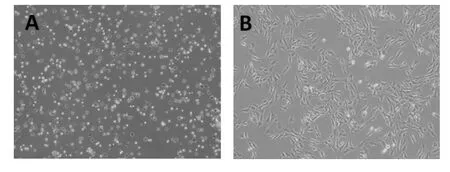
图1 倒置显微镜观察滑膜细胞形态(×100)Figure 1 The morphological features of synoviocytes under inverted microscope(×100)
2.1.2 滑膜细胞上清中IL-1β、TNF-α含量 表2结果显示:与空白组比较,模型组IL-1β、TNF-α含量均显著升高(P<0.05);与模型组比较,白脉组IL-1β、TNF-α含量均显著降低(P<0.05),西药组仅TNF-α含量降低(P<0.05)。
表2 各组滑膜细胞上清中IL-1β、TNF-α含量比较Table 2 Comparison of the contents of IL-1β and TNF-α in the synoviocyte supernatant in various groups[±s,ρ/(pg·mL-1)]

表2 各组滑膜细胞上清中IL-1β、TNF-α含量比较Table 2 Comparison of the contents of IL-1β and TNF-α in the synoviocyte supernatant in various groups[±s,ρ/(pg·mL-1)]
①P<0.05,与空白组比较;②P<0.05,与模型组比较
组别空白组模型组西药组白脉组F P TNF-α 36.645±9.592 62.793±6.716①43.815±4.904②38.787±7.699②5.283 0.015 IL-1β 38.711±6.209 53.055±7.569①46.599±6.369 40.308±3.278②3.256 0.059
2.2共培养体系中退变滑膜细胞对软骨细胞的影响
2.2.1 共培养体系中软骨细胞形态 共培养24 h后观察软骨细胞形态。图2结果显示:与空白组比较,其余3组细胞形态明显细长,呈长梭形改变;与模型组比较,白脉组、西药组软骨细胞形态无明显差异。
2.2.2 共培养体系中软骨细胞基因表达 qPCR法检测各组软骨细胞MMP3、TNF-α、ADAMTS4、Sox9 mRNA表达。图3结果显示:与空白组比较,模型组软骨细胞MMP3、TNF-α、ADAMTS4 mRNA表达明显升高,Sox9 mRNA表达明显降低(P<0.05);与模型组比较,白脉组、西药组MMP3、TNF-α、ADAMTS4 mRNA表达降低,Sox9 mRNA表达升高(P<0.05)。

图2 倒置显微镜观察各组软骨细胞形态(×100)Figure 2 The morphological features of chondrocytes under inverted microscope(×100)
2.2.3 共培养体系中软骨细胞蛋白表达 Western blot法检测各组共培养体系中软骨细胞MMP13、p-NF-κBp65、COL2A1蛋白的表达情况。图4结果显示:与空白组比较,模型组MMP13、p-NF-κBp65表达升高,COL2A1表达降低(P<0.05);与模型组比较,白脉组MMP13、p-NF-κBp65表达降低,COL2A1表达升高(P<0.05),西药组仅COL2A1表达升高(P<0.05)。
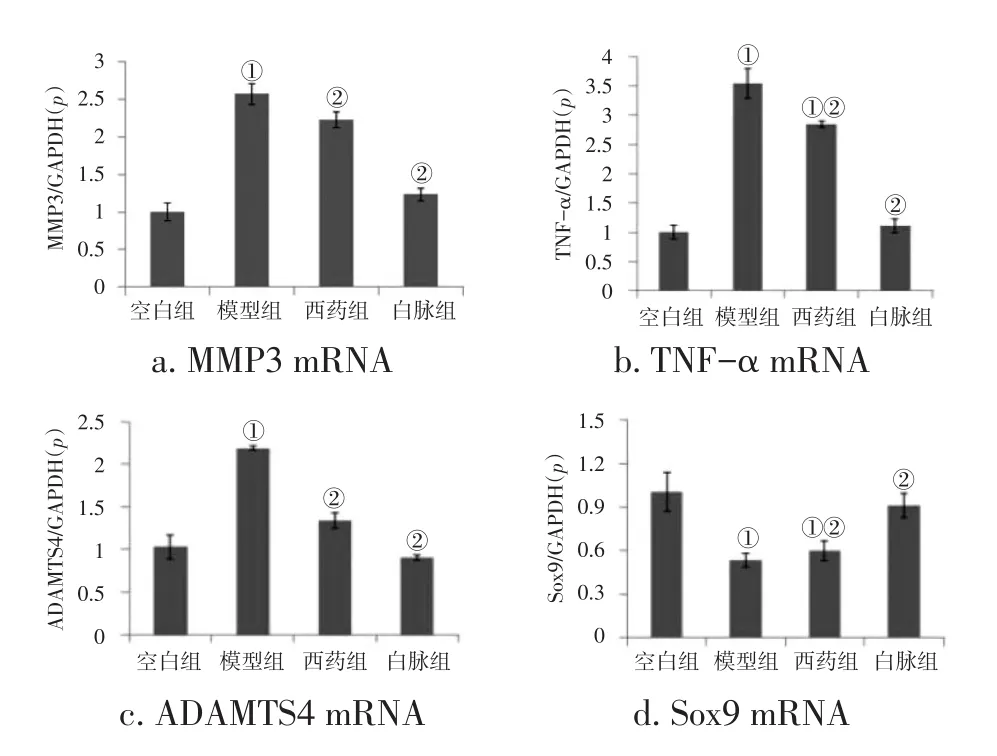
图3 各组软骨细胞MMP3、TNF-α、ADAMTS4、Sox9 mRNA表达比较Figure 3 Comparison of the mRNA expression levels of MMP3,TNF-α,ADAMTS4,and Sox9 in the chondrocytes of various groups
3 讨论
生理情况下,为维持软骨结构的完整,内环境中分解性细胞因子和合成性细胞因子共同作用,二者在体内维持着分解代谢与合成代谢的动态平衡,而滑膜炎症则打破了内环境的平衡从而导致进一步的软骨侵蚀[13]。骨关节炎进程中的起关键作用的细胞因子如IL-1β、TNF-α在滑膜及软骨处皆检测出大量表达[13-15]。诸多证据[4,5]提示,滑膜炎可能先于关节软骨的破坏,为骨关节炎进展的前驱,滑膜退变和软骨退变互相影响形成“滑膜—软骨”轴,滑膜退变是骨关节炎发病的重要因素。本研究观察了退变滑膜细胞对体外培养大鼠软骨细胞的形态、基因表达的影响,在此基础上进一步观察了白脉软膏对“滑膜—软骨”轴的干预作用。
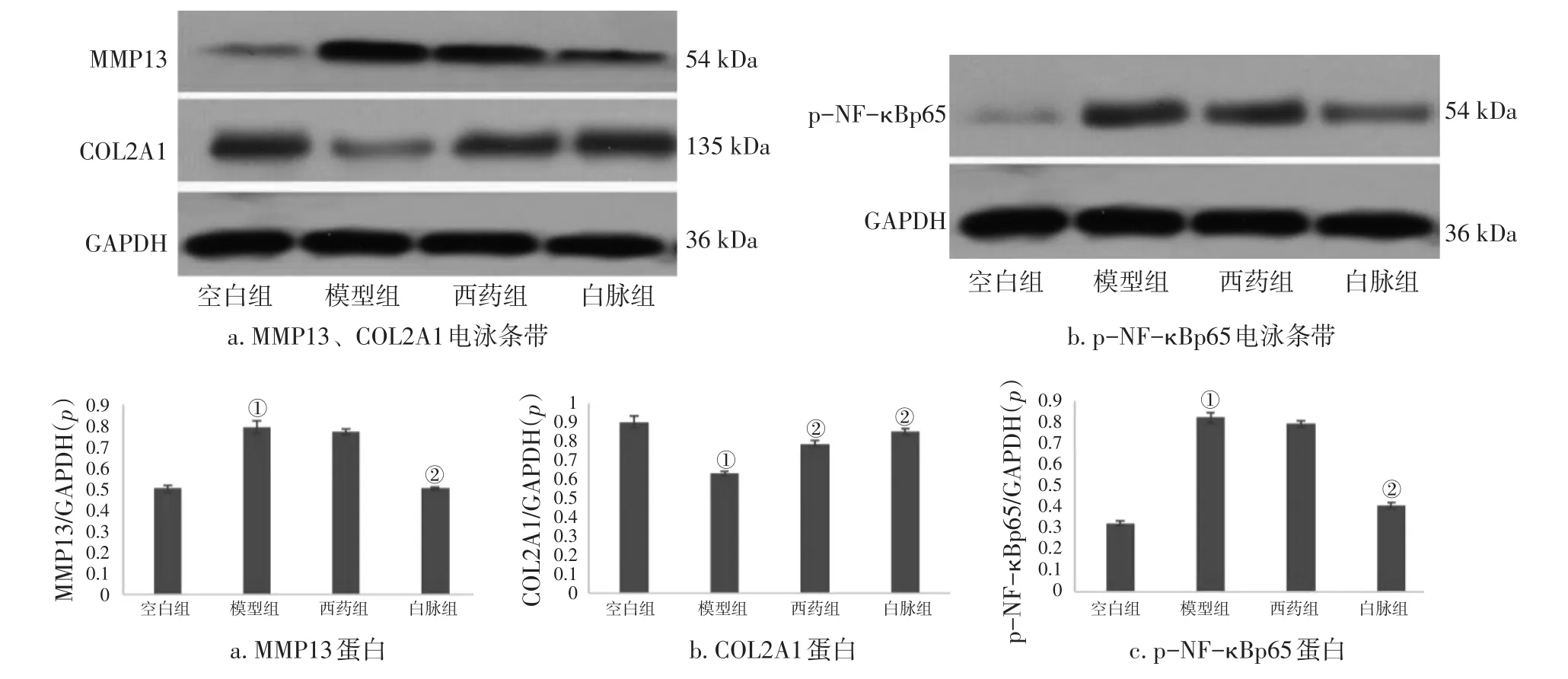
图4 各组软骨细胞MMP13、p-NF-κBp65、COL2A1蛋白表达比较Figure 4 Comparison of the protein expression levels of MMP13,p-NF-κBp65,and COL2A1 in the chondrocytes of various groups
IL-1β和TNF-α是与骨关节炎密切相关的炎症指标[16]。本研究结果显示,经LPS诱导的滑膜细胞在形态上出现明显的成纤维样改变,滑膜细胞上清中IL-1β和TNF-α含量升高,白脉含药血浆可有效下调IL-1β和TNF-α含量。表明LPS诱导后加重了滑膜细胞炎症反应,其形态变化亦与滑膜细胞退变进程符合,而白脉含药血浆能抑制滑膜细胞炎症反应以及退变进程。
骨关节炎发病机制复杂,涉及关节及周围组织多种病理改变,这些病变相互影响并促进了疾病的发展,为了研究其病理机制尚需要提供与体内环境相似的细胞培养环境。细胞共培养体系可模拟体内环境,常应用于骨科相关病理基础研究中[17]。软骨基质的主要成分有水、胶原和蛋白多糖。Ⅱ型胶原(COL2A1)是关节软骨的主要结构成分,MMP3与MMP13皆属于基质降解酶,MMP13被证实为Ⅱ型胶原最有效的降解酶,而IL-1β、TNF-α是软骨降解的有效激活物[16]。聚蛋白多糖酶家族(ADAMTS)为A-can退变的重要影响因素,ADAMTS4被证实与骨关节炎的发展密切相关[18]。Sox9基因能调控软骨细胞Ⅱ型胶原和蛋白多聚糖的表达,抑制软骨降解的作用[19]。NF-κB是广泛存在于真核细胞内的一个核转录因子,其在骨关节炎炎症反应及疾病发生发展过程中起重要作用,与软骨降解和关节损伤密切相关[20,21]。退变滑膜细胞与软骨细胞共培养实验结果显示,与空白组比较,模型组软骨细胞表现出明显的形态变化,细胞逐渐细长,呈长梭形改变。软骨细胞失去原有形态特征,这与骨关节炎病程中关节软骨发生成纤维化与肥大化改变一致。与模型组比较,西药组、白脉组软骨细胞的形态无明显差异。提示软骨细胞与退变滑膜细胞共培养后发生退变,扶他林软膏、白脉软膏含药血浆对此形态变化未显示出明显的抑制作用。PCR结果显示:与空白组比较,模型组软骨细胞MMP3、ADAMTS4、TNF-α mRNA表达上调,Sox9mRNA表达下调;与模型组比较,白脉组软骨细胞明显抑制MMP3、TNF-α、ADAMTS4 mRNA表达,并上调Sox9 mRNA表达。说明退变滑膜细胞促进了软骨细胞退变,加重了骨关节炎的病理进展,提示“滑膜—软骨”轴对骨关节炎起促进作用,而白脉含药血浆对此病理过程有明显抑制作用。Western blot结果显示:与空白组比较,模型组MMP13、p-NF-κBp65蛋白表达上调,明显抑制COL2A1蛋白表达;与模型组比较,白脉组MMP13、p-NF-κBp65表达上调,COL2A1表达下调。表明白脉软膏含药血浆可能通过抑制p-NF-κBp65表达,减轻骨关节炎炎症反应,调控“滑膜—软骨”轴,从而抑制软骨破坏。提示白脉软膏有明显的软骨保护作用,对“滑膜—软骨”轴起抑制作用。
从白脉软膏配方组成来看,姜黄破血行气、通经止痛,肉豆蔻温中止痛,甘松行气止痛,麝香活血止痛,干姜、茴香散寒止痛,藏菖蒲散热消肿,花椒散寒祛痹,阳起石补虚祛痹,甘草调和诸药、缓急止痛。诸药合制,共奏活血止痛、舒筋消肿之效。其舒筋活络止痛的功效亦与骨关节炎中医临床治疗相对应。
综上所述,“滑膜—软骨”轴中滑膜细胞的变化在滑膜病变中起着重要作用,其退变可影响软骨细胞形态及基因表达,滑膜的退变可促进骨关节炎的发展。白脉软膏对“滑膜—软骨”轴有着明显的抑制作用,其作用机制可能与减轻滑膜细胞炎症反应,抑制软骨细胞NF-κB活化,降低“滑膜—软骨”轴中各降解性细胞因子的表达有关。
