金针菇退化菌株复壮条件的优化初探
2019-02-28李雪飞佟希丹李长田付永平
李雪飞 佟希丹 李长田 付永平 宋 冰 李 玉
金针菇退化菌株复壮条件的优化初探
李雪飞 佟希丹 李长田 付永平 宋 冰*李 玉*
(吉林农业大学食药用菌教育部工程研究中心,吉林 长春 130118)
金针菇在工厂化栽培的过程中,经常出现菌种退化问题,严重影响产量和质量。试以金针菇的退化菌株为材料,通过组织分离、菌丝尖端分离的方法进行复壮,通过接种在4种不同培养基质上进行生长速度测定,筛选最适合金针菇复壮菌株生长的基质,并考察不同光质对复壮菌株生长的影响。结果表明:构树基质可以促进金针菇复壮菌株生长;相对于白光和红光,蓝光更有利于金针菇复壮菌株的生长,并在一定程度上提高了产量。
金针菇;退化菌株;复壮;培养基质;光质
金针菇()又名构菌、冬菇、毛柄金钱菌等[1-2]。其颜色有白色、褐色和淡黄色,是我国重要的栽培食用菌之一,有较高的经济价值和营养价值,且因独特的口感和风味,备受人们的喜爱。相比其他菇种,金针菇较早实现大规模工厂化周年栽培。
金针菇生长过程中,需要适宜的温度、湿度、光照和CO2等条件。其属于厌氧型食用菌品种,对光照要求不严格,在光照或黑暗条件下均能形成子实体,而子实体形态和产量则有一定差异[3]。有研究表明,适宜的光质(颜色)在一定程度上可以提高其产量[4-5]。
金针菇在工厂化栽培过程中,经常出现菌丝老化、菌种退化,出菇不整齐,出菇延迟,产量严重下降。造成菌种退化的原因较多,包括核型改变、基因突变、菌株无性繁殖体感染病毒、细胞内酶合成能力下降等,此外还有菌种自身遗传多样性、营养不良、无限传代、长期低温保藏等因素[6]。在金针菇工厂化栽培的过程中,感染病毒是造成菌种退化的主要原因之一。国内外研究多次证实,感染病毒的金针菇会出现菌丝生长变弱[7]、子实体褐化的现象[8],并且由于病毒的潜隐期长、发病症状不明显等导致病毒病害不易被察觉,一旦爆发将造成巨大的损失[9]。
菌种退化分为可逆和不可逆两类,可逆的退化可通过提纯复壮恢复优良特性,生产上常采用菌丝尖端分离和原生质体再生的方法进行提纯复壮[10]。研究表明,在金针菇工厂化栽培中使用组织分离法提纯复壮效果显著[11];王玉、张沿江的研究均表明在食用菌菌种复壮过程中,更换培养基基质后菌种活性和成活率均有提升[12-13];张俊玲使用菌丝尖端分离法对金针菇菌株进行复壮处理后收到显著效果[14]。
本文以金针菇的退化菌株为主要试验材料,利用简便易行的菌丝尖端分离法进行复壮处理,并在不同培养基上进行复壮培养,将获得的复壮菌株在不同光质下进行出菇栽培实验,以期筛选获得金针菇退化菌株适宜的复壮培养基和光照条件。
1 材料与方法
1.1 供试菌株
退化菌株白色金针菇品种沈金2号和黄色金针菇品种川6号,由吉林农业大学提供。
1.2 培养基
(1)基础培养基。①PDA培养基:马铃薯200 g/L,葡萄糖20 g/L,琼脂20 g/L,MgSO41.5 g/L,KH2PO43 g/L,维生素B 10 mg/L,水1 000 mL,pH自然。②PDB液体培养基:马铃薯200 g/L,葡萄糖20 g/L,水1 000 mL,pH自然。
(2)复壮培养基。①CK培养基:马铃薯200 g/L,葡萄糖20 g/L,琼脂20 g/L,MgSO41.5 g/L,KH2PO43 g/L,维生素B 10 mg/L,麸皮50 g/L,水1 000 mL。②构树培养基:马铃薯200 g/L,葡萄糖20 g/L,琼脂20 g/L,MgSO41.5 g/L,KH2PO43 g/L,维生素B 10 mg/L,麸皮50 g/L,构树木屑10 g/L,水1 000 mL。③燕麦培养基:马铃薯200 g/L,葡萄糖20 g/L,琼脂20 g/L,MgSO41.5 g/L,KH2PO43 g/L,维生素B 10 mg/L,麸皮50 g/L,燕麦10 g/L,水1 000 mL。④玉米粉培养基:马铃薯200 g/L,葡萄糖20 g/L,琼脂20 g/L,MgSO41.5 g/L,KH2PO43 g/L,维生素B 10 mg/L,麸皮50 g/L,玉米粉10 g/L,水1 000 mL。
1.3 组织分离法制备菌种
将两个退化菌株分别进行组织分离,在超净工作台内取菌柄与菌盖连接处的菌肉置于含有PDA培养基的培养皿上,24 ℃恒温培养箱内避光培养,获取金针菇退化菌种待用。
1.4 菌丝尖端分离法复壮金针菇退化菌株
(1)用打孔器分别取两退化菌株菌落边缘菌块(直径0.5 cm)置于PDA培养基上,获得白色品种复壮一代,黄色品种复壮一代。与此同时选取退化菌株中间菌落置于PDA培养基上,获得白色原种和黄色原种,将所有接有菌块的培养皿置于24 ℃恒温培养箱中进行避光培养,观察并记录菌丝的长势。
(2)待菌落长到一定体积后,对黄色、白色复壮一代进行菌丝尖端分离,获得白色、黄色复壮二代;并对白色、黄色原种进行扩繁,置于24 ℃恒温培养箱中进行避光培养,观察并记录菌丝长势。重复以上步骤,获得复壮三代和同期原种。
1.5 测量不同培养基菌丝生长速率
用打孔器分别在所获得的复壮三代和原种中取同一位置菌块接种于提前准备好的4种复壮培养基的正中央,每组设置3个重复,置于24 ℃恒温培养箱内进行避光培养。与此同时,采取十字交叉法划线,连续一周每天测量菌落大小,并记录实验数据,以便计算菌丝生长速率。
1.6 栽培出菇
将所获得的退化菌株原种和白色、黄色复壮菌株在无菌条件下用打孔器取6~7个菌块分别接种于提前准备好的PDB液体培养基中,做好标记,置于振荡频率为200 r/min的恒温摇床中培养6~7天获得液体菌种,4 ℃下保存待用。
栽培瓶规格为直径7 cm,高12 cm,装料高压灭菌冷却后置于超净工作台上消毒接种,每瓶接入液体菌种约10 mL。接菌后,置于24 ℃下避光培养,待菌瓶菌丝长满后,搔菌,移入出菇室的暗箱中进行出菇管理。
出菇室温度控制在15 ℃,空气相对湿度80%~90%,同时设置白、红、蓝三色光处理,白色光为对照,每天光照时间8 h,观察子实体的生长情况,记录原基个数并进行观察。待子实体成熟后,测定菌柄长度、粗细、菌盖直径和单瓶产量等商品性状。
2 结果与分析
2.1 不同复壮培养基对复壮菌株生长的影响
通过比较金针菇复壮菌株与原种退化菌株在各培养基上的生长速率(表1)发现,在构树培养基中各菌株菌丝生长速率均较快,两个品种复壮之后菌丝生长速度明显加快,且黄色品种菌丝生长速率较白色品种快,复壮效果更为明显。
通过不同培养基菌丝长势方差分析,得出构树培养基所对应的Sig.=0.047<0.05,说明其对菌丝长势具有显著性影响,而玉米培养基和燕麦培养基对应Sig.值均>0.05,说明对菌丝长势均没有显著影响。
通过比对金针菇复壮菌株与原种退化菌株生长性状(表2),可看出复壮菌株各性状均有改良,其中子实体原基个数、生物学效率增加明显。生物学效率相比原种退化菌株,黄色品种提高17%,原基数增加20个,子实体重增加2.2 g;白色品种提高13%,原基数增加12个,子实体重提高2.7 g。
2.2 不同光质对复壮菌株的影响
通过比较金针菇复壮菌株与原种退化菌株在各光照处理下的子实体性状(表3),得出两个复壮菌株的各项性状均优于原种退化菌株,而蓝光处理组子实体重和原基数目均优于红、白光处理。
3 结论与讨论
3.1 结论
本研究采用组织分离法和菌丝尖端分离法对菌株进行复壮。将金针菇两个品种分别置于4种复壮培养基内进行培养,并通过对菌丝生长速度的测量比对,得出结论:在复壮方法为菌丝尖端分离时,添加构树木屑的培养基菌丝生长速率较快。由此推测,构树木屑含有更有利于菌丝生长的营养成分,且金针菇黄色品种较白色品种复壮效果显著。
复壮处理后对原种退化菌株和复壮菌株在不同光照下进行出菇栽培实验,复壮菌株与原种退化菌株相比:黄色品种生物学效率提高17%,原基数增加20个,子实体重提高2.2 g;白色品种生物学效率提高13%,原基数增加12个,子实体重提高2.7 g。得出结论:金针菇复壮菌株的各项指标均优于原种退化菌株,且在三色光中,蓝色光照射处理的子实体重以及原基数量均有所提高,优于白光、红光的处理效果。
3.2 讨论
目前,金针菇主要为工厂化周年栽培生产,若想保证其产量及质量,就必须从源头发现并及时解决问题,保证菌种的质量。但由于菌种的长时间保存和多次扩繁,均在一定程度上导致活力下降,影响产品产量和质量。为此需要对金针菇的菌种进行复壮,增强其活力。
菌种退化除了病毒感染的原因外,还有营养不良、无限传代、菌种保藏不当等原因[15]。因此不能考虑单一因素,而要齐头并进,从小处着手。对退化菌种,可采取及时剔除、定期分离纯化、创造适合的培养基质及环境条件、控制菌种的传代次数、更换不同的培养基质等措施[16]。食用菌菌株的复壮方法主要有传统的组织分离法、菌丝尖端分离法、原生质体再生法等。相比原生质体再生法,菌丝尖端分离法容易得到纯的提纯复壮的菌株;若将退化的菌株直接进行原生质体再生,无疑增加了筛选的工作量,也很难达到满意的效果。本实验采用的菌丝尖端分离法具有操作简单、转化效率高、不需要特殊的仪器设备等优点,目前最为常用。
本研究所进行的栽培实验为小批量实验,初步断定在金针菇的栽培过程中,蓝色光源为有利光源,在一定程度上促进生长,提高产量。但是光源应用也需讲究,否则会有相反的作用。2012年,佟希丹报道,不同品种在不同时期用不同光照照射不同时间,对金针菇的生长均有不同的影响[17]。在今后的研究中,应考虑在金针菇生长不同时期的不同光照强度以及复合光的应用。金针菇工厂化周年生产,把补充光源的范围和密度作为一个变量考虑进去,在保证节约能源的前提下可提高产量,增加收入。
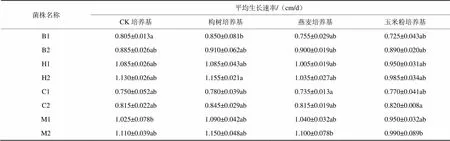
表1 金针菇复壮菌株与原种退化菌株在各培养基上的生长速率比较
注:B1标记为组织分离培养所得样本白色退化菌株,B2标记为组织分离培养所得样本白色复壮菌株;H1标记为组织分离培养所得样本黄色退化菌株,H2标记为组织分离培养所得样本黄色复壮菌株;C1标记为菌料中菌丝培养所得样本白色退化菌株,C2标记为菌料中菌丝培养所得样本白色复壮菌株;M1标记为菌料中菌丝培养所得样本黄色退化菌株,M2标记为菌料中菌丝培养所得样本黄色复壮菌株。

表2 金针菇复壮菌株与原种退化菌株生长性状比对
注:B1标记为白色退化菌株,B2标记为白色复壮菌株;H1标记为黄色退化菌株,H2标记为黄色复壮菌株。
生物学效率=(子实体鲜重/培养料干重)×100%。
“+”越多表示子实体整齐度越好。

表3 金针菇复壮菌株与原种退化菌株在各色光照处理下的子实体性状
注:B1标记为白色退化菌株,B2标记为白色复壮菌株;H1标记为黄色退化菌株,H2标记为黄色复壮菌株。
“+”越多表示子实体整齐度越好。
[1] Wang PM, Liu XB, Dai YC, et al. Phylogeny and species delimitation of Flammulina: taxonomic status of winter mushroom in East Asia and a new European species identified using an integrated approach[J]. Mycological Progress, 2018(7): 1-18.
[2] 戴玉成, 杨祝良. 中国五种重要食用菌学名新注[J/OL].菌物学报: 1-6[2018-12-11]. https://doi.org/10.13346/j. mycosystema.180117.
[3] 钱磊, 张志军, 周永斌, 等. 光对食用菌生长的影响[J]. 天津农业科学, 2017, 23(7): 103-106.
[4] 刘明月, 何长征. 光质对金针菇子实体生长发育的影响[J]. 中国食用菌, 1997(6): 11-13.
[5]张杨. 金针菇的光效应[J]. 食用菌, 1984(1): 29.
[6] 李亚娇, 郭九峰. 食用菌菌种退化机制及预防措施的最新研究进展[J]. 黑龙江农业科学, 2018(2): 136-139.
[7] Magae Y, Hayashi N. Double-stranded RNA and virus-like particles in the edible basidiomycete Flammulina velutipes(Enokitake)[J]. FEMS microbiology Letters, 1999, 180(2): 331-335.
[8] Magae Y, Sunagawa M. Characterization of a mycovirus associated with the brown discoloratin of edible mushroom, Flammulina velutipes[J]. Virology Journal, 2010(7): 342.
[9] 张俊玲, 章炉军, 尚晓冬, 等. 主栽金针菇品种中病毒的快速检测和鉴定[J]. 中国农学通报, 2015, 31(6): 234-240.
[10] 刘昆昂, 张根伟, 马宏, 等. 黄色金针菇菌株提纯复壮技术研究[J]. 食用菌, 2017, 39(2):21-23.
[11] 陈志松. 工厂化栽培金针菇菌种退化与复壮的研究[J].中国食用菌, 1998(05): 10.
[12] 周君强. 食用菌菌种复壮四法[J]. 吉林农业, 2007(03): 38.
[13] 张沿江, 张翠艳, 吴金玉. 食用菌菌种复壮的方法[J]. 农村科学实验, 2003(5): 34.
[14]张俊玲, 章炉军, 刘建辉, 等. 金针菇褐化病毒(FvBV)脱毒方法[J]. 微生物学通报, 2015, 42(10): 1952-1961.
[15] 姚卫红, 张丽娜, 刘美秀. 浅谈菌种的退化及有效包藏方法[J]. 中国卫生产业, 2013(3): 189-189.
[16] 赫朝灿. 菌种退化的原因、处理措施及菌种保藏探析[J]. 生物技术世界, 2015(2): 1.
[17] 佟希丹. 不同光质LED对黄白品种金针菇商品性状与产量的影响[D]. 长春: 吉林农业大学, 2012.
Preliminary study onoptimization of conditions for rejuvenation of degenerated strains of
Li Xuefei Tong Xidan Li Changtian Fu Yongping Song Bing*Li Yu*
(Engineering Research Center of Chinese Ministry of Education for Edible and Medicinal Fungi, College of Agronomy, Jilin Agricultural University, Changchun 130118, JilinProvince, China)
Industrial cultivation ofstrains are often affected by degeneration leading to yield and quality loss. In this study, two degenerated strains ofwere used as starter materials from which rejuvenated strains were obtained by tissue and mycelial tip isolation technique. The most suitable media for reviving the growth of the degenerated strains was screened by measuring their growth rate on four different media, and the effects of different light quality on their growth were also investigated.The results showed that a media prepared fromin addition to blue light was the best in rejuvenating the growth of degenerated strains ofand increased their yield to a certain extent. This rejuvenation method will provide technical support for commercial production of, as well as in the preservation of strains.
; Degenerated strains; Rejuvenation; Illumination
S646
B
2095-0934(2019)01-052-05
长春市科技局资助项目(15SS11),公益性行业(农业)科研专项(No.201503137);吉林省教育厅项目(No.JJKH20180670KJ);高等学校学科创新引智计划资助项目(No.D17014)
,E-mail:yuli@126.com(李玉);song19800123@126.com(宋冰)。
