27nt-miRNA对血管平滑肌细胞SM22α表达的调节及其对细胞活力、迁移和表型改变的影响*
2019-02-28陶晓静颜渊鸳罗雪兰秦祖杰覃裕旺欧和生
沈 凤, 杨 鹏, 陶晓静, 李 丹, 颜渊鸳, 罗雪兰, 秦祖杰, 覃裕旺△, 欧和生, △
(1广西医科大学药学院, 广西 南宁 530021; 2广西中医药大学附属广西国际壮医医院, 广西 南宁 530001)
血管平滑肌细胞(vascular smooth muscle cells,VSMCs)是维持血管正常生理功能的重要细胞。在正常情况下,VSMCs呈非增殖性的收缩型,在血管损伤和一些生物活性物质(如一氧化氮产物、血管紧张素Ⅱ和血小板生长因子等)刺激的情况下,VSMCs转化为增殖性的合成表型,合成并分泌血管活性物质和生长因子等,并发生增殖和迁移,从而导致血管壁增厚、管腔狭窄和血管重构。血小板源性生长因子(platelet-derived growth factor,PDGF)是一种重要的促细胞分裂原,主要有AA、 BB 及AB 3种形式,其中 PDGF-BB 可与 VSMCs 表面的 PDGF-β受体结合以激活多条信号通路,诱导细胞发生表型转换、增殖和迁移。VSMCs表型转换及增殖是高血压和动脉粥样硬化等血管增殖性疾病发生发展过程的重要因素[1]。
微小RNAs(microRNAs,miRNAs,miR)是一类内源性非编码小分子RNA,它们通过抑制翻译过程或者促进靶目标mRNA降解参与胚胎发育、细胞分化、血管生成和肿瘤形成等几乎所有病理生理过程。近年来发现miRNAs参与心血管系统疾病的调控过程,并且在血管重构过程发挥重要作用,如miR-145/143可以抑制VSMCs增殖、促进其分化,减少血管新内膜的形成[2];而miR-34a通过调节Notch表达水平抑制VSMCs增殖和迁移,并减少内膜增生[3]。27nt-miRNA来源于内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)基因第 4 内含子中的 27 碱基重复序列,本课题组前期工作提示27nt-miRNA可能在心血管疾病的发生发展中发挥重要作用,内含子源性27nt-miRNA一方面可以抑制内皮细胞的增殖和迁移;另一方面,高表达27nt-miRNA可以抑制内皮细胞代谢产生和释放一氧化氮(nitric oxide,NO)[4]。由于NO不仅是调节血管舒张功能的重要因子,而且参与VSMCs增殖、迁移和表型改变的调节[5],因此,本研究推测27nt-miRNA可能通过对组织特异性基因的表达调节,参与VSMCs增殖及其表型改变的调控过程。为证实这一观点,本实验选取大鼠主动脉血管平滑肌细胞为研究对象,构建27nt-miRNA慢病毒载体,然后转染VSMCs,检测VSMCs收缩型标志物平滑肌22α蛋白(smooth muscle 22α protein, SM22α)的表达水平,并观察VSMCs形态、细胞活力和迁移能力的变化。
材 料 和 方 法
1 细胞和试剂
大鼠原代主动脉血管平滑肌细胞(武汉普诺赛生命科技有限公司);DMEM培养基(Gibco);胎牛血清(Lonsera);胰蛋白酶消化液(Gibco);重组人PDGF-BB (PeproTech);MTT(北京索莱宝科技有限公司);RNA提取试剂盒(北京百泰克生物技术有限公司);逆转录试剂盒(MBI);PCR试剂盒(天根生化科技有限公司);慢病毒载体(上海吉凯基因化学技术有限公司);兔抗SM22α和GAPDH抗体(Proteintech)。
2 方法
2.127nt-miRNA慢病毒载体的构建和鉴定 以eNOS第4内含子中27碱基重复序列5’-GAAGTCTAGACCTGCTGCAGGGGTGAG-3’为根据,设计miRNA的发夹结构,以Ubi-MCS-BFLAG-SV40-EGFP-IRES-puromycin为载体,经AgeI和NheI双酶切,转染 293FT细胞,浓缩得到27nt-miRNA高表达慢病毒载体mimic 27nt-miRNA,同时根据发夹结构构建27nt-miRNA反义序列(anti-27nt-miRNA)和阴性对照(negative control,NC)慢病毒载体。病毒载体上含有嘌呤霉素抗性,可用来识别细胞转染是否成功,加入嘌呤霉素进行筛选,建立稳定细胞株。
2.2大鼠原代血管平滑肌细胞的培养和转染 VSMCs用含15%胎牛血清、青霉素(1×105U/L)和链霉素(100 mg/L)的DMEM培养基进行培养,放置于37 ℃、5% CO2恒温饱和湿度培养箱中,待细胞密度>85%时,倾去培养液,用 PBS洗涤细胞。加入0.25%胰蛋白酶进行消化,37 ℃放置1~2 min后再加入2 mL含15% FBS的DMEM培养液,吹打使细胞形成单细胞悬液。按每孔5×105细胞的浓度接种6孔板,混匀后正常静置培养24 h。上述3种慢病毒载体以MOI=70感染VSMCs,置于培养箱孵育48 h,在倒置荧光显微镜下观察荧光表达情况,加入嘌呤霉素(8 mg/L)进行筛选。实验分为5组:(1)正常(normal)组:VSMCs正常培养;(2)PDGF-BB组:VSMCs加入终浓度为10 μg/L的PDGF-BB;(3)PDGF-BB+mimic 27nt-miRNA组:往成功转染27nt-miRNA过表达慢病毒载体的细胞株加入终浓度10 μg/L的PDGF-BB;(4)PDGF-BB+NC组:向成功转染阴性对照慢病毒载体的细胞株加入10 μg/L的PDGF-BB;(5) PDGF-BB+anti-27nt-miRNA组:向成功转染anti-27nt-miRNA的细胞株加入10 μg/L的PDGF-BB。
2.3MTT法检测细胞活力 成功转染后,除正常组外其它4组都加入10 μg/L PDGF-BB,然后取对数生长期的细胞以每孔6×103个细胞接种到96孔板中,放置37 ℃、5% CO2恒温培养箱培养。待细胞密度达到50%时更换无血清的培养基,继续培养24 h。后加入MTT培养4 h,使用酶联免疫检测仪在490 nm波长处测每孔的吸光度(A)值。
2.4划痕实验检测各组VSMCs的迁移能力 通过细胞划痕实验检测27nt-miRNA对VSMCs的迁移能力的影响。各组细胞接种到48孔板中,每孔2×104个,置于37 ℃、5% CO2细胞恒温培养箱中培养至细胞基本达到100%融合,用200 μL移液枪及枪头在培养板底部正中位置划“一”字痕,弃去原有培养基,并用无菌PBS洗去划落的细胞及碎片,重复2~3次。后每孔加入无血清的DMEM培养基200 μL,置于培养箱中继续分别培养 0 h和24 h,应用倒置电子显微镜观察不同时点细胞迁移愈合的情况,迁移率(%)=(0 h划痕宽度-24 h划痕宽度)/0 h划痕宽度×100%,实验重复3 次,取平均值。
2.5RT-PCR 检测细胞 SM22α的mRNA 表达 根据TRIzol 试剂盒说明书提取各组细胞的总RNA,利用 Primer 5.0 软件设计合成引物,SM22α的上游引物序列为5’-CGTGGAGATCCCAACTGGTTTATG-3’, 下游引物序列为5’-CCCTCTGTTGCTGCCCATTTG-3’; GAPDH的上游引物序列为5’-GATGACATCAAGAAGGTGGTGA-3’, 下游引物序列为5’-ACCCTGTTGCTGTAGCCATATTC-3’。分别取各组细胞RNA 1 μg,加入1 μL(0.5 g/L)Oligo(dT)18Primer,70 ℃变性 5 min后立即放置冰上冷却;加4 μL 5×Reaction Buffer、1 μL Ribo LockTMRibonuclease Inhibitor(2.0×107U/L)、2 μL dNTP Mix(10 mmol/L),37 ℃温育5 min,加入1 μL逆转录酶,42 ℃ 1 h,后70 ℃ 10 min终止反应,得到cDNA 第1 链。PCR 扩增反应条件为94 ℃预变性 5 min;94℃ 30 s、56℃ 1 min、72 ℃ 1 min,30个循环;最后72 ℃ 5 min,终止反应。取 5 μL PCR 产物进行1.5% 琼脂糖凝胶电泳分析。
2.6免疫组化检测各实验组SM22α的表达 将无菌玻片放入 6孔板,将实验细胞消化,取细胞悬液加入6孔板中,每孔加2 mL,摇匀静置,放入37 ℃、5%CO2恒温培养箱培养,24 h后取出玻片放于载玻片上,PBS 冲洗 3 次,中性树胶封片,4%甲醛固定。双蒸水冲洗 3 次,敷Ⅰ抗、Ⅱ抗后显色剂显色。使用显微镜观察、拍照,并计算细胞阳性率。实验重复3 次,取平均值。
2.7Western blot检测SM22α蛋白的表达 将各组细胞裂解,4 ℃、12 000 r/min离心15 min,取上清。各组分别取30 μg蛋白进行SDS-PAGE(10%)分离并转移到PVDF膜上。用脱脂奶粉封闭1 h后加入抗SM22α抗体湿盒过夜(4 ℃)。第2天用TBST冲洗3次,每次10 min,然后加入 II 抗孵育2 h,重复用TBST冲洗3次,每次10 min。最后利用Odyssey红外荧光扫描成像系统(LI-COR)分析蛋白电泳条带的灰度值,计算SM22α蛋白的表达量,以GAPDH为内参照,SM22α相对表达量=SM22α灰度值/GAPDH灰度值。实验重复3次,取平均值。
3 统计学处理
采用SPSS 17.0统计软件进行统计分析。实验重复3次,数据均用均数±标准差(mean±SD)表示,多组间比较用单因素方差分析,组间两两比较采用SNK-q检验。以P<0.05为差异有统计学意义。
结 果
1 27nt-miRNA对PDGF诱导VSMCs活力的影响
细胞成功转染后,用MTT法检测各组细胞24 h的细胞活力,结果显示,与正常对照组比较,PDGF-BB组的A值明显升高(P<0.05),提示PDGF可促进VSMCs的活力;与PDGF-BB+NC组相比,PDGF-BB+mimic 27nt-miRNA组的A值下降,而PDGF-BB+anti-27nt-miRNA组的A值升高(P<0.05),提示27nt-miRNA可以抑制PDGF诱导的VSMCs细胞活力,见图1。
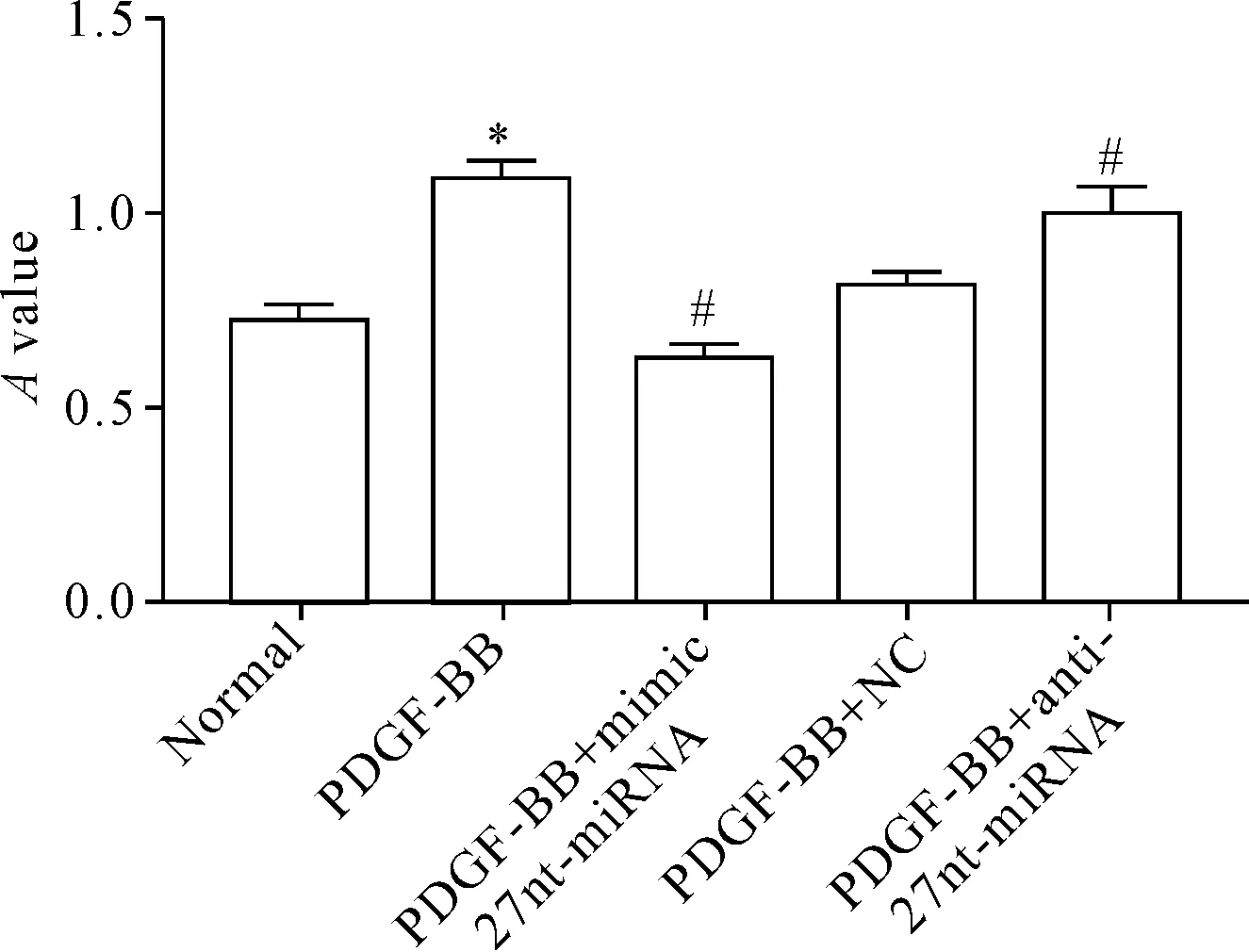
Figure 1.The effect of 27nt-miRNA on the cell viability of VSMCs measured by MTT assay. Mean±SD.n=3.*P<0.05vsnormal group;#P<0.05vsPDGF-BB+NC group.
图1MTT实验检测27nt-miRNA对VSMCs细胞活力的影响
2 27nt-miRNA对PDGF诱导VSMCs迁移的影响
划痕实验检测各组细胞迁移能力,PDGF-BB组的迁移率比正常组升高(P<0.05),PDGF-BB+mimic 27nt-miRNA组的迁移率与PDGF-BB+NC组相比则下降(P<0.05),而PDGF-BB+anti-27nt-miRNA组却比PDGF-BB+NC组上升(P<0.05),提示27nt-miRNA对PDGF诱导VSMCs迁移起到一定的抑制作用,见图2。
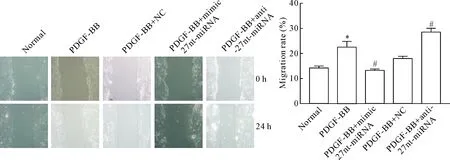
Figure 2.The effect of 27nt-miRNA on the migration ability of VSMCs(×200). Mean±SD.n=3.*P<0.05vsnormal group;#P<0.05vsPDGF-BB+NC group.
图227nt-miRNA对VSMCs迁移能力的影响
3 RT-PCR 检测细胞 SM22α的mRNA 表达
与正常组比较,PDGF-BB组SM22α的mRNA表达量下降(P<0.05);与PDGF-BB+NC组比较,PDGF-BB+mimic 27nt-miRNA组SM22α的mRNA表达量提高,而PDGF-BB+anti-27nt-miRNA组SM22α的mRNA表达量下降(P<0.05),见图3。结果提示27nt-miRNA促进SM22α的转录。
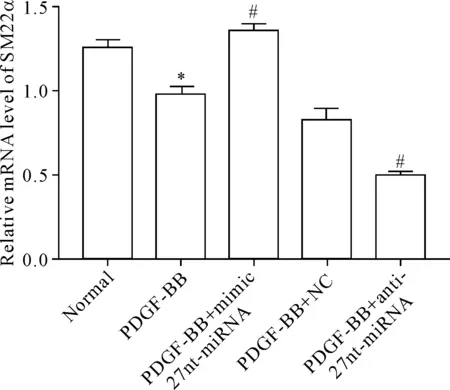
Figure 3.The effect of 27nt-miRNA on the mRNA expression of SM22α in the VSMCs detected by RT-PCR. Mean±SD.n=3.*P<0.05vsnormal group;#P<0.05vsPDGF-BB+NC group.
图3RT-PCR检测27nt-miRNA对SM22αmRNA表达的影响
4 免疫组化检测27nt-miRNA对SM22α表达的影响
用免疫细胞化学染色方法检测各组细胞中的收缩型特异性蛋白SM22α的表达量,结果显示,SM22α蛋白主要在细胞胞浆表达,阳性染色呈棕黄色颗粒。运用IPP6.0软件对SM22α蛋白表达量进行计算,平均吸光度(mean absorbance)越大,SM22α蛋白表达越高。与正常组比较,PDGF-BB组的SM22α表达量下降(P<0.05),提示PDGF-BB可以促进VSMCs的表型转换;PDGF-BB+mimic 27nt-miRNA组的SM22α表达量比PDGF-BB+NC组升高(P<0.05),而与PDGF-BB +NC相比,PDGF-BB+anti-27nt-miRNA组的SM22α表达量下降(P<0.05)。结果提示,27nt-miRNA对PDGF-BB诱导的VSMCs表型转换具有一定的抑制作用,见图4。
5 Western blot检测27nt-miRNA对SM22α蛋白表达的影响
与正常组比较,PDGF-BB组的SM22α表达水平下降(P<0.05);与PDGF-BB + NC组比较,PDGF-BB+mimic 27nt-miRNA组SM22α表达水平提高(P<0.05),而PDGF-BB+anti-27nt-miRNA组的SM22α表达水平下降(P<0.05)。结果提示27nt-miRNA促进VSMCs收缩型特异性蛋白SM22α的表达,见图5。
讨 论
本文通过研究27nt-miRNA对大鼠血管平滑肌细胞的细胞活力、迁移及表型改变的影响,发现27nt-miRNA参与SM22α表达的调控;在调控SM22α表达同时,影响VSMCs的活力以及迁移能力。SM22α是VSMCs收缩型的特异性蛋白之一,PDGF-BB可以促进VSMCs从收缩型转变为合成型,27nt-miRNA高表达可能抑制VSMCs从收缩型转变为合成型。据我们所知,这是首次报道来源于eNOS基因的27nt-miRNA参与VSMCs活力、迁移及表型改变的调控过程。
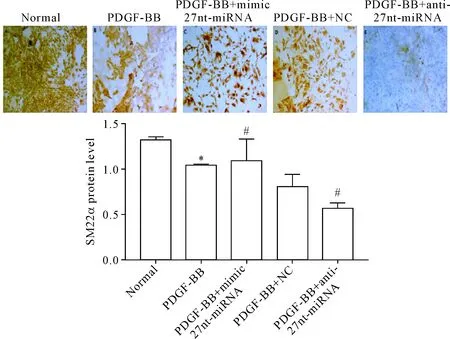
Figure 4.The effect of 27nt-miRNA on the protein expression of SM22α in the VSMCs was detected by immunohistochemistry (×200). Mean±SD.n=3.*P<0.05vsnormal group;#P<0.05vsPDGF-BB+NC group.
图4免疫组化检测27nt-miRNA对细胞SM22α蛋白表达的影响
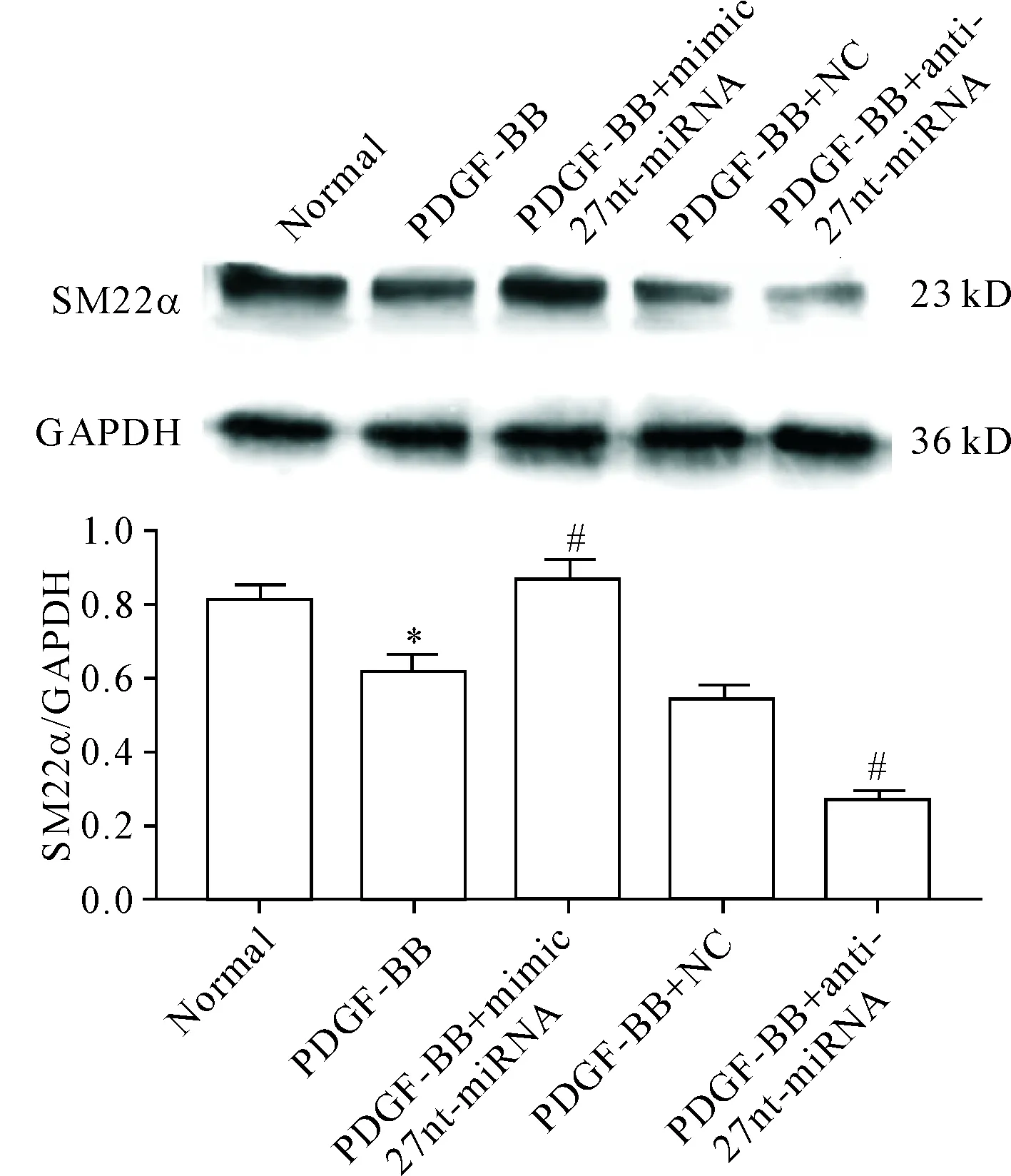
Figure 5.The effect of 27nt-miRNA on the protein expression of SM22α in the VSMCs was detected by Western blot. Mean±SD.n=3.*P<0.05vsnormal group;#P<0.05vsPDGF-BB+NC group.
图5Westernblot检测27nt-miRNA对VSMCs中SM22α蛋白表达的影响
血管平滑肌细胞的功能改变与心血管疾病的发生发展具有密切的关系[6-7]。心血管疾病已成为威胁人类健康的主要疾病之一,高血压、动脉粥样硬化和缺血性脑病等血管增殖性疾病发病率及病死率逐年升高。VSMCs与血管内皮细胞是血管的重要组成成分,血管内皮细胞位于血管内膜,VSMCs位于中膜。正常情况下,VSMCs处于分化成熟状态也称为收缩型,维持动脉血管壁的正常收缩功能,从而调节血压。当血管内皮损伤后或周围微环境改变后,多种信号通路被激活进而作用于VSMCs,促使VSMCs由收缩型变成合成型,发生增殖和迁移,并大量合成和分泌细胞外基质沉积于血管,从而导致血管重塑。研究发现[8],生长因子、PDGF-BB、Ang-II和机械因素等可以使VSMCs由收缩型向合成型转变,促进其增殖和迁移,其中 PDGF-BB可能通过影响 KLF4 磷酸化与不同转录调节因子的相互作用的机制,进而诱导 VSMCs 由收缩型转变为合成型[9]。本文选用PDGF-BB刺激VSMCs建立VSMCs表型转换模型,结果发现PDGF-BB组的细胞活力和迁移率明显高于正常VSMCs组,并且PDGF-BB组的收缩型特异性SM22α蛋白表达量低于正常VSMCs组,结果证实PDGF-BB可以促进VSMCs表型转变。miRNA可以通过抑制或相关基因的表达从而调控细胞功能,如细胞分化、增殖及维持稳态等。众多研究表明[10],miRNA的特异性表达在心血管疾病发生发展过程中发挥重要作用。因此,miRNA是否对VSMCs表型转换以及活力和迁移有影响是一个很重要的研究课题。Yang等[11]在动物体内实验发现大鼠受伤的主动脉中,miR-22表达水平下降,而且体外实验发现miR-22过表达抑制VSMCs从收缩型变为合成型;miRNA-18a/b通过作用于血清反应因子促进VSMCs从收缩型变为合成型[12];此外,miR-26a作为另外一个参与VSMCs表型调控的miRNA,可以通过抑制Smad1从而抑制PDGF-BB诱导的VSMCs的表型转变[13]。miRNA不仅参与VSMCs表型调控,还参与VSMCs活力、迁移及内膜形成的调控过程。Ham等[14]发现miR-9过表达可以抑制VSMCs增殖和迁移,且同时在球囊损伤实验中发现miR-9抑制新内膜的形成;miR-146a 通过 NF-κB依赖的途径可以促进血管平滑肌细胞增殖以及迁移[15]。27nt-miRNA来源于eNOS基因第 4 内含子中的 27 碱基重复序列,我们前期工作发现高表达27nt-miRNA通过抑制转录因子AP1从而抑制eNOS的活性,并且抑制NO的合成和释放[4]。已有研究报道NO可以活化VSMCs内的鸟苷酸环化酶,通过环磷鸟苷酸依赖蛋白激酶Ⅰ信号通路催化一系列蛋白磷酸化,从而使血管平滑肌舒张,抑制VSMCs增殖和迁移[5]。由此推测27nt-miRNA可能对VSMCs的表型转变、活力及迁移有一定影响。本研究发现27nt-miRNA高表达组SM22α的mRNA和蛋白表达量高于PDGF-BB+NC组,细胞活力和迁移能力明显下降,而27nt-miRNA抑制组与高表达组相反,这一结果强烈提示27nt-miRNA参与VSMCs收缩型特异性SM22α基因调控,并且抑制PDGF-BB诱导VSMCs生长及迁移,并有可能抑制其表型转换。VSMCs的表型转变、活力及迁移是一个多因素调节的过程,不是单一分子或基因所调控,本文研究发现27nt-miRNA可能通过调控SM22α基因从而影响VSMCs的表型转变、生长及迁移的过程,但是否存在其它影响因素存在,有待进一步的探究。
