参附注射液对大鼠胆道缺血再灌注后损伤的保护作用
2019-02-28
1.甘肃中医药大学基础医学院病理教研室,甘肃 兰州 730000;2.甘肃省中医院麻醉科,甘肃 兰州 730050
临床研究显示,胆道并发症作为影响肝移植术后远期疗效的重要并发症,其发病率为7%~25%,且更容易发生在活体和心脑死亡供体肝移植术后,是影响患者术后长期生存率和移植肝脏无功能的主要原因[1-3],如何避免或减轻供肝缺血再灌注后的胆道损伤已成为研究热点。参附注射液源自中医古方参附汤,由人参、附子制备而成,主要成分为人参皂甙和乌头类生物碱,因其抗自由基、抗Ca2+超载,改善微循环等“多靶效应”广泛应用于临床,尤其是在心、肺、肝等脏器缺血再灌注损伤方面,具有明显的保护作用[4-8],但目前对胆道系统缺血再灌注损伤的作用效应及其机制尚不十分清楚。本实验通过建立大鼠的胆道缺血再灌注模型,观察并探讨参附注射液对其可能的保护机制。
1 材料与方法
1.1 试验药物 参附注射液(每支10 mL,每毫升含生药红参100 mg、附子100 mg,批号:Z51020664,三九制药有限公司),依达拉奉注射液(批号:080511,南京先声东元制药有限公司)。
1.2 动物 清洁级健康雄性SD大鼠60只,体重(260±20)g,饲养环境温度(22±2)℃,自由进食,饮水,由甘肃中医药大学实验动物中心提供,合格证号:0001478。
1.3 试剂 TNF-a、Fas免疫组化试剂盒,SP试剂盒均购自武汉博士德公司,TNF-a和Fas稀释浓度均为1:150。超氧化物歧化酶(SOD)测试盒、丙二醛(MDA)测试盒购自南京建成生物研究所。
1.4 仪器 全自动生化分析仪(奥林巴斯),病理切片机和医学显微照相系统为德国莱卡。
1.5 方法 参照Peralta 等[9]建立大鼠肝脏缺血再灌注损伤模型。 采用乙醚麻醉,取上腹正中切口,分离并暴露肝门部,无损伤血管夹钳夹闭肝左、中门静脉及肝动脉分支,造成70%的热缺血,60min后松开血管钳恢复血流即行再灌注,于再灌注4 h后抽取腹主动脉血标本。取左肝固定部位组织,大小适中,一块置于-70℃冰箱保存,用于组织MDA、SOD的统一测定;另一块用10%中性甲醛固定,用于组织形态学观察和免疫组化染色。
1.5.1 分组 60只大鼠随机分为假手术组、缺血再灌注组、依达拉奉组、参附注射液15 mL/kg组、参附注射液10 mL/kg和参附注射液5 mL/kg组,每组10只。假手术组:仅游离肝脏,不阻断血流。IR组:行肝门阻断。参附注射液组:在行缺血再灌注术前,每天腹腔注射15 mL/kg、10 mL/kg、5 mL/kg不同剂量的参附注射液,连续3天,第3天于术前30 min给药。依达拉奉组和IR组大鼠同样方法分别给予依达拉奉10 mL/kg及生理盐水15 mL/kg,除假手术组(Sham)外,其它5组均与第3天手术,给药期间常规喂养。
1.5.2 血清谷丙转氨酶( ALT)、碱性磷酸酶( ALP)、总胆红素( TBIL) 浓度测定 使用全自动生化分析仪测定不同时间点血清ALT、ALP及TBIL 浓度,作为肝缺血再灌注术后胆道损伤的标志。
1.5.3 胆管组织TNF-α、Fas的检测 选用SP免疫组化试剂盒,TNF-α、Fas稀释度均为1∶150,具体步骤按说明书操作,TNF-α、Fas主要表达于细胞浆,呈棕色。应用Laica图像分析系统,光镜放大400倍摄取图像,输入图像分析系统。每张切片随机选取5个区域,计算每张切片的平均光度,阳性单位。
1.5.4 肝组织SOD和MDA的测定 准确称取冰冻肝脏组织100 mg,按说明书操作,手工匀浆制成10%的组织匀浆,低温3000 r/min离心12 min上清液,采用化学比色法测定组织匀浆上清液SOD活性、MDA含量。
2 结果
2.1 血清酶学指标 与假手术组相比,缺血再灌注组的血清ALT、ALP、TBIL水平均显著升高,表明造模成功;与缺血再灌注组比较,参附注射液15 mL/kg组、10 mL/kg、 5 mL/kg组和依达拉奉组可明显减低血清ALT、ALP及TBIL的水平,参附注射液15 mL/kg组的ALT、ALP水平明显下降,详见表1。


组别剂量/mL/kgALT/IU/LALP/IU/LTBIL/μmol/L假手术组 50.41±2.88** 69.23±4.51**0.62±0.25**参附注射液51008.42±4.44*372.61±20.904.62±2.44参附注射液10 930.23±15.77**331.83±6.54**3.54±0.41**参附注射液15 880.41±11.51**316.24±9.31**3.21±0.15**依达拉奉组10 928.73±20.14** 339.52±16.14**3.13±0.28**
注:与缺血再灌注组比较,*P<0.05,**P<0.01。
2.2 SOD活力、MDA浓度水平 与假手术组比较,缺血再灌注组大鼠胆管组织中SOD活力明显降低,MDA含量明显升高;与缺血再灌注组比较,参附注射液15 mL/kg组、10 mL/kg组、5 mL/kg组和依达拉奉组大鼠胆管组织中SOD活力显著升高, MDA含量显著降低,表明参附注射液对胆管缺血再灌注损伤具有明显的保护作用,详见表2。
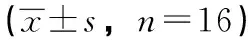
组别剂量/mL/kgSOD/U/mgMDAμmol/g假手术组160.11±4.28**1.52±0.35**缺血再灌注组79.42±10.175.04±0.90参附注射液590.33±13.41*4.58±1.16参附注射液10119.71±6.54** 2.92±2.51**参附注射液15125.32±6.71** 2.89±1.02**依达拉奉组10108.44±13.27** 3.14±0.60**
注:与缺血再灌注组比较,*P<0.05,**P<0.01。
2.3 组织病理学观察
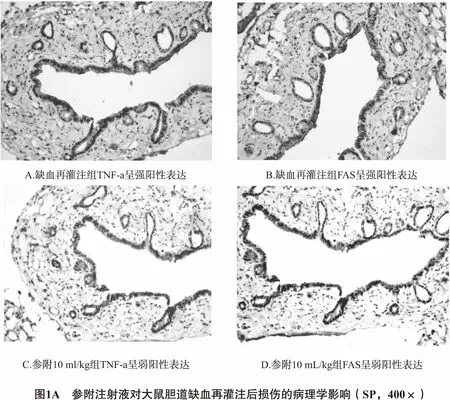
2.3.1 病理学观察 光镜下假手术组胆管上皮细胞形态正常,排列整齐,无炎细胞聚集;缺血再灌注组胆管可见上皮细胞明显肿胀变性,有灶状或片状坏死脱落,大量中性粒细胞浸润;参附注射液5 mL/kg组可见胆管上皮细胞水肿、灶状坏死脱落虽较缺血再灌注组减轻,但上皮连续不完整,有较多中性粒细胞浸润;参附注射液15 mL/kg组、10 mL/kg组和依达拉奉组病理改变明显减轻,胆管上皮连续尚完整,仅见少量中性粒细胞浸润。
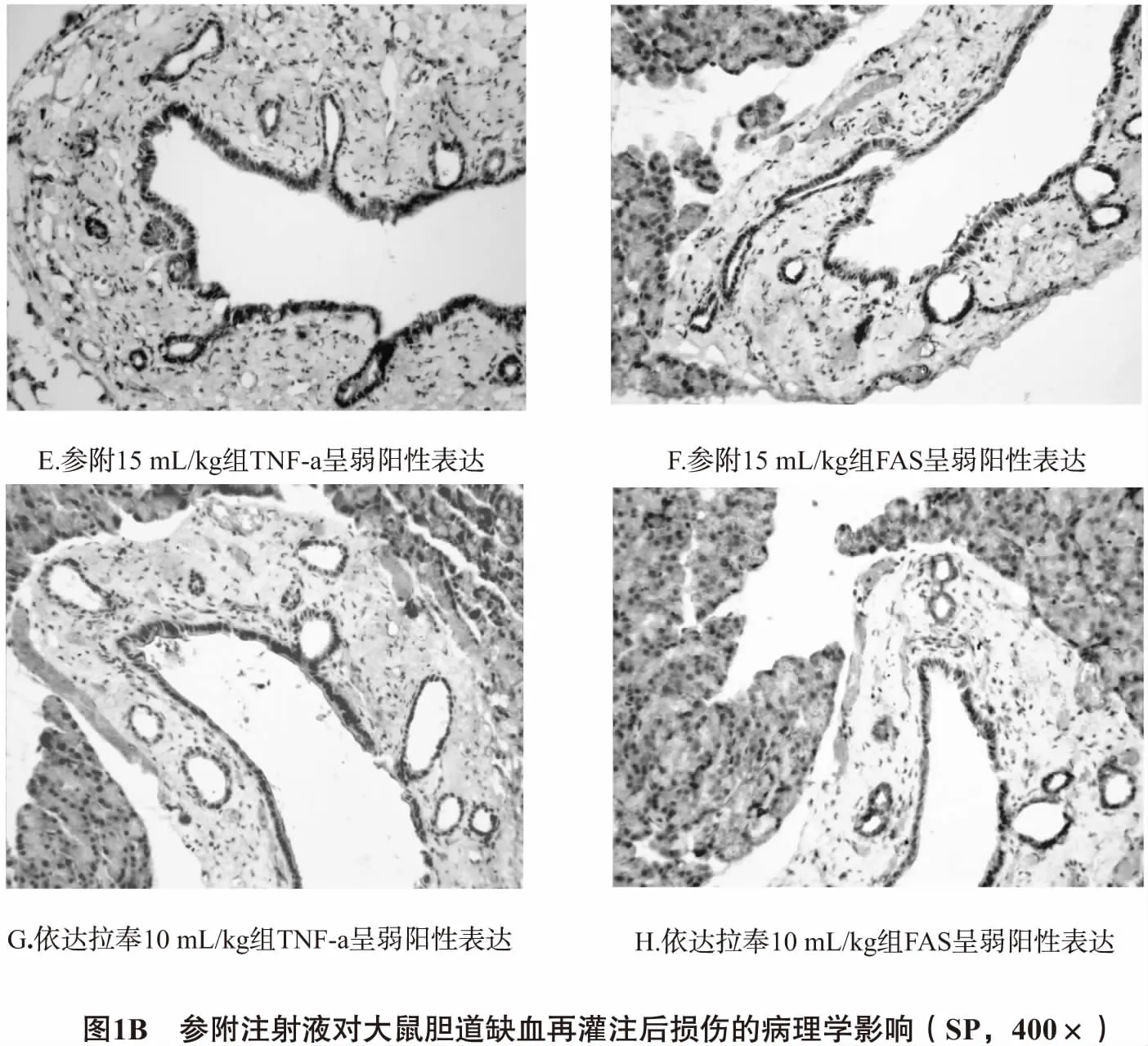
2.3.2 胆管上皮细胞中TNF-α、Fas的表达 TNF-α、Fas主要表达于胆管上皮细胞胞浆中。假手术组胆管上皮细胞形态正常,细胞核蓝染,背景染色浅,无明显非特异性染色;缺血再灌注组胆管上皮细胞胞浆可见多量棕黄色粗颗粒,呈弥漫性分布;参附注射液5 mL/kg组可见一定量淡/棕黄色颗粒,散在分布;参附注射液15 mL/kg组、10 mL/kg组和依达拉奉组胆管上皮细胞胞浆可见少量淡黄色细颗粒,程度较其他组减轻,但比假手术组明显,见图1、表3。

表3 各组大鼠胆管组织TNF-α、Fas蛋白表达(OD值)
注:与缺血再灌注组比较,*P<0.05,**P<0.01。
3 讨论
缺血再灌注损伤是移植肝胆管必然经历的病理生理过程,肝动脉和胆道系统的完整性、通畅性与胆道并发症的发生有着重要关系。肝动脉终末分支-胆管周围毛细血管丛是肝内胆管唯一血供,长时间的缺氧会导致血管内皮细胞损伤、肿胀明显,再灌注时导致血液再灌流减少;胆管上皮细胞极易活化,活化的胆管细胞可迅速产生释放大量的毒性氧自由基,导致内源性抗氧化剂SOD、谷胱甘肽含量明显减少[10],并分泌大量炎症介质和肽类物质,如TNF-α、NO、IL-1等,促进中性粒细胞、血小板粘附聚集,加重毛细血管狭窄,阻塞血液灌流,引起胆管微循环障碍,又进一步加重血管内皮细胞和胆管上皮细胞的损伤,形成恶性循环,进而引起胆汁淤积、高胆红素血症,甚至移植肝功能丧失等后果。此外,游离的大鼠胆管上皮细胞在缺氧4 h,再灌注60或120 min后发现大量细胞凋亡[11],提示胆管上皮细胞凋亡也是缺血再灌注损伤的特征性改变。
TNF-α主要由激活的单核巨噬细胞系统分泌,参与免疫反应和炎症反应。在缺血再灌注过程中,TNF-α浓度迅速增加,并表现出比其他细胞因子更高的灵敏度,因此TNF-α表达水平可反映机体损伤程度,被视为炎症指标;在TNF-α的刺激下,细胞粘附分子(ICAM-1)表达增高,促进白细胞和血管内皮细胞的粘附,加重动脉粥样硬化的进程[12]。
TNF-α和Fas还是细胞凋亡过程中关键性的因子,TNF-α与其受体TNF-R1结合、Fas与其配体Fas L结合后,生成相关的死亡结构域簇集TRADD 、FADD,与Caspase-8前体N末端的死亡效应域相作用,激活Caspase-8,启动Caspase蛋白酶级联反应诱导细胞凋亡发生。Chen等[13]肝缺血再灌注损伤研究中发现参附注射液通过下调TNF-α,从而减少肝实质细胞凋亡。Kumar A等[14]在甲亢诱导大鼠肝细胞凋亡的研究中也证实,TNF-α和Fas水平明显升高,且TNF-α可上调Fas表达。本实验结果显示,与缺血再灌注组比较,参附注射液5 mL/kg组、参附注射液10 mL/kg和参附注射液15 mL/kg组胆管上皮细胞TNF-α、Fas表达量和表达强度明显减弱;参附注射液15 mL/kg组肝门部胆管上皮细胞中TNF-α、Fas阳性表达率分别为24.8%、22.4%,较同一时相缺血再灌注组(36.7%、32.6%)明显下降(P<0.05);汇管区胆管上皮细胞中TNF-α、Fas的阳性表达率,参附注射液15 mL/kg组分别是20.1%、17.3%,较缺血再灌注组(31.2%、25.9%)也明显减少(P<0.01)。Zhu等[15]的研究表明参附注射液能显著诱导血管内皮依赖性舒张,有效保护血管内皮细胞。Yan等[16]在大鼠心衰模型研究中发现参附注射液可降低心衰细胞的阳性率,抑制Caspase-3的表达和细胞凋亡。由此可以推测,参附注射液可改善微循环,并通过干预调节TNF-α、Fas/FasL死亡信号通路而抗胆管上皮细胞的凋亡,发挥胆道保护作用。
丙二醛(MDA)是脂质过氧化反应的终产物,当组织抗氧化剂耗尽时,会引起细胞损伤及细胞膜的破裂;超氧化物歧化酶(SOD)是一种金属酶,能催化O2-到O2和H2O2的歧化,直接灭活氧自由基,抑制白细胞的粘附和Na+内流,修复组织损伤。本实验中,缺血再灌注组大鼠血清ALT、ALP及TBIL持续升高,血浆SOD活力明显减弱,MDA含量显著增高;应用不同剂量的参附注射液处理后,ALT、ALP及TBIL显著降低,血浆SOD活力增强,MDA含量明显下降,均较缺血再灌注组明显改善。研究表明,参附注射液能稳定细胞膜,减少心肌酶的释放,保护缺血的心肌细胞;还可灭活黄嘌呤氧化酶,清除氧自由基,抑制细胞脂质过氧化反应,通过抑制NF-κB活性,降低肝脏Kupffer 细胞激活,减少TNF-α、IL-1等促炎因子的释放,保护肝细胞的活性[17-20]。实验中,我们还发现参附注射液15 mL/kg组、10 mL/kg组效果尤为明显(P<0.01),并呈现剂量依赖关系,提示参附注射液可干预调节炎症反应,降低胆管细胞氧耗,加速自由基的排泄,减轻脂质过氧化损伤,在维护机体氧化与抗氧化之间的平衡方面作用显著。
综上所述,参附注射液可以通过抑制TNF-a/TNF-R1→Fas/ Fas-L死亡信号转导途径,减轻胆管上皮细胞的凋亡,从而有效保护胆管功能,减轻肝移植缺血再灌注后胆道并发症的发生,为临床治疗提供一条可行性思路。
