血清生存素水平在预测肿瘤坏死因子-α抑制剂治疗类风湿关节炎临床疗效中的作用
2019-02-27韩俊张英
韩俊,张英
(江汉大学附属医院药剂科,武汉 430015)
类风湿关节炎 (rheumatoid arthritis,RA) 是一类慢性自身免疫性疾病,以对称性多关节炎为主要临床表现,如不给予积极治疗,病情将逐渐加重,导致关节畸形、功能丧失,甚至导致不同程度的残疾[1]。但随着肿瘤坏死因子抑制剂 (tumor necrosis factor inhibitors,TNFi) 的发展和使用,RA的预后有了很大改善[2-3]。但仍然有约20%~30%的RA患者TNFi疗效不佳或难以承受其高昂的费用[4-5],因此,探索可预测TNFi疗效的生物标志物,对RA患者个体化治疗具有重要意义。生存素是最近新发现的凋亡抑制蛋白,其表达水平与RA密切相关。研究[6]显示,生存素阳性 (> 0.45 ng/mL) 的RA患者单独使用甲氨蝶呤(methotrexate,MTX) 治疗效果较差,生存素水平降低与较好的临床疗效相关。肿瘤坏死因子-α (tumor necrosis factor-α,TNF-α) 抑制剂是临床最常用的TNFi,目前血清生存素在预测其治疗RA患者临床疗效中的作用尚不清楚。因此,本研究拟评估血清生存素水平在预测RA患者TNF-α抑制剂临床疗效中的作用。
1 材料与方法
1.1 研究对象
选择2015年4月至2017年3月期间在江汉大学附属医院接受TNF-α抑制剂治疗的中高疾病活动度RA患者63例。纳入标准:(1) 符合美国风湿病学会1987年修订的RA分类标准;( 2) 年龄≥18周岁;( 3)28关节疾病活动度( disease activity score 28,DAS28) ≥3.2分;( 4) 根据病情需要自愿接受TNF-α抑制剂治疗。排除标准:患有严重的关节变形或接受过关节手术;合并中重度肝功能或肾功能不全;6个月内使用过TNF-α抑制剂或其他生物制剂治疗;有恶性肿瘤史、严重感染史;怀孕或哺乳期。本研究获得了江汉大学附属医院伦理委员会批准,所有患者均签署了知情同意书。
1.2 研究方法
1.2.1 治疗及评估:本研究所有患者均根据病情需要和自我意愿选择TNF-α抑制剂治疗。常规推荐TNF-α抑制剂治疗方案如下,TNF-α抑制剂皮下注射2次/周,25 mg/次,持续24周。根据患者实际病情需要,联合1种抗风湿病情药物 (disease-modifying antirheumatic drugs,DMARD) 药 物 进 行 治 疗。记录患者的基线期信息,包括年龄、性别、病程、血沉 (erythrocyte sedimentation rate,ESR) 、C反应蛋白(C-reactive protein,CRP) 、DAS28评分、健康状况问卷 (health assessment questionnaire,HAQ) 评分、类风湿因子 (rheumatoid factor,RF) 状态、抗环瓜氨酸肽抗体 (anti-cyclic citrullinated peptide antibody,A-CCP)状态以及合并用药信息。TNF-α抑制剂治疗24周时评估患者的DAS28评分,参考欧洲抗风湿病联盟标准,临床应答定义为DAS28评分相对于基线期下降≥1.2分;临床缓解定义为DAS28评分<2.6分。
1.2.2 样本采集:基线期收集RA患者血清。清晨抽取空腹静脉血5 mL,室温放置2 h,或4 ℃过夜后于3 000 r/min (离心半径10 cm) 离心5 min,分离血清,置于-80 ℃冰箱中保存待用。
1.2.3 酶联免疫吸附测定 (enzyme-linked immunosorbent assay,ELISA):严格按照ELISA试剂盒 (美国Abcam公司) 操作说明进行ELISA测定,测量基线期生存素表达水平。
1.3 统计学分析
采用SPSS 23.0软件和GraphPad prism V5.01软件进行数据分析。连续变量采用Kolmogorov-Smirnov进行正态性检验,符合正态分布的连续变量采用s的形式描述,非正态分布的连续变量采用中位数 (四分位间距) 形式描述。分类变量采用频数 (百分比) 的形式表示。生存素水平 (非正态分布的连续变量) 在应答患者和无应答患者以及缓解患者和未缓解患者的组间差异比较采用Mann-Whitney U检验。采用受试者工作特征 (receiver operating characteristic,ROC) 曲线对生存素预测TNF-α抑制剂治疗RA患者临床应答进行评估。采用单因素logistic回归模型分析影响TNF-α抑制剂治疗RA患者临床疗效的因素,将单因素回归分析中P≤0.1的因素进一步纳入多因素logistic回归模型,分析影响预测TNF-α抑制剂治疗RA临床疗效的独立预测因素。P < 0.05为差异有统计学意义。
2 结果
2.1 患者的基线信息
63例RA患者的平均年龄为 (48±11) 岁,其中,男19例,女44例,疾病病程中位值为59 (51~86) 个月。ESR、CRP中位值分别为36.3 (27.8~50.1) mm/h和29.1 (22.4~38.8) mg/L。DAS28评分和HAQ评分分别为5.7±1.5和1.9±0.8。RF阳性48例 (76.2%) ,RF阴性15例 (23.8%);A-CCP阳性42例 (66.7%) ,阴性21例 (33.3) 。合并治疗MTX、来氟米特 (leflunomide,LEF) 和柳氮磺吡啶 (sulfasalazine,SSZ) 的患者数分别为30例 (47.6%) 、26例 (41.3%) 和7例 (11.1%) 。
2.2 TNF-α抑制剂治疗临床应答和无应答RA患者基线期血清生存素表达水平
如图1所示,经24周TNF-α抑制剂治疗后,参考欧洲抗风湿病联盟标准对63例患者进行评估,41例符合临床应答标准 (设为应答组) ,22例未达到临床应答 (设为无应答组) 。应答组基线期生存素表达水平低于无应答组 (P = 0.004) 。
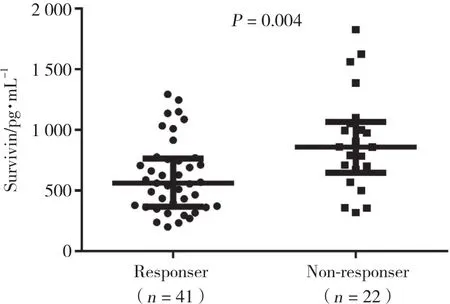
图1 TNF-α抑制剂治疗应答组与无应答组患者基线期生存素表达水平Fig.1 The expression level of survivin in TNF-α inhibitor treatment responser group and non-responser group
2.3 生存素水平预测TNF-α抑制剂治疗RA患者临床无应答的ROC曲线分析
如图2所示,生存素表达水平对预测TNF-α抑制剂治疗有无应答具有较高价值,生存素表达水平越高,则预示治疗应答可能性越大,其曲线下面积 (area under the curve,AUC) 为0.717,95%CI:0.583~0.852,当取最佳分割点生存素水平为780.7 pg·mL-1时 (特异度与灵敏度之和最大的点) ,特异度为63.6%,灵敏度为80.5%。
2.4 基线期预测TNF-α抑制剂治疗RA临床应答的因素分析
为了明确基线期生存素水平在TNF-α抑制剂治疗RA临床应答中的预测作用,进一步采用单因素、多因素logistic回归模型分析了基线期特征对于临床应答的预测作用,其中连续变量按照中位值或均值划分高低。单因素回归结果表明,生存素高表达可预测TNF-α抑制剂治疗RA患者无临床应答 (P = 0.008) ,CRP水平高可以预测TNF-α抑制剂治疗RA患者临床应答 (P = 0.003) ,见表1。
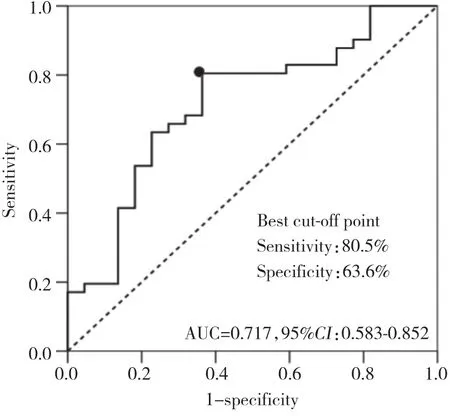
图2 生存素预测TNF-α抑制剂治疗RA患者临床无应答的ROC曲线Fig.2 ROC curve of survivin predicts the efficacy of TNF-α inhibitor treatment for RA patients without a clinical response
将单因素logistic回归模型中P ≤ 0.1的因素进一步纳入多因素logistic回归模型进行分析,结果显示,生存素高表达可以独立预测TNF-α抑制剂治疗RA患者无临床应答 (P = 0.032) ,而CRP水平高也可以独立预测RA患者对TNF-α抑制剂治疗有临床应答 (P =0.011) ,见表2。因此,生存素高表达可以独立于CRP预测TNF-α抑制剂治疗RA患者无临床应答。
2.5 TNF-α抑制剂治疗缓解组与未缓解组基线期生存素表达水平
经TNF-α抑制剂治疗24周后,DAS28评分结果显示16例RA患者达到临床缓解 (设为缓解组) ,47例未达到临床缓解 (设为未缓解组) ,缓解组基线期生存素水平与未缓解组相比无统计学差异 (P =0.265) 。见图3。
2.6 基线期预测TNF-α抑制剂治疗RA临床缓解的因素分析
单因素logistic回归结果显示,生存素高表达以及患者基线信息、生化指标水平、联合用药等均不是影响RA患者达到TNF-α抑制剂治疗临床缓解的因素 (均P > 0.1) 。因为所有因素P值均>0.1,所以没有进行多因素回归分析,见表3。

表1 影响TNF-α抑制剂治疗RA患者临床应答因素的单因素logistic回归分析Tab.1 Univariate logistic regression analysis of clinical response factors in RA patients treated with TNF-α inhibitor

表2 影响TNF-α抑制剂治疗RA患者临床应答因素的多因素logistic回归分析Tab.2 Multivariate logistic regression analysis of clinical response factors in RA patients treated with TNF-α inhibitor
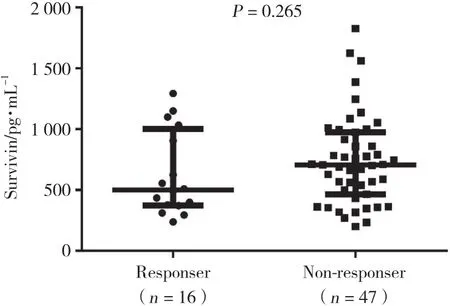
图3 TNF-α抑制剂治疗缓解组与未缓解组基线期生存素表达水平的差异Fig.3 Differences in baseline survivin level in the remission and non-remission groups after treatment with TNF-α inhibitor
3 讨论
生存素是凋亡抑制蛋白家族中的一员,是由142个氨基酸组成的多功能蛋白。它可以直接或间接抑制凋亡相关蛋白caspase3/7/9的激活从而抑制细胞凋亡,此外它还参与细胞周期,具有调节细胞有丝分裂的功能,是联系细胞周期和细胞凋亡的重要因子[7-8]。在免疫细胞中,生存素是功能T细胞受体形成和记忆T细胞分化的重要组成部分[8],还是功能性抗原递呈所必须的,可以调节组织相容性复合体Ⅱ分子的表达和抗原递呈树突状细胞的成熟,在RA发病中起着关键作用[9]。

表3 影响TNF-α抑制剂治疗RA患者临床缓解的单因素logistic回归分析Fig.3 Logistic regression analysis of clinical remission in RA patients treated with TNF-α inhibitor
研究表明,RA的发生与滑膜细胞周期失调及凋亡异常导致的关节滑膜组织过度增生、肥厚有关。已有资料证实滑膜组织、关节液及血浆中存在生存素高表达,并且与早期关节损伤和不良治疗反应相关[8-10]。一项关于马来西亚RA流行病学的研究[11]显示,在1 233例RA患者中,有50.7%的患者血液检测出高表达的生存素,而1 566例对照组中仅有5.4%生存素水平升高。另一项研究以87例年龄为24~89岁,病程18~526个月的RA患者为研究对象,通过ELISA方法检测RA患者血液中生存素的表达水平,结果发现37%的RA患者生存素水平呈阳性 (生存素>0.9 ng/mL) 。而与生存素阴性的患者相比,血液生存素阳性的患者对单用infliximab治疗不容易产生临床应答和达到临床缓解[12]。提示生存素可能可以预测RA患者对生物制剂治疗的敏感性。但是生存素预测TNF-α抑制剂治疗RA患者临床疗效的研究尚少,其预测作用尚不完全清楚。本研究通过ELISA检测并分析基线期生存素水平在预测TNF-α抑制剂治疗RA患者临床疗效中的作用,结果发现,生存素在临床应答组患者中显著下调。进一步多因素logistic回归模型分析显示,基线期生存素水平高可以独立预测RA患者对TNF-α抑制剂治疗不容易达到临床应答。分析其原因可能是生存素可以抑制细胞凋亡,参与细胞周期,促进细胞增殖,而细胞增殖和抗细胞凋亡进一步促进类风湿成纤维样滑膜细胞和类风湿关节慢性炎症细胞的增多[8-9,11]。因此,高水平的生存素可能预示着患者预后差,疾病进展快。此外,生存素可能对生物制剂具有抵抗作用,使RA患者产生耐药[11-13],故生存素可以独立预测RA患者对TNF-α抑制剂治疗的临床应答。但是本研究发现,基线期生存素水平并不能预测患者对TNF-α抑制剂治疗是否达到临床缓解。可能是由于本研究评估时间较短,达到临床缓解的患者较少,导致结果可能出现偏差。
本研究存在一些局限性:(1) 样本量相对较小,仅63例患者,缺乏统计效能,未能找到影响疗效缓解的因素,因此,未来的研究应纳入更多样本,以进一步验证生存素对TNF-α抑制剂临床疗效的预测价值; (2) 随访时间较短,仅为24周,因此生存素对TNF-α抑制剂治疗RA患者的长期疗效及预测作用未能评估; (3) 由于患者有联合其他DMARDs进行治疗,可能会影响生存素的表达水平,从而干扰生存素预测TNF-α抑制剂治疗RA临床应答的结果,但是本研究进行了单因素和多因素logistic回归分析,减少了其他药物对结果预测的干扰。
综上所述,本研究结果表明,基线期血清生存素表达水平可以作为预测TNF-α抑制剂治疗中高疾病活动度RA患者临床应答的可靠生物标志物。
