原位制备的铁配合物催化烯烃选择性环氧化
2019-02-27宋虹瑾孟祥光
宋虹瑾 李 璐 张 妮 王 斐 吕 婧 孟祥光
(四川大学化学学院,绿色化学与技术教育部重点实验室,成都 610064)
0 引 言
环氧化合物是一类重要的有机合成中间体和有机化工原料,被广泛应用于树脂、涂料、胶黏剂、塑料、电镀等各种化学化工领域,是工业生产上极其重要的关键化学品之一[1]。烯烃的催化环氧化是制备环氧化合物的一种重要途径。目前烯烃的催化环氧化研究较为广泛,其所用催化剂种类繁多,主要类型有:金属配合物[2]、纳米金属[3]、金属氧化物[4]、分子筛[5-6]、水滑石[7-8]和杂多酸[9]。 其中金属配合物是烯烃环氧化反应最有效的催化剂之一。常见的金属配合物有铼金属配合物[10]、钌金属配合物[11-14]、铁金属 配 合 物[15-19]、 锰 金 属 配 合 物[20-24],然 而 报 道 的 金 属配合物大多催化选择性差或活性低,并且几乎都对H2O2产生明显的分解作用,从而失去了工业应用价值。因此,探寻催化活性和选择性高、无污染、简单方便的绿色环氧化技术和方法一直是一项具有挑战性的课题。Shoji等报道了许多细胞色素P450酶对烯烃的环氧化反应具有较好的催化活性,而其活性中心是由4个吡咯基团与铁形成的铁卟啉[25]。为了模拟天然P450酶的活性中心,在本工作中,我们设计的催化剂也包含4个氮原子与铁配位的结构,其结构类似于金属卟啉,在室温下对末端烯烃的环氧化显示了良好的催化活性。
1 实验部分
1.1 仪器和试剂
仪器包括:核磁(Brucker DPX-300FX),CDCl3为溶剂,TMS为内标;ESI-MS(TSQ,Quantum Ultra,thermo fisher);GC(中国,FULI 9790,KB-5 毛细管柱),FID 检测器;MOD 1106元素分析仪 (意大利,CarloErba公司),Hitachi U-2910 UV-Vis紫外分光光度计(Tokyo,Japan)。
30%过氧化氢、Fe(OTf)2、2,2′-联吡啶、吡啶-2-甲酸(PCA)、三乙胺、氯甲酸异丁酯、2-氯乙胺盐酸盐、甲醇、吡啶-3-甲酸、乙酸、苯甲酸、哌啶-2-甲酸、DL-脯氨酸、甘氨酸、水杨酸、哌啶-2-甲酸、1-金刚烷羧酸、乙腈以及其他烯烃底物等均为市售分析纯试剂;实验用水为二次蒸馏去离子水。
1.2 2-(2-吡啶基)-噁唑啉的合成及表征
2-(2-吡啶基)-噁唑啉(Pyrox)参考文献方法合成[26]:准确称取400 mg 2-吡啶甲酸固体将其加入到100 mL烧瓶中,然后向其中加入干燥的二氯甲烷32 mL,冰水浴下搅拌,并加入1.3 mL三乙胺,待固体全部溶解后,于30 min内向溶液中慢慢滴入485 μL氯甲酸异丁酯,继续在冰水浴下搅拌30 min,然后向混合溶液中加入433 mg 2-氯乙胺盐酸盐,在冰水浴下搅拌10 min后,再在室温下搅拌2.5 h。随后用旋转蒸发仪将溶剂移除,向其中加入20 mL甲醇和912 mg氢氧化钾,在75℃下回流12 h。反应结束后冷却至室温,得到浅黄色油状的物质。将油状物质溶于50 mL二氯甲烷,并用饱和的氯化铵溶液洗涤。水层用二氯甲烷进行萃取,然后将有机层合并,并用无水硫酸钠干燥,过滤,再将溶剂旋蒸除去得到产物。所合成物质分析结果如下:ESI-MS:m/z 187.00,计算值 187.06[M++K];1H NMR(400 MHz,CDCl3):δ8.71(d,J=4.7 Hz,1H),8.05(d,J=7.9 Hz,1H),7.79(t,J=7.7 Hz,1H),7.42~7.39(m,1H),4.53(t,J=9.7 Hz,2H),4.14(t,J=9.7 Hz,2H);13C NMR(100 MHz,CDCl3):δ163.88,149.70,146.77,136.64,125.53,123.81,68.21,55.13。
1.3 实验方法
烯烃环氧化反应的实验方法和步骤如下:于4.8 mL乙腈中加入50μL 0.1 mol·L-1Pyrox的乙腈溶液,再向其中加入 25 μL 0.1 mol·L-1Fe(OTf)2的乙腈溶液,接着加入25μL 0.1 mol·L-1PCA的乙腈溶液,所得混合液在25℃下搅拌5 min。然后加入50 μL 1 mol·L-1烯烃和 50 μL 1 mol·L-1对硝基甲苯(溶剂均为乙腈),再逐滴加入0.1 mmol H2O2(水溶液质量分数30%),在25℃下搅拌30 min。反应完毕后用乙酸乙酯萃取,无水Na2SO4干燥。过滤后,用旋转蒸发仪除去溶剂。使用石油醚与乙酸乙酯的混合液(30∶1,V/V)作为流动相对粗产物进行过柱纯化,即可得到产物,反应物和产物同时用GC进行分析和定量检测。
2 结果与讨论
2.1 原位催化剂复合物组成分析
原位生成的配合物不同于固定组成的配合物,它在溶液中可能同时形成多个结构的配合物。为了进一步了解其在溶液中的组成结构,我们用ESI-MS对原位生成的催化剂混合液进行了分析,结果如图1所示。从图1可见最强的4个信号峰,m/z值分别为250.07、325.91、474.00和500.92。 这 4个峰对应的物质分别为[Fe(Pyrox)3]2+、[Fe(Pyrox)(PCA)]+、[Fe(Pyrox)2(PCA)]+和[Fe(Pyrox)2(OTf)]+,它们具体的结构如图1中所示。
溶液中共有4种配合物,为了解哪一种配合物才具有催化活性,我们分别进行了分析研究。实验结果表明,只有Pyrox、吡啶-2-甲酸与Fe(OTf)2物质的量之比为2∶1∶1时才有催化活性。为了进一步了解这种六配位的金属配合物的配位细节,用量子化学密度泛函理论(DFT)方法,在B3LYP/6-31G(d)(对于 C,H,O,N)或 B3LYP/LANL2DZ(对于 Fe)的水平上计算了铁(Ⅱ)配合物的几何构型。相对于其它可能的构型,图2所示的构型是能量最低的,其对应计算的键长和键角列在表1中。这一计算结果说明亚铁离子与5个N原子和1个O原子形成了一个六配位的扭曲的八面体几何构型。意料之外的是,配体Pyrox参与配位的是氮原子而非氧原子,而氧原子可能对配位的氮原子的电负性产生了明显的诱导效应。

表1 金属铁配合物计算的键长(nm)和键角(°)Table 1 Calculated bond lengths(nm)and bond angles(°)for Fe(Ⅱ) complex with optimized geometry
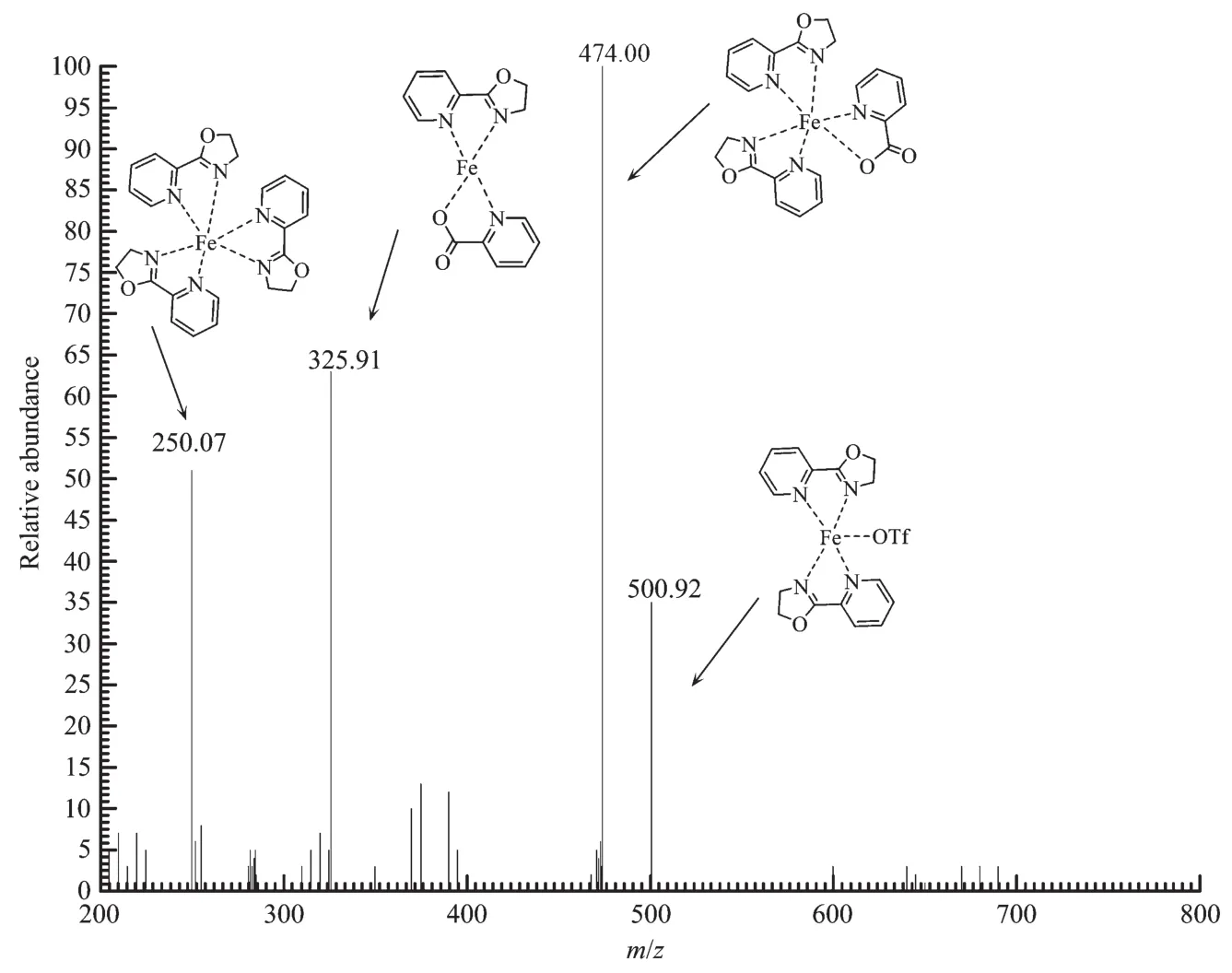
图1 原位制备催化剂的质谱图Fig.1 ESI-MSspectra of catalyst in situ prepared

图2 金属铁配合物优化的几何构型Fig.2 Optimized geometry of metal iron complex
2.2 配体对苯乙烯催化环氧化的影响
金属卟啉是由4个吡咯环与金属离子形成的配位化合物。因此我们选择了3种类似结构的含氮配体与Fe(OTf)2原位生成催化剂,用于催化苯乙烯环氧化反应,研究结果列于表2。从表2可以发现,当用2,2′-联吡啶作配体时,活性较低,且产物是裂解产物苯甲醛;2,2′-双(2-恶唑啉)作为配体时,催化活性和环氧化选择性有了很大提高。令人意外的是,噁唑啉与吡啶结合的配体(Pyrox)与铁形成的金属配合物,对苯乙烯的氧化反应展现出极好的催化活性和环氧化选择性:室温下30 min内,苯乙烯完全转化,并得到了87.3%的环氧苯乙烷。图3为H2O2氧化苯乙烯反应30 min前后的GC图谱,从中可以看到,在保留时间1.845 min处的原料苯乙烯峰完全消失,取而代之的是2.572 min处的产物环氧苯乙烷和少量苯甲醛(2.198 min处)。这一结果体现了配体对反应的活性和选择性所展现的极其敏感的效应,其原因在于配体对金属配合物活性的影响不仅在于配体作为金属的配位原子,更重要的是配体上的电子效应能够传递到催化剂的金属原子上,使得金属配合物整体产生协同催化作用,从而对催化反应的速率、产物的选择性和反应途径等都产生较大影响[27-29]。
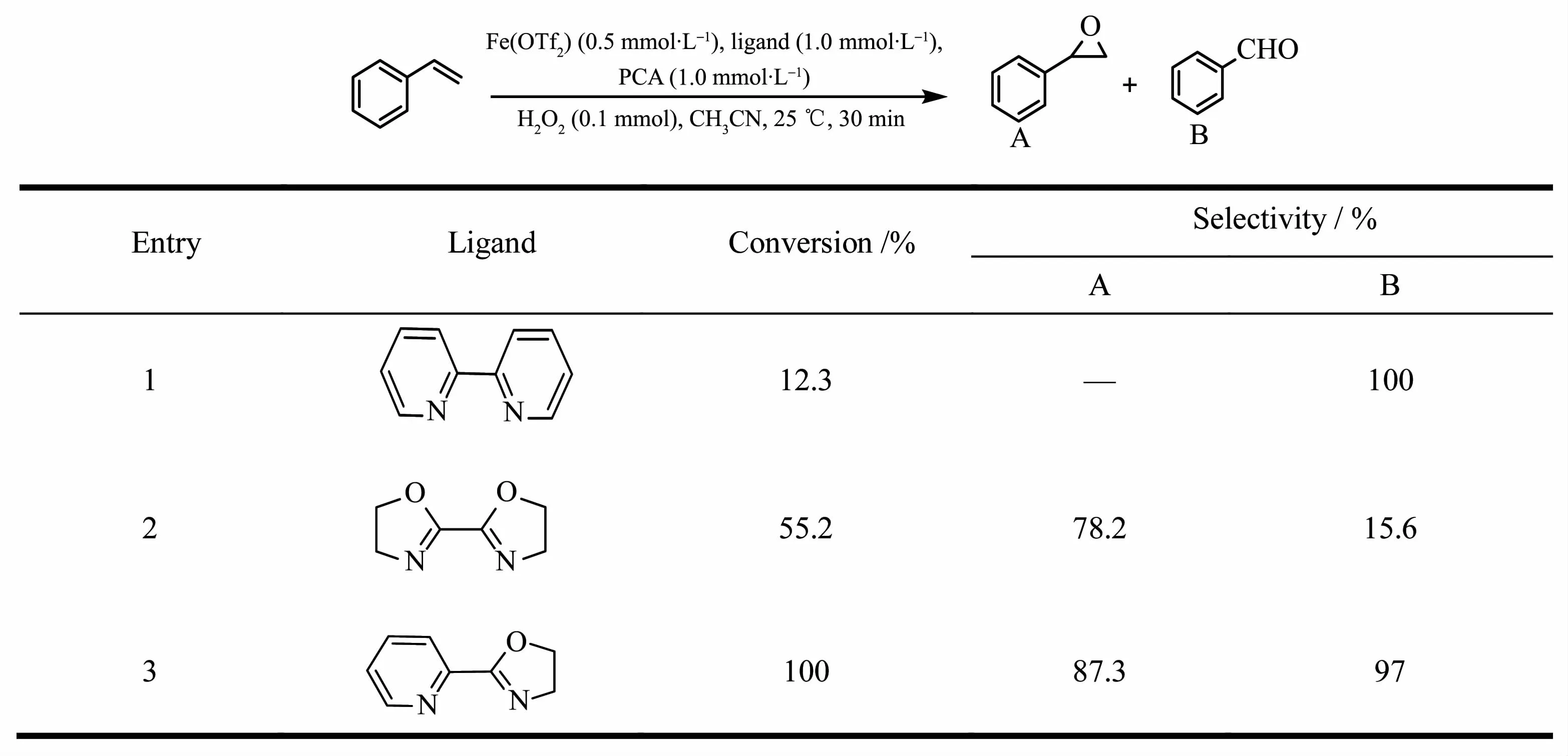
表2 各种配体对苯乙烯环氧化的影响Table 2 Effect of various ligands on epoxidation of styrene*
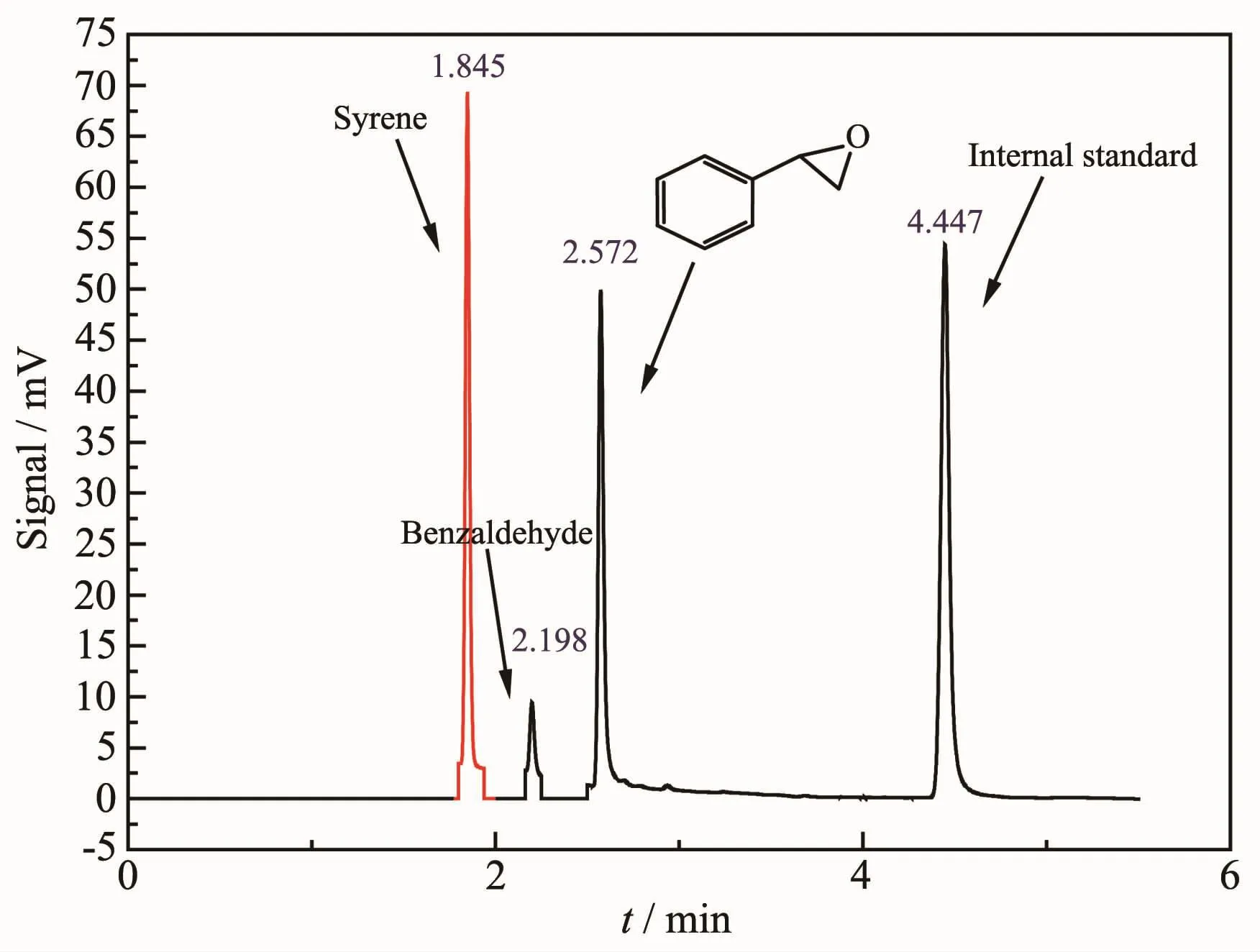
图3 苯乙烯环氧化反应前后的GC图Fig.3 GCchart before and after epoxidation of styrene
2.3 辅助配体对苯乙烯催化环氧化的影响
辅助配体对烯烃的环氧化也具有重要作用[30]。本文选取多种辅助配体并对其用量进行研究,实验结果列于表3。从表3可以看出,当辅助配体不存在时,催化体系的催化活性很低,仅有8.5%的苯乙烯被氧化生成苯甲醛。若辅助配体上只有一个羧基配位时(Entry 2,3),环氧化选择性较高,但转化率较低;当苯甲酸作辅助配体时,转化率低且只生成苯甲醛,这可能是由于它对铁离子的电子效应传递不匹配所致。当辅助配体提供2个配位原子时(其中一个是羧基),情况有些复杂:酚氧原子的配位没有活性(Entry 5);间位吡啶羧酸尽管可以提供2个配位点(N,COO-),但由于其位置错位,只能形成COO-与Fe2+配位形式,因此其作用类似于苯甲酸。当邻位N原子和羧基同时配位时,不管分子结构如何(Entry 7~9),其都有较好的催化活性,尤其是良好的环氧化选择性。最适宜的是吡啶-2-甲酸作为辅助配体,且与底物物质的量之比为0.05∶1时催化活性极高,生成87.3%的环氧苯乙烷。进一步研究发现,辅助配体的用量也对反应产生极大影响,用量过多或过少,都会产生不良效果(Entry 10~12)。辅助配体不仅可以与金属原子配位,形成稳定的金属配合物,而且通过它上面的N、O配位原子与Fe2+形成电子转移而产生电子效应,进而影响催化活性,合适的电子效应能产生与反应匹配的活性物种,促进反应的进行[31]。
2.4 不同阴离子对反应的影响
2003 年,Sheldon 等[32]在研究 将 芳 香醇 氧 化 生成相应的醛时发现,含有不同阴离子的铜盐对反应活性的影响很大。由此可见,阴离子在催化氧化反应中起着重要的作用。我们选择了4种不同阴离子的铁(Ⅱ)盐分别与配体原位配位生成催化剂,对其进行了考察,其结果列于表4。从表中的数据可以看出,含有不同阴离子的铁(Ⅱ)盐对反应活性的影响很大,当阴离子为氯离子、硫酸根离子或草酸根离子时,苯乙烯完全不反应;而当阴离子为三氟甲烷磺酸根离子时,苯乙烯的转化率和产物环氧苯乙烷的选择性较高。一个可能的解释是:小体积阴离子能够进入金属配合物内部,使得它们能够与铁离子结合而占用了配位位置,这样就阻碍了金属铁离子与底物烯烃和H2O2的结合而失去活性;而较大体积的CF3SO3-阴离子的空间效应和电子效应会使催化剂对底物的不对称诱导作用大大増增强,从而提高烯烃环氧化产率,其具体原因需要进一步实验工作和理论计算分析,有待后续开展。

表3 辅助配体对苯乙烯环氧化的影响Table 3 Effect of auxiliary ligands on epoxidation of styrene a

表4 不同阴离子对苯乙烯环氧化反应的影响Table 4 Effect of different anions on epoxidation of styrene*
2.5 溶剂和氧化剂对苯乙烯催化环氧化反应的影响
溶剂对烯烃的氧化具有重要的影响[33],我们选择6种不同的溶剂进行研究,其结果列于表5。从表中的数据可以看出,在丙酮、三氯甲烷、1,2-二氯乙烷和四氢呋喃4种溶剂中,苯乙烯不发生反应;而当溶剂为叔丁醇和乙腈时,苯乙烯容易被氧化而发生反应生成环氧苯乙烷,尤其是使用乙腈为溶剂时,苯乙烯完全被氧化生成87.3%的氧化苯乙烯。除此之外,我们又探究了不同的氧化剂对苯乙烯催化氧化的影响。从实验数据可以看出,苯醌、尿素过氧化氢加合物和高碘酸钠作氧化剂时,反应一段时间后未检测到任何产物,反应不进行;当叔丁基过氧化氢作为氧化剂时,只有少量的苯乙烯发生反应;然而当过氧化氢和间氯过氧苯甲酸为氧化剂时,苯乙烯的转化率和环氧苯乙烷的选择性均较高,尤其是使用过氧化氢作氧化剂,得到的结果最好。这也是我们最期望的结果,因为与其它类型氧化剂相比,H2O2是一种高效、廉价和环境友好的氧化剂。

表5 溶剂和氧化剂对苯乙烯环氧化反应的影响Table 5 Effects of different solvents and oxidants on epoxidation of styrene*
2.6 底物的扩展应用
为了研究此催化体系是否也可以用于其它类型烯烃底物,我们将原位制备的催化剂作用于各类烯烃氧化反应,其结果列于表6。根据表中的实验数据可知,芳香族末端烯烃的转化率比脂肪族末端烯烃的转化率要高,这主要是因为芳基的电子密度比较大,使得连接的碳碳双键更加活泼,但是此催化体系对环烯烃并不起作用。研究表明我们的这种催化体系与其它的研究报道不同,大多数文献报道的催化类型对环己烯、环戊烯等有很好的催化活性,而对苯乙烯类芳香烯烃的催化效果和选择性较差,此原因有待进一步研究。
2.7 机理讨论
关于烯烃环氧化反应的催化机理研究相对较少,目前尚没有定论,文献报道的可能机理有“过氧酸机理”[34-35]和“铁氧物种机理”[36-38]。 “过氧酸机理”认为在氧化过程中产生了过氧酸物种,过氧酸再将烯烃进行环氧化。“铁氧物种机理”认为在铁配合物催化烯烃氧化的过程中产生了高价铁活性物种,如Fe(Ⅲ)、Fe(Ⅳ)=O或Fe(Ⅴ)=O。为了进一步了解本文的铁配合物催化烯烃氧化机理,我们分别对文献提出的2种催化机理进行了分析。
为了检测反应过程中是否有过氧酸生成,我们采用经典的GB/T 19108-2003方法进行分析。室温下将催化剂(0.5 mmol·L-1)和过量吡啶-2-甲酸配体(0.02 mol·L-1)相混合,然后滴加过氧化氢(0.04 mol·L-1)进行反应。分析H2O2和过氧酸浓度随时间变化情况。结果表明:30 min后H2O2的浓度几乎未变,也没有检测到过氧酸的生成。
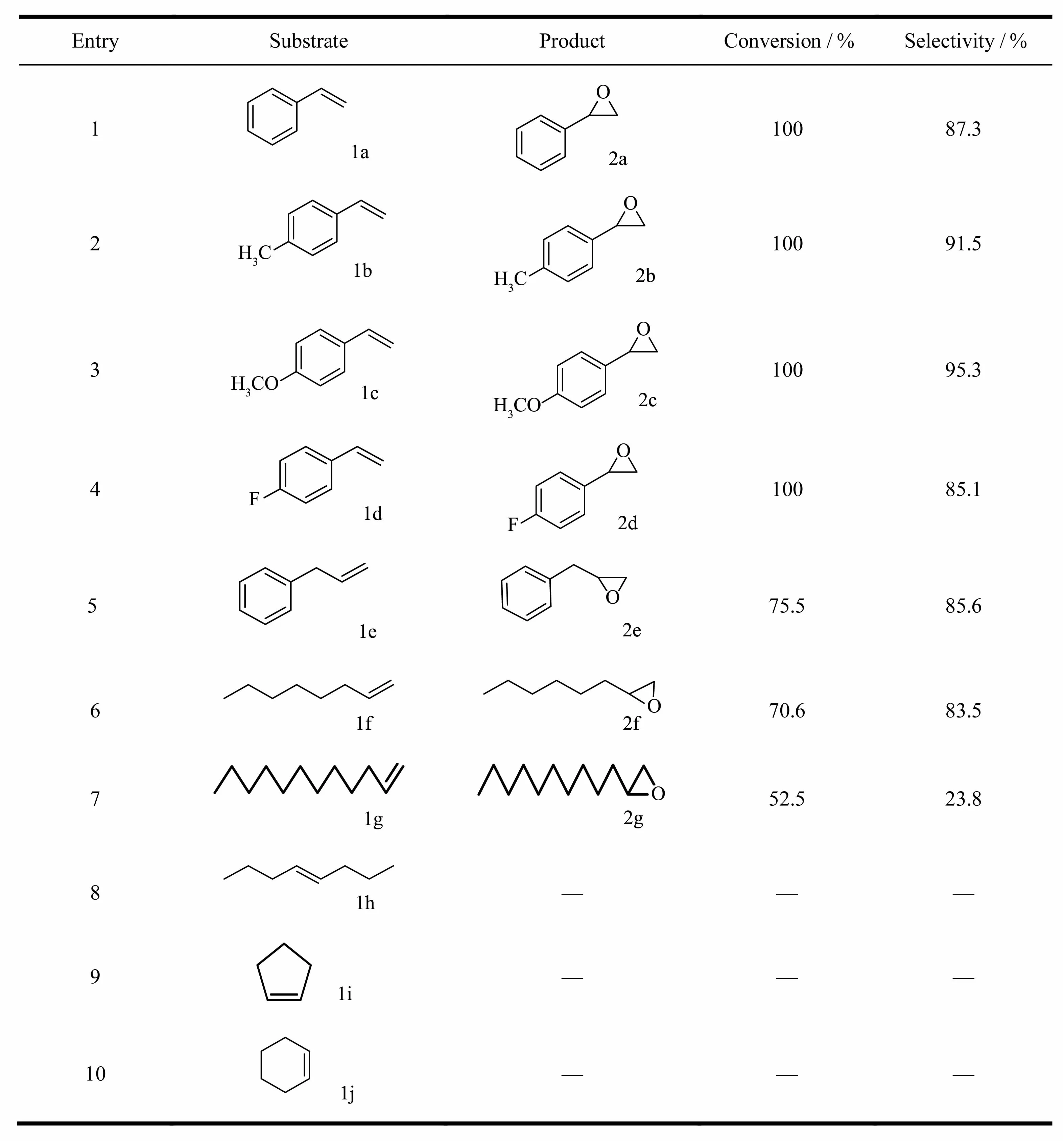
表6 不同烯烃环氧化反应的转化率和选择性Table 6 Conversion and selectivity of epoxidation of various olefins by H 2O2a
为了探讨催化反应是否符合“铁氧物种机理”,我们将催化剂加入到过量H2O2的乙腈溶液中,用紫外-可见分光光度计对此溶液进行全波长扫描和时间扫描,研究表明:在30 min内,溶液的UV-Vis谱在400~800 nm范围内并无变化,这说明此反应过程中没有铁氧活性物种如Fe(Ⅲ)、Fe(Ⅳ)=O、Fe(Ⅴ)=O的特征谱出现[39],说明铁氧物种不是本文反应的主要催化活性物种。

图4 可能的烯烃环氧化催化机理Fig.4 Possible catalytic mechanism for epoxidation of alkene
根据我们的实验工作和相关数据,我们提出了可能的催化机理(图4):计算表明末端烯烃的C1上带有较多的负电荷,因此烯烃可以取代PCA上的羧基,而与金属配合物上的Fe2+结合形成复合物A,然后H2O2受到PCA和烯烃的作用而与之结合得到复合物 B,随后 H2O2受到 Fe2+、COO-和烯烃 C1δ-的电性诱导作用而发生异裂,失去一分子水成为活性氧,进攻烯烃后得到复合物C。随后是氧原子进攻C1,重排后得到环氧产物,催化剂恢复原先状态。值得指出的是,在此过程中处在外围的CF3SO3-阴离子对H2O2和烯烃上的原子具有电性诱导作用,可能在由B→C的过程中对过渡态的形成并稳定起到促进作用。
3 结 论
本文建立了一种简便快捷的原位生成铁配合物并对末端烯烃的环氧化具有良好催化活性的方法,对催化机理也进行了初步讨论,并提出了一种新的机理。室温下乙腈溶液中,30min内5%(n/n)的催化剂可以催化H2O2氧化苯乙烯的完全氧化,并生成87.3%的环氧产物。量化计算表明具有活性的配合物具有5个氮原子和1个氧原子与铁原子形成的扭曲的八面体构型。辅助配体、溶剂、氧化剂和阴离子都对烯烃的环氧化反应产生较大影响。该催化体系底物适用范围广泛,不仅对芳香烯烃,也对脂肪烯烃有较好催化作用,然而对环烯烃底物无催化效果。
