Bi/BiVO4&Bi4V2O11复合催化剂的制备及其光催化性能
2019-02-27梁梦君向心怡杨志远杨水金
梁梦君 邓 楠 向心怡 梅 英 杨志远 杨 赟 杨水金
(湖北师范大学化学化工学院,污染物分析与资源化技术湖北省重点实验室,黄石 435002)
伴随着各国的经济、国防、工业等领域的高速发展,环境污染与生态毁坏已发展成为世界性的主题问题,人们对新的无污染清洁生产十分关心[1]。近几年来,我国环境问题十分令人担忧,其中水污染问题格外严重[2]。目前,废水的排放已经相当严重的影响了我国的经济、社会、环境的可持续发展[3]。因此,科学工作者尝试了多种方法来处理污水,如化学氧化(chemical oxidation)法[4]、生化(biochemical)法[5]、物理吸附(physical suction)法[6]等。 但由于存在能量损耗大,操作复杂,许多污染物做不到彻底的无害化消除甚至容易产生二次污染等弊端,限制了其应用,因此,传统的治理模式已无法与当前的环境污染现状抗衡。近年来,许多工作者将目光移向了解决环境污染、开发新能源这两大问题。太阳能是一种源源不断的再生能源,具有清洁、资源丰富、无毒等优点。1972年 Honda 和 Fuiishima[7]研究发 现 单 晶 TiO2电极上能光电解水,这表明了半导体的非均相光催化技术的到来。而Yang等[8]已成功利用TiO2对水中的有机染料等污染物进行光催化分解处理,从而加深了半导体在改善环境污染境况中的应用。
光催化技术直接利用太阳能这一自然界存在的光能,通过能量的转化,可产生具有氧化性相当强的活性物种,几乎可分解大量的有机或无机污染物[9-11]。在应用于光催化降解有机染料或有机物的光催化剂中,铋系材料因在6s轨道上占据的2个孤电子具有特殊的惰性电子的效应,而成为潜在的具有可见光活性的光催化剂, 例如 Bi2NO6(N=W,Mo)[12-13],BiYO4(Y=V,P)[14-15]。 其中,钒酸铋作为一种无有害重金属元素的亮黄色的无机物,在结构上,主要以3种晶格存在:四方白钨矿(s-t)、单斜白钨矿(s-m)、四方锆石(z-t)结构[16]。一定条件时,钒酸铋的这3种结构可互相转化。Kudo等[17]的研究表明具有白钨矿结构(即单斜晶系)的BiVO4相对于四方锆石结构(斜方晶系)的Bi4V2O11催化活性较好。但Bi4V2O11也具有窄带半导体的优越性能,在可见光下可使染料等污染物降解,其电子是通过O的2p轨道向空的V3d轨道传输的[18]。单斜钒酸铋 (BiVO4)的电子则是通过Bi的6s轨道或Bi的6s与O的2p组成的杂化轨道向空的V3d轨道传输的,在可见以及在紫外光区都有一定范围的吸收,可呈现圆盘状和多面体形状[19]。单斜和斜方晶系的钒酸铋的电子传输方式有一定的差异,而且其光催化性质也存在差异,但二者可构造异质结加快载流子的迁移进而增强光催化降解活性。另外,为了能够更大限度的提高钒酸铋在降解有机污染物方面的应用价值,采取非金属元素(如C,N)掺杂、贵金属(如Ag,Au)沉积[20-23]的方法来对钒酸铋进行改性,进而改善钒酸铋的催化性能,这也是目前制备高活性和高度稳定性的钒酸铋光催化剂的研究热点。
通过简单的水热法成功制备了同时具有单斜(BiVO4)和斜方(Bi4V2O11)两种晶相的钒酸铋(BiVO4&Bi4V2O11)纳米光催化剂,并通过光还原将金属Bi沉积在BiVO4&Bi4V2O11表面。与BiVO4/Bi4V2O11相比,Bi/BiVO4&Bi4V2O11复合纳米材料对于RhB均有增强的光催化活性。与此同时,Bi/BiVO4&Bi4V2O11对于无色抗生素TC也有较强的光催化降解性能。此外,Bi/BiVO4&Bi4V2O11复合光催化剂降解RhB的机理也被提出。
1 实验部分
1.1 实验步骤
1.1.1 钒酸铋(BiVO4&Bi4V2O11)纳米材料的制备[24]
将0.485 g Bi(NO3)3·5H2O溶解在装有8 mL H2O和2 mL 15 mol·L-1HNO3的烧杯中形成A溶液,与此同时,将0.117 g NH4VO3和0.1 g乙二胺四乙酸(EDTA)超声分散在10 mL 4 mol·L-1的NaOH溶液中得到B溶液。随后,将B溶液逐滴加入A溶液中,调节pH值至11.5后转移至45 mL反应釜中,180℃保持10 h,待冷却至室温后,H2O和C2H5OH各洗涤3次,80℃真空干燥10 h得到产品。
1.1.2 光还原法制备Bi/BiVO4&Bi4V2O11复合光催化材料
称取0.1 g BiVO4&Bi4V2O11超声分散在20 mL、含有一定量的Bi(NO3)3·5H2O的乙二醇/水(体积比1∶1)中,以300 W的Xe灯为光源光照1 h,再分别用H2O和C2H5OH各洗涤3次,60℃干燥12 h,得到Bi/BiVO4&Bi4V2O11复合光催化材料。通过控制BiVO4&Bi4V2O11的量保持一定,改变 Bi(NO3)3·5H2O在溶液中的含量,可以获得金属铋的负载量分别为0%、0.2%、0.4%、0.6%、0.8%、1.0%、1.4%(w/w)的 Bi/BiVO4&Bi4V2O11复合光催化材料,并分别记为 BBVO0、B-BVO1、B-BVO2、B-BVO3、B-BVO4、B-BVO5 、B-BVO6,即 B-BVO X(X=0,1,2,3,4,5,6)。
1.2 材料的表征
用D8 ADVANCE型X射线粉末衍射仪(Cu Kα辐射,λ=0.154 18 nm,工作电压为40 kV,电流为30 mA,扫描范围 2θ=10°~80°)表征材料的晶相结构。采用Quanta 400F型扫描电子显微镜 (加速电压为10 kV)、FEI TF20型透射电子显微镜和高分辨透射电子显微镜(加速电压为200 kV)表征样品的形貌。X射线光电子能谱在具有单色Al KαX射线的Thermo Fisher Scientific ESCALAB 250Xi系统上进行。用德国耶拿SPECORD 50 PLUS型分光光度计测得材料的紫外可见漫反射光谱。通过ASAP2020 HD88型的比表面积分析仪进行催化剂的N2吸附-脱附实验。用F-4500型荧光分光光度计测量催化剂的光致发光(PL)光谱。
1.3 光催化性能测试
在可见光照射下,在含有RhB、TC水溶液的光反应容器中进行光催化反应,取50 mL 10 mg·L-1RhB或TC液倒入光反应器中,称取50 mg光催化剂加入到上述溶液中,以300 W的Xe灯为光源,使用滤光片滤掉紫外光(λ<420 nm)。在光照前,暗处理搅拌30 min以使催化剂与待降解物达到吸附-解吸平衡,再打开灯源,在可见光条件下光催化降解RhB或TC,实验全程保持室温。光源与反应液之间的距离保持约为10 cm,每10 min取3 mL上层清液,高速离心以去除催化剂,再用722S型号的分光光度计进行吸光度的检测。
1.4 自由基捕获实验
为了进一步的探究该催化机理,在催化时加入不同的捕获剂乙二胺四乙酸二钠(EDTA-2Na)、叔丁醇(TBA)和苯醌(BQ)分别捕获反应过程中产生的空穴(h+)、羟基自由基(·OH)和超氧自由基(·O2-),以探究光催化降解过程中的活性物种。捕获剂捕获的活性物种如表1所示。并以不加入捕获剂的空白作为对比,分别考察此3种活性物种对该复合光催化剂的光催化降解效率的影响大小。

表1 捕获实验试剂及相关试剂用量Table 1 Capture experimental reagents and related dosages
2 结果与讨论
2.1 催化剂的XRD分析
由图1可看出,B-BVO0的特征衍射峰同时包含单斜相的BiVO4和斜方相的Bi4V2O11。其中2θ=28.6°、31.8°、46.0°、48.4°、54.7°、55.3°和 59.1°的特征衍射峰分别属于Bi4V2O11(PDF No.42-0135)的(113)、(020)、(220)、(206)、(133)、(313)和(226)晶面,其他的特征衍射峰则基本属于单斜相的BiVO4(PDF No.12-0293),这证明2种混合晶相钒酸铋的成功合成。当混合钒酸铋中引入金属 Bi后,B-BVO X(X=1,2,3,4,5,6)的特征衍射峰基本与B-BVO0一致,没有发现金属Bi的特征衍射峰,这可能是金属Bi的含量较低导致的。

图 1 B-BVO X(X=0,1,2,3,4,5,6)的 XRD 图Fig.1 XRD patterns of B-BVO X(X=0,1,2,3,4,5,6)
2.2 SEM、TEM和HRTEM图分析
如图为B-BVO0和B-BVO4的SEM图,从图2(a,c)可以看出B-BVO0和B-BVO4均为堆积的不规则的纳米片结构,图2(b,d)的侧面图也表明B-BVO0和B-BVO4均呈纳米片形状且两者形貌基本相似。由此可知,金属Bi的负载并不会对BiVO4&Bi4V2O11的形貌结构产生显著的影响。

图 2 B-BVO0(a,b)和 B-BVO4(c,d)的 SEM 图Fig.2 SEM images of B-BVO0(a,b)and B-BVO4(c,d)

图 3 B-BVO4 的 TEM(a~c)和 HRTEM(d)图Fig.3 TEM(a~c)and HRTEM(d)images of B-BVO4
图3 (a,b)的TEM图表明B-BVO4为堆积的纳米片结构,与SEM的结果一致。图3c表明纳米片上较均匀的沉积了不规则的金属Bi纳米颗粒。为了进一步证明Bi/BiVO4&Bi4V2O11的成功合成,对BBVO4进行了HRTEM表征(图3d)。B-BVO4中晶格间距 0.299,0.312和 0.329 nm分别归属于 BiVO4(PDF No.12-0293)的(004),Bi4V2O11(PDF No.42-0135)的(113)和 Bi(PDF No.51-0765)的(020)晶面。
2.3 XPS分析
用XPS光谱来测定B-BVO4的元素组成和化学态,结果如图4所示。图4a为B-BVO4的全谱图,结果显示B-BVO4存在Bi、V、O、C四种元素。图4b为Bi4f的高分辨XPS图谱,2个强峰158.6和164.1 eV 分别属于 Bi3+的 Bi4f7/2和 Bi4f5/2[25],2 个弱峰 157.3和 162.6 eV 归属于金属 Bi[26-27]。 图 4c为 V2p 的高倍XPS图谱,图谱中在516.4和523.9 eV的峰分别属于 V5+的 V2p1/2和 V2p3/2[28]。 图 4d 为 O1s 的高倍 XPS图谱,图中位于529.6和531.2 eV的特征峰分别属于羟基和晶格氧[29-30]。
2.4 UV-Vis DRS 光谱分析

图4 B-BVO4的XPS图谱Fig.4 XPSof B-BVO4

图 5 B-BVO X(X=0,1,2,3,4,5,6)的 DRS图谱Fig.5 DRSspectra of B-BVO X(X=0,1,2,3,4,5,6)
如图5a的UV-Vis DRS光谱图所示,当金属Bi沉积在BiVO4&Bi4V2O11表面后,复合物的吸收边均明显发生红移。这可能是半导体BiVO4&Bi4V2O11表面沉积金属Bi后光催化活性提高的原因之一。此外, 根据 Tauc plot等式得到带隙图 (图 5b):(αhν)2=A(hν-Eg),其中 α,h,ν和 Eg分别表示光吸收系数,普朗克常数,光子频率和带隙,A为比例常数。由图作切 线 可 得 B-BVO0、B-BVO1、B-BVO2、B-BVO3、BBVO4、B-BVO5和 B-BVO6的带隙分别为 2.63、2.59、2.61、2.58、2.52、2.57 和 2.55 eV。由此证明金属Bi的引入能够缩短混合钒酸铋的带隙。
2.5 催化剂的氮气吸附-脱附曲线和孔径分布
图6为B-BVO0,B-BVO4的N2吸附-脱附等温曲线和B-BVO4的孔径分布图。结果显示B-BVO0和B-BVO4均为Ⅲ型等温线,且插图表明B-BVO4具有介孔结构。B-BVO0和B-BVO4的比表面积分别为2和5 m2·g-1,B-BVO4增大的比表面积可能是其活性增强的原因之一。

图6 B-BVO0,B-BVO4的N2吸附-脱附等温曲线和B-BVO4的孔径分布图(插图)Fig.6 N2 adsorption-desorption isotherms of B-BVO0,B-BVO4 and the corresponding pore size distribution curves(inset)of B-BVO4
2.6 催化剂的光催化性能
图 7 为 B-BVO X(X=0,1,2,3,4,5,6)对 RhB 脱色实验的活性比较,并以不加催化剂的RhB自身降解作为对照。由图7a可知,RhB的自降解可以忽略,且B-BVO0在光照30 min后的降解率仅有8.4%,在 其 表 面 沉 积 金 属 Bi 后 ,B-BVO1、B-BVO2、BBVO3、B-BVO4、B-BVO5、B-BVO6 复合材料的脱色率均比混合钒酸铋要高,分别为49.5%、78.0%、90.5%、95.6%、95.5%、94.9%。由此可知,当金属Bi的负载量为0.8%时,B-BVO4材料的脱色率最高。但当金属Bi的负载量继续增加时,RhB的脱色率反而下降,这可能是过量金属Bi成为光生载流子的复合中心,从而限制了其催化效果[30]。与此同时,各催化剂的速率常数的大小与降解速率相一致,其中BBVO4的速率常数最大。另外,为了排除染料敏化的作用,对TC进行了催化降解。如图8所示,B-BVO0在光照60 min后只能降解37.9%的TC,引入金属Bi 后 ,B-BVO1、B-BVO2、B-BVO3、B-BVO4、B-BVO5和B-BVO6的降解率分别为37.9%、41.1%、55.7%、60.8%、68.4%、67.0%和 63.4%,均比 BiVO4&Bi4V2O11的光催化降解效果好。由此可知金属Bi的沉积有利于光催化活性的提高。金属Bi的引入促使催化剂对RhB和TC脱色效率增强的原因可能归因于金属Bi的SPR效应使得金属Bi与半导体BiVO4&Bi4V2O11复合后复合材料光生载流子的复合效率降低,比表面积增大及光吸收范围增强。
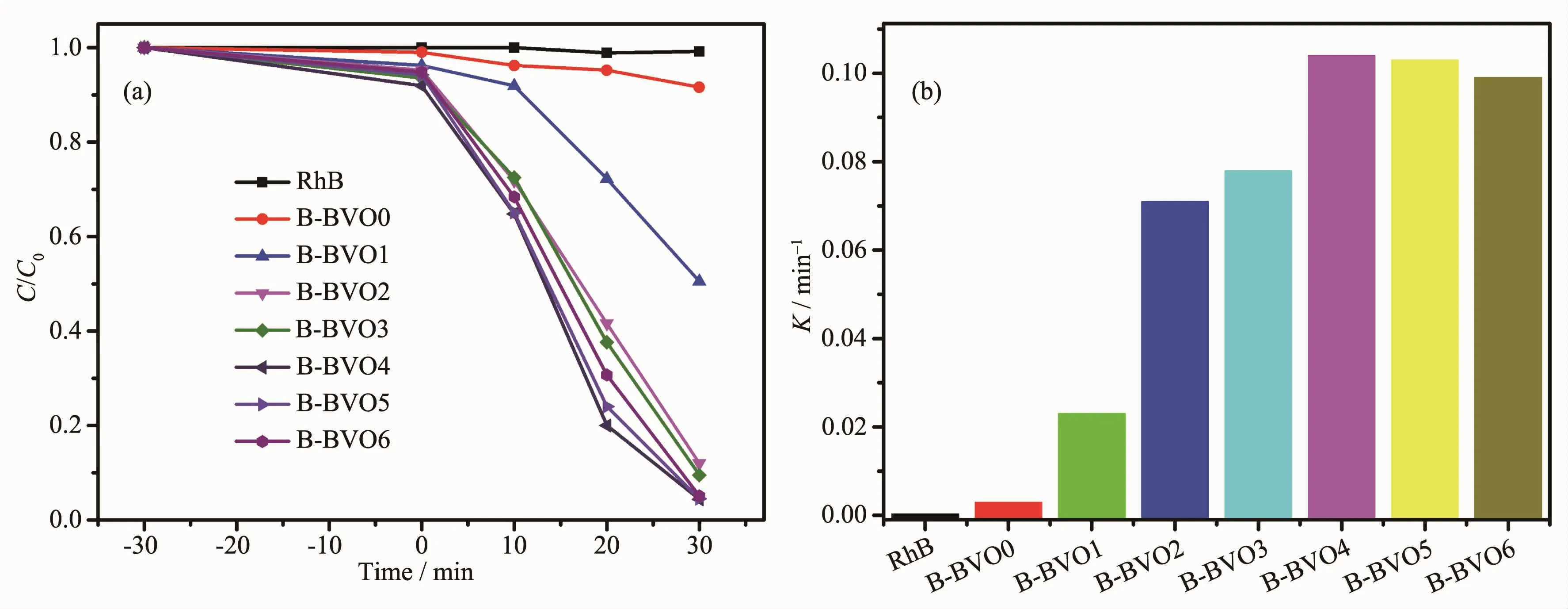
图7 光催化降解RhB(a)和相应的速率常数k(b)Fig.7 Photocatalytic degradation of RhB(a)and corresponding rate constant k(b)
光催化剂的稳定性对其实用性也有重要的意义。为了证明材料的稳定性,B-BVO4进行了5次循环实验,结果如图9所示。由图可知,B-BVO4在经过5次循环之后光催化降解效率仍能达到88.7%,说明催化剂的稳定性较好。
2.7 光催化机理
为了更好地了解光催化反应过程中光生载流子的分离和迁移速率,测试了B-BVO0和B-BVO4的PL。如图10显示,B-BVO0和B-BVO4的荧光光谱在362 nm处检测,且B-BVO4的荧光强度低于BBVO0。结果表明,BiVO4&Bi4V2O11表面引入金属Bi后,促进了光生载流子的分离和迁移,进而导致更高的光催化活性。
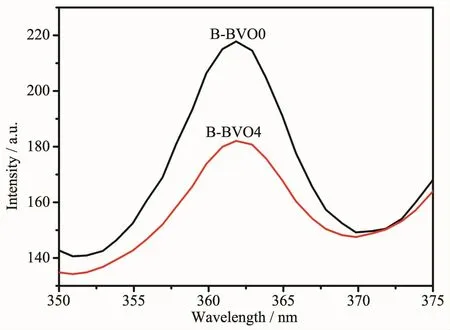
图10 B-BVO0和B-BVO4在激发波长为254 nm处的PL光谱Fig.10 PL spectra of B-BVO0 and B-BVO4 at the excitation wavelength of 254 nm
图11 为复合材料B-BVO4在可见光下对RhB溶液降解的捕获实验,并和未加捕获剂的空白实验作对比,以此证明光催化降解过程中参加反应的活性物种。如图所示,未加入捕获剂的降解速率常数为0.103 min-1,加入EDTA-2Na后,降解速率常数显著降低至0.001 min-1,说明h+起着关键性作用。同样,加入捕获剂TBA、BQ后,降解速率常数分别减至0.073、0.066 min-1, 说明·OH 和·O2-起到一定的作用。由此可知,此催化降解反应进程中,起着决定性作用的活性物种是h+。

图11 B-BVO4光催化剂在可见光下降解RhB的捕获实验Fig.11 Capture experiment of B-BVO4 photocatalyst for degradation of RhB under visible light irradiation
根据上述的实验结果和理论分析,提出了Bi/BiVO4&Bi4V2O11的光催化机理图 (图12)。BiVO4和Bi4V2O11均能在可见光下被激发,且BiVO4和Bi4V2O11能够构造异质结促进光生载流子的分离和迁 移[31-32]。 由 于 金 属 Bi可 以 作 为 电 子 陷 阱 ,当BiVO4&Bi4V2O11中沉积金属Bi后,BiVO4&Bi4V2O11导带(CB)上的电子被金属Bi捕获,有效地抑制光生h+和e-的复合,进而提高Bi/BiVO4&Bi4V2O11的光催化降解效率。该催化过程的具体反应如下:
Catalysts+hν→ e-+h+(1)
e-+O2→·O2-(2)
h++H2O→·OH (3)
·O2-+RhB→ Degradation (4)
·OH+RhB→Degradation (5)
h++RhB→Degradation (6)
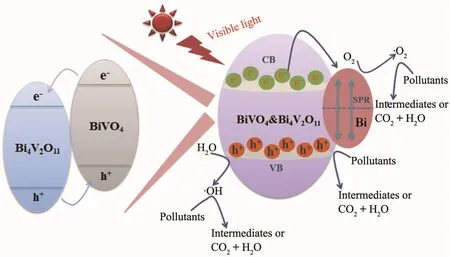
图12 Bi/BiVO4&Bi4V2O11催化剂的光催化机理图Fig.12 Photocatalytic mechanism of Bi/BiVO4&Bi4V2O11 catalyst
3 结 论
采用溶剂热反应和光辅助还原法制备Bi/BiVO4&Bi4V2O11纳米复合光催化剂,在可见光照射下,Bi/BiVO4&Bi4V2O11复合物与 BiVO4&Bi4V2O11相比,对污染物RhB和TC均表现出增强的光催化性能。光催化活性的提高的原因一方面归因于金属Bi的等离子体效应促进光生载流子的迁移和分离;另一方面金属Bi的引入拓宽了光响应吸收范围和增大了比表面积。此外,经由捕获实验可知,h+是光催化降解过程中起主要作用的活性物种,·OH和·O2-具有一定的作用。该项工作充分利用金属Bi的SPR效应和BiVO4&Bi4V2O11复合半导体的优越性能降解有色染料RhB和无色抗生素TC,为设计具有高活性和稳定性的材料提供一种新的思路。
