原发性肝癌患者外周血CD39+,CD73+调节性T细胞和自然杀伤(NK)细胞的表达及其与肝损伤的相关性*
2019-02-26沈海涛焦荣红陆志成谢钰帆蒋秀娣
沈海涛,焦荣红,陆志成,徐 正,谢钰帆,蒋秀娣
(1.上海中医药大学附属第七人民医院检验科,上海 200137;2.上海市浦东新区人民医院检验科,上海 201299)
原发性肝癌(HCC)是一种恶性程度极高的恶性肿瘤,临床治疗一直未取得显著性突破,预后较差,研究学者愈发关注免疫治疗及其预后指标的研究。近年来,调节性T细胞(Treg)作为CD4+T细胞的一种重要表型,在肿瘤微环境中发挥着特有的抵抗外源性抗原和免疫调节作用[1]。研究发现CD39+,CD73+在CD4+Treg细胞上的活化及表达是免疫抑制机制一个关键构成部分,现已证实其在感染、免疫性疾病、机械性损伤及缺血再灌注损伤等疾病的炎性反应控制过程中扮演着重要角色[2-4]。研究证实,免疫功能紊乱与肝损伤密切相关,但关于肝癌患者的免疫状态与肝功能损伤机制之间的关系仍缺乏足够证据[5]。本研究拟采用流式细胞技术,检测肝癌患者外周血CD39+,CD73+Treg表达水平,探讨其与患者肝损伤的相关性,旨在为肝癌的临床治疗提供参考。
1 材料与方法
1.1 研究对象 收集2013年1月~2017年12月在上海中医药大学附属第七医院收治的原发性肝癌患者(HCC组),共220例。入组标准:①均符合《原发性肝癌规范化病理诊断指南(2015年版)》的诊断标准[6],并经手术病理诊断证实;②均未接受过放化疗、分子靶向等抗肿瘤治疗;③排除肝炎病毒感染、自身免疫性疾病或心肝肾等重要器官功能障碍者。其中男性143例,女性77例,年龄45~79(53.7±5.2)岁。TNM分期:Ⅰ期86例,Ⅱ期93例,Ⅲ期41例;Child-Pugh肝功能分级:A级78例,B级106例,C级36例。并发肝损伤89例,无肝损伤131例。以ALT超过正常值2倍以上(1%肝细胞损伤可致ALT成倍升高),即ALT≥80 IU /L作为判定肝损伤的诊断标准[7]。选取同期收治的慢性乙肝患者(CHB组,n=100)及健康体检者(C组,n=100)。三组研究对象在年龄、性别构成比等一般资料方面比较,差异无统计学意义(P>0.05)。
1.2 试剂和仪器 TGL-16M台式高速冷冻离心机(上海卢湘仪离心机仪器有限公司);7600型全自动生化分析仪及配套试剂盒(日立公司);FACS Calibur流式细胞仪(美国BD Pharmingen公司)。
1.3 方法 采集HCC组、CHB组和C组清晨空腹静脉血5 ml,分装于两个EDTA抗凝管中。取2 ml充分颠倒混匀,3 000 r/min,离心半径20 cm,高速离心10 min,保留血浆备检。采用全自动生化分析仪及配套试剂盒检测肝功能指标,包括丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)。另取3 ml离心去除血浆后,PBS稀释,加入到含淋巴细胞分离液的离心管中,2 500 r/min离心20 min,吸取中间的白色絮状层,再用PBS洗涤2遍,即可分离外周血单个核细胞(PBMCs)。取2×106个PBMC染色、孵育后,采用FACS Calibur流式细胞仪测定CD4+Treg细胞中CD39+,CD73及自然杀伤(NK)细胞比例。

2 结果
2.1 各组外周血T淋巴细胞亚群比例表达情况 见表1。与C组比较,CHB组、HCC组外周血CD4+Treg细胞中CD39+,CD73细胞比例明显升高,而NK细胞比例明显下降,差异均有统计学意义(P<0.05)。与CHB组比较,HCC组外周血CD4+Treg细胞中CD39+,CD73+细胞比例明显升高,而NK细胞比例明显下降,差异均有统计学意义(P<0.05)。
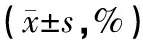
表1 各组外周血T淋巴细胞亚群比例表达情况比较
2.2 原发性肝癌患者外周血T淋巴细胞亚群比例与肝功能损伤的关系 见表2。并发肝损伤的肝癌患者外周血CD4+Treg细胞中CD39+,CD73+细胞比例明显高于无肝损伤的肝癌患者,而NK细胞比例则明显降低,差异均有统计学意义(P<0.05)。
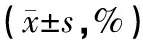
表2 原发性肝癌患者外周血T淋巴细胞亚群比例与肝功能损伤的关系
2.3 相关性分析 见表3。Pearson相关性分析显示,CD39+,CD73+与NK细胞呈显著负相关(r=-0.452,-0.424,均P<0.05)。AST,ALT与CD39+,CD73+细胞比例呈显著正相关,与NK细胞比例呈显著负相关(P<0.05)。
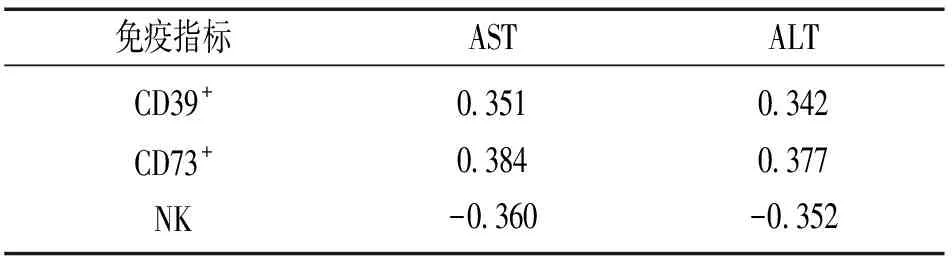
表3 原发性肝癌患者外周血T淋巴细胞亚群比例与肝功能指标的相关性(r)
3 讨论
HCC的发生机制尚未十分明确,多数观点认为其与患者的细胞免疫功能改变有关[8]。当机体免疫功能下降时,肿瘤的发生风险升高,且肿瘤进行性浸润生长使免疫功能进一步受到抑制[9]。PBMCs是包含T淋巴细胞等多种免疫活性细胞的集合体,在抗肿瘤免疫反应中发挥着重要作用。Treg作为具有独立功能的免疫抑制细胞亚群,能够抑制过度的炎性免疫反应和自身免疫反应性,并对组织器官起到保护作用,其在肿瘤微环境的作用一直是近年来的研究热点[10-11]。有研究显示,Treg可通过阻断效应T细胞、NK细胞对肿瘤细胞及病毒的杀伤作用,介导免疫逃逸,发挥中心免疫耐受,一定程度上促进了肿瘤的发生和发展[12]。CD39+,CD73+均特异地表达于Treg细胞表面,构成该细胞免疫抑制功能的重要环节[13]。近年来研究发现一个重要分子通路:胞外酶CD39+,CD73+腺苷通路,其中CD39+作为钙镁依赖的细胞外双磷酸酶,通过水解ATP,ADP为单磷酸腺苷,发挥抵抗血小板聚集、抑制炎症反应等作用。而CD73+属于细胞外5’核苷酸酶,通过糖基-磷脂酰肌醇与CD39协同表达于细胞膜外的一种多功能糖蛋白,可将单磷酸腺苷进一步水解为腺苷,后者可与CD8+T,NK细胞等效应性T细胞表面的腺苷1型嘌呤G蛋白偶联,发挥免疫抑制作用[14-15]。本研究结果显示,HCC组外周血CD4+Treg细胞中CD39+,CD73+细胞比例较C组和CHB组明显升高,而NK细胞比例则明显下降(P<0.05),说明HCC患者免疫细胞分布异常,Treg亚群变化不平衡,存在免疫功能抑制,与Turcotte等[16]研究结果一致。大量体内外实验证实,采用单克隆抗体等CD39+抑制剂,阻断其促肿瘤作用,可特异性抑制Treg细胞的抗肿瘤免疫作用[17]。Bonner等[18]实验发现,通过基因敲除小鼠CD73+后,可明显抑制恶性肿瘤的生长、转移。目前研究认为,肝癌所致肝功能损伤主要与以下两个方面因素有关:①肿瘤侵袭引起局部肝细胞坏死、胆管阻塞,随着肿瘤的进展可能破坏肝脏生理结构,加重肝功能受损;②非正常活化的免疫反应是导致肝脏免疫功能损害的关键[19-20]。本组病例中,并发肝损伤的肝癌患者外周血CD4+Treg细胞中CD39+,CD73+细胞比例明显高于无肝损伤的肝癌患者,而NK细胞比例则明显降低(P<0.05),提示HCC患者CD39+,CD73+细胞的表达与肝功能损伤存在相关性,并发肝损伤患者免疫功能抑制更为明显。相关性分析显示,CD39+,CD73+与NK细胞呈显著负相关(P<0.05),且AST,ALT与CD39+,CD73+细胞比例呈显著正相关,与NK细胞比例呈显著负相关(P<0.05),进一步验证了CD4+Treg细胞与肝损伤的关系。Xing等[21]研究认为,肝功能损伤早期HCC患者免疫功能处于亢进状态,晚期患者肝功能损伤加重,免疫功能逐渐转为抑制状态。
综上所述,HCC患者外周血CD39+,CD73+Treg表达水平明显升高,且与肝损伤密切相关。阻断CD39+,CD73+的表达可能有助于减轻肝损伤,并有望成为抗肿瘤免疫治疗的一种安全有效的途径。
