α-硫辛酸对高脂饮食肥胖小鼠术后空间学习记忆功能的影响
2019-02-26
肥胖在全球有流行趋势,据估计,全球超过11亿成人超重,其中3.12亿人属于肥胖。肥胖不仅易引发心脑血管病变、2型糖尿病、肿瘤,近年来发现肥胖病人发生术后认知功能障碍(postoperative cognitive dysfunction, POCD)的风险增加[1]。α-硫辛酸(α-LA)具有降低血脂、抗炎及抗氧化作用,神经保护作用也逐渐被报道,但具体机制尚不明确[2-3]。近些年,关于POCD的研究取得了很多的进展[4-7]。然而,对于肥胖病人POCD发病机制及有效的防治手段一直没有定论。本研究拟观察α-LA对高脂饮食(HFD)诱导的肥胖小鼠术后空间学习记忆功能的影响,并探讨可能的机制。
1 对象与方法
1.1 一般资料 120只雄性C57BL/6小鼠(14周)购于北京维通利华实验动物有限公司[批号SCXK (京)-2011-0011]。饲养于SPF级动物房,室温(24±1)℃,自由进食饮水,实验结束后苯巴比妥钠处死。
1.2 实验方法 小鼠被随机分为6组(对照组, 对照+手术组,对照+α-LA+手术组,HFD组, HFD+手术组,HFD+α-LA+手术组),每组20只。HFD、HFD+手术组和HFD+α-LA+手术组小鼠每日用高脂饲料(D12492, 60 kcal% Fat, Research diets, Inc, USA)喂养,其他组普通饲料喂养,持续12周。对照+α-LA+手术组和HFD+α-LA+手术组用α-LA(惠氏制药有限公司, 苏州) 100 mg/(kg·d)灌胃,持续12周,其他组等体积生理盐水灌胃。手术模型采用50 mg/kg苯巴比妥钠腹腔内注射麻醉,肝左叶及中叶切除。对照组和HFD组只接受麻醉处理。
1.3 行为学测试 术后第1~4天空间航行实验记录逃避潜伏期和游泳速度,第5天空间探索实验记录穿台次数及原平台象限滞留时间。
1.4 蛋白检测及透射电镜观察 术后第5天行为学测试结束后即刻取海马,免疫荧光法检测casepase 3、Bcl-2表达情况。透射电镜观察海马神经元、突触结构,计算突触密度、突触界面曲率、突触后活性区长度、突触间隙宽度和突触后致密物质(postsynaptic density,PSD)厚度。

2 结果
2.1 一般资料 HFD组、HFD+手术组体质量分别明显高于对照组、对照+手术组(P<0.01)。HFD+α-LA+手术组高脂饮食后14~84 d体质量明显低于HFD组和HFD+手术组(P<0.01)。见图1。

图1 各组高脂饮食期间体质量变化比较注:与对照组比较,*P<0.01;与对照+手术组比较,#P<0.01;与HFD+手术组比较,△P<0.01
2.2 水迷宫结果 术后第1天定位航行实验中,对照+手术组、对照+α-LA+手术组、HFD+手术组和HFD+α-LA+手术组逃避潜伏期均明显长于HFD组和对照组(P<0.01),HFD+手术组和HFD+α-LA+手术组游泳速度明显小于其他4组(P<0.01)。术后第2~4天,对照+α-LA+手术组逃避潜伏期明显短于对照+手术组(P<0.01或P<0.05);HFD+α-LA+手术组逃避潜伏期明显短于HFD+手术组(P<0.01),长于对照+α-LA+手术组(P<0.01);HFD+手术组游泳速度明显小于其他5组(P<0.01)。术后第3~4天,HFD+手术组逃避潜伏期明显长于对照+手术组。术后第5天空间探索实验中,对照+α-LA+手术组穿台次数及原平台象限滞留时间明显多于对照+手术组(P<0.01),HFD+α-LA+手术组穿台次数及原平台象限滞留时间明显多于HFD+手术组(P<0.01)。对照+α-LA+手术组和HFD+α-LA+手术组的穿台次数及原平台象限滞留时间组间比较差异无统计学意义。见图2。
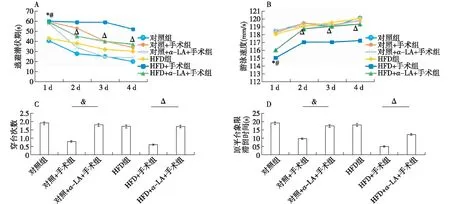
注: A、B为术后第1~4天定位航行实验; C、D为术后第5天空间探索实验。与对照组比较,*P<0.01;与对照+手术组比较,&P<0.01;与HFD组比较,#P<0.01;与HFD+手术组比较,△P<0.01图2 水迷宫结果
2.3 免疫荧光结果 术后第5天对照+α-LA+手术组海马casepase 3、Bcl-2蛋白表达水平明显低于对照+手术组(P<0.01);HFD+α-LA+手术组casepase 3、Bcl-2蛋白表达水平明显低于HFD+手术组(P<0.01)。对照+α-LA+手术组与HFD+α-LA+手术组的casepase3、Bcl-2蛋白表达水平,组间比较差异无统计学意义。见图3。
2.4 透射电镜结果 术后第5天,对照组和HFD组小鼠海马区神经元胞浆和胞核染色质分布均匀,细胞核形态规则,核膜光滑;其他组小鼠海马区神经元的超微结构发生了不同程度的病理改变。对照+手术组和HFD+手术组神经细胞核固缩,核膜凹陷、皱缩。对照+手术组突触密度、活性区长度、PSD厚度明显小于对照+α-LA+手术组(P<0.01);HFD+手术组突触密度、活性区长度、PSD厚度明显小于HFD+α-LA+手术组(P<0.01)突触密度,对照+α-LA+手术组和HFD+α-LA+手术组的活性区长度、PSD厚度组间比较差异无统计学意义。见表1。

表1 各组透射电镜下海马突触结构比较(±s)
注:与对照+手术组比较,*P<0.01;与HFD+手术组比较,△P<0.01

注: A为术后第5天海马casepase3表达; B为术后第5天海马Bcl-2表达;与对照+手术组比较,*P<0.01;与HFD+手术组比较,△P<0.01图3 术后第5天6组海马casepase3、Bcl-2表达比较
3 讨论
大量研究显示,术后学习记忆功能下降与海马神经元及突触数量减少、结构改变有关[8]。肥胖病人术后认知功能下降明显[9],具体机制及有效防治措施尚不明确。本研究采用HFD造肥胖小鼠模型,肝部分切除术后1~5 d发现小鼠的学习记忆功能明显下降。
α-LA是已知天然抗氧化剂中效果最强的一种,近年来,α-LA对神经细胞的保护作用取得很多研究者的认同。已报道的神经保护机制包括抑制凋亡信号调节激酶1/死亡结构域相关蛋白(ASK1/DAXX)信号、激活PI3K/AKT或PI3K/ERK途径等[10-11]。有研究发现α-LA调控突触可塑性蛋白[12],通过线粒体途径抑制神经元细胞凋亡[13]。本研究结果显示,α-LA干预12周可明显改善HFD小鼠术后学习记忆功能,降低小鼠体质量,降低海马casepase 3、Bcl-2表达水平。
突触界面结构参数是反映突触结构可塑性的敏感性指标, 与突触的功能状态及神经信息传递有重要的联系。突触界面曲率是突触前后膜隔着突触间隙相对应界面的曲率, 既反映神经递质释放的状况, 又是突触后膜上受体蛋白分子构像变化的标志。突触活性区是突触前膜与聚集成簇的突触小泡相接触形成的区域, 代表神经递质释放的有效面积。突触间隙是一个神经元与另一个神经元信息沟通的部位, 其大小与形态对突触活动的动力学有重要影响。PSD由突触后膜内侧胞浆中的蛋白复合体组成, 其中蛋白表达的改变就会引起PSD厚度的变化, 影响突触的传递效率。PSD厚度越大, 越有利于神经元之间的相互沟通[15]。本研究结果显示,α-LA干预12周后,小鼠的海马突触密度、活性区长度、PSD厚度明显改善,说明α-LA可维持小鼠神经元、突触正常结构。
综上所述,α-LA对HFD诱导的肥胖小鼠术后学习记忆功能有保护作用,其机制可能与抑制海马神经元凋亡,维持神经元、突触正常结构有关。
