某猪场高致病性猪蓝耳病和胸膜肺炎放线杆菌混合感染的诊断分析
2019-02-26石远菊汤德元廖少山郭倩妤
张 森,石远菊,汤德元,叶 丽,杨 伟,廖少山,郭倩妤
(贵州大学动物科学学院,贵州 贵阳 550025)
贵州省某猪场从湖北引进后备母猪500多头,引进后部分猪只出现咳嗽、喘气、呼吸困难、体温升高、耳朵部位皮肤发绀等临床症状,且免疫猪瘟疫苗后病症加重。引进1周左右,死亡6头,发病期间该猪场曾使用过泰乐菌素、氨苄西林,阿莫西林等抗生素进行治疗,但大部分猪病情未见好转,发病率反而上升。
1 临床症状
病猪精神沉郁,食欲减少或废绝,体温升高,出现不同程度的呼吸困难,喘气和咳嗽,鼻部间可见明显出血,被毛粗乱,共济失调,渐进性消瘦,眼睑水肿,少数病猪表现出咳嗽及双耳背面、边缘、腹部及尾部皮肤发绀,部分后备母猪于发病后2~4 d内死亡。
2 剖检变化
发病猪肺脏淤血、出血、坏死、有纤维素性渗出物(图1),肝脏肿大,淤血(图2),胃底部弥漫性出血(图3)
3 实验室诊断
3.1 细菌的分离培养
用灭菌接种环无菌取病变肝脏直接涂片后,经革兰氏染色于油镜下观察,有少量长丝状的红色杆菌(图4-A)。无菌接种于血清营养琼脂平板上,于37 ℃、CO2需氧/厌氧条件培养24~48 h,分离菌株在含FBS的LB琼脂培养基上培养约12 h后形成表面光滑、圆形、凸起、湿润、灰白色带金黄色荧光且不透明的菌落,结构细致,在菌落上面似有一层白色云雾(图4-B),用灭菌接种环挑取培养约12 h后的单个菌落,经革兰氏染色于油镜下观察,可见革兰氏阴性球杆菌,菌体细小,也可见杆状、丝状散在菌体(图4-C),培养基上的菌落形态及革兰氏染色镜检结果与胸膜肺炎放线杆菌的基本特性相符。

图1 肺脏淤血、出血、坏死、有纤维素性渗出物

图2 肝脏脏淤血、肿大

图3 胃底部弥漫性出血
3.2 细菌的生化特性鉴定
按照细菌生化鉴定管的说明书,将疑似菌落的纯培养物分别接种于 5 μL FBS的生化鉴定管中,置于 37 ℃ 5 % 的 CO2培 养 箱 中, 培 养24~48 h后观察结果。生化鉴定结果显示:分离菌株能发酵葡萄糖、麦芽糖、蔗糖、木糖和甘露醇,尿素酶、H2S阳性;吲哚试验、甲基红试验、VP试验、卫矛醇试验、KCN试验阴性。以上生化结果参考《伯杰氏细菌鉴定手册》上的判断标准,与胸膜肺炎放线杆菌的生化特性基本相符。

图4 分离菌株的形态学观察
3.3 猪传染性胸膜肺炎放线杆菌的PCR鉴定
参照马晓平[1]建立的猪传染性胸膜肺炎放线杆菌的PCR检测方法,用煮沸法提取纯化的菌液的DNA为模板,用生物公司的APP引物(dsbE-F:5'-GCTTCCATACTTGCCTTATTCG-3';dsbER: 5'-TCGGTTGATCGGAATAGGTAAG-3')进行PCR扩增,预扩增片段为374 bp。反应结束后取PCR产物5 μL,用1.0%琼脂糖凝胶电泳检查,扩增的片段与预期目的片段374 bp接近(图5),将分离菌株的目的片段回收纯化后送华大基因公司测序。测序结果分析表明:分离的菌株与NCBI上的胸膜肺炎放线杆菌菌株有99.1 %~99.6 %的同源性。
3.4 猪传染性胸膜肺炎放线杆菌的药敏试验
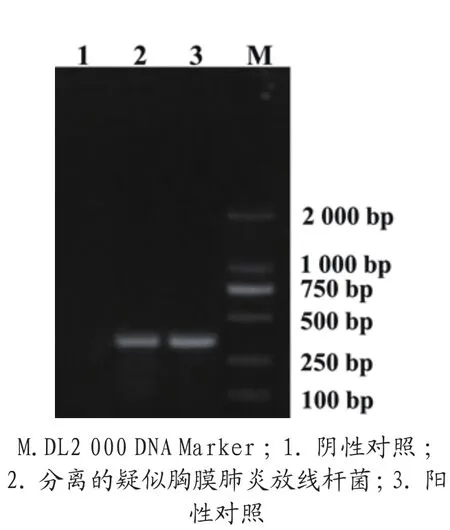
图5 分离菌株APP dsbE基因的PCR扩增结果

图6 药敏试验结果
挑取含FBS的LB琼脂平板上的单个菌落于LB液体培养基中增菌培养, 约 12 h 后 取 0.5 mL 菌 液 均 匀 涂布于含FBS的LB琼脂平板表面,待菌液吸收后贴上链霉素、磺胺甲基异唑、卡那霉素、环丙沙星、多西环素、阿莫西林、青霉素、庆大霉素、头孢曲松等9种药敏纸片,置37 ℃培养箱中培养12~24 h,用直尺测量抑菌圈直径,参考药敏试验抑菌圈直径判定标准(WS-T125-1999) 判定药敏试验结果。药敏试验结果显示(图6):分离的APP对磺胺甲基异唑的抑菌圈直径为17 mm,高敏;对头孢曲松的抑菌圈直径为11 mm,中敏;对链霉素、卡那霉素、环丙沙星、多西环素、阿莫西林、青霉素、庆大霉素等抗生素的抑菌圈直径在10 mm以下,敏感性低或不敏感。
3.5 动物致病性试验
挑取含FBS的LB琼脂平板上的单个菌落于5 mL 含FBS的LB液体培养基中增菌培养,约12 h后分别吸取菌液原液、用LB液体进行1:1稀释、1:10稀释、1:20稀释,最后用注射器分别吸取4个梯度的菌液,对4组小白鼠进行腹腔注射,每组雌雄小白鼠各一只,每组小白鼠分别注射1 mL菌液原液、1 mL1:1 稀释的菌液,1 mL 1:10 稀释的菌液,1 mL 1:20稀释的菌液,最后用两只小白鼠分别腹腔注射1 mL LB液体作正常对照,注射10 h内每隔2 h观察1次小白鼠的活动情况。
试验组注射菌液1 h内小鼠不采食和饮水,喜用嘴啃食腹部,2 h后小鼠精神沉郁,不活动,8 h后注射原液的小鼠死亡,24 h后注射1:1稀释菌液的小鼠也死亡,72 h后注射1:10稀释菌液的小鼠死亡,剖解死亡的小鼠,发现腹腔中有大量脓液,肠壁变薄,肠腔充满黄色内容物,肺脏出血,肝脏淤血、坏死,脾脏淤血、坏死(图7)。无菌采取小鼠的肺脏进行涂片,革兰氏染色镜检出现大量革兰氏阴性长短不一的红色杆菌(图8),与猪肺脏组织涂片的染色镜检结果相同。
3.6 高致病性猪蓝耳病RT-PCR检测
采集送检猪的肺脏、肝脏及胃黏膜,取病变部位混合研磨,反复冻融3次,匀浆器磨20 min后收集匀浆液,12 000 r/min 离心 10 min,取上清液, 用 TaKaRa MinBEST Viral DNA/RNA Extraction Kit Ver.5.0 试 剂 盒 提取核酸。参照浙江省地方标准(DB 33/T 822—2011)中高 致病性猪 蓝耳病RT-PCR检测方法对提取的核酸进行RT-PCR检测,引物序列(P1:5'-ATGGGCGACAATGTCCCTAAC-3';P2:5'-GAGCTGAGTATTTTGGGCGTG-3'), 待检样品出现421 bp的扩增条带,为HPPRRSV 阳性 ;待检样品出现 511 bp 的扩增条带,判定为美洲型PRRSV阳性。病变组织核酸经RT-PCR扩增出了421 bp的特异性条带(图 9)。
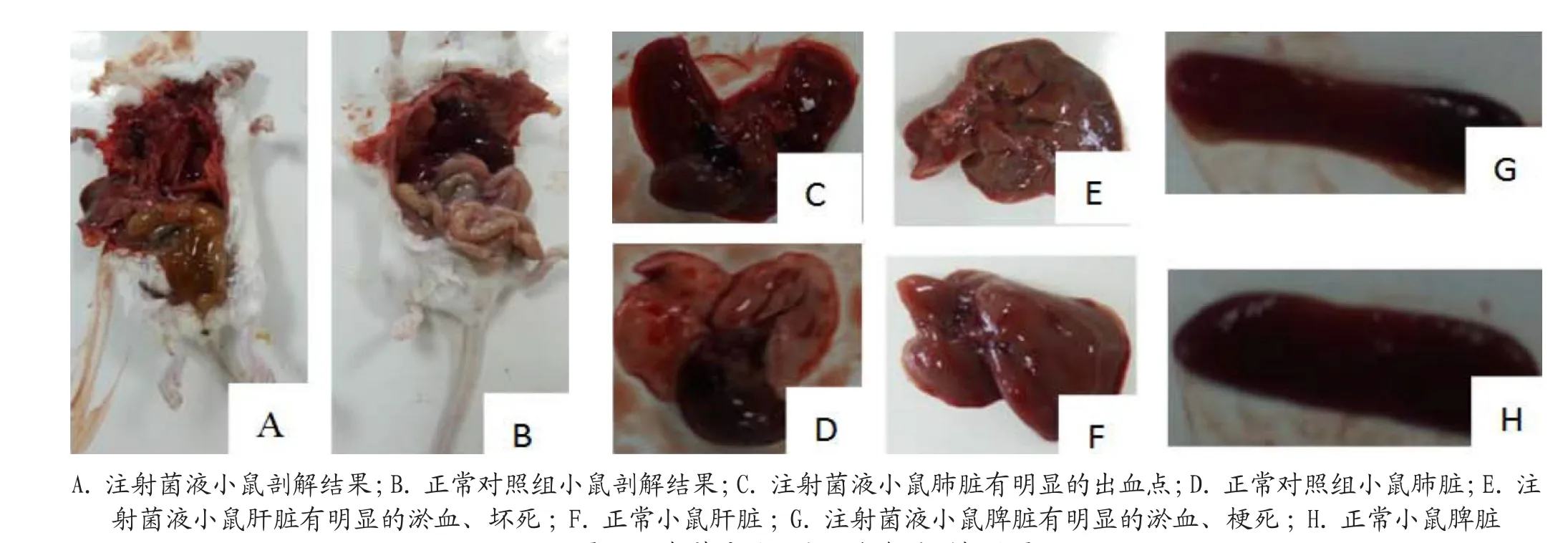
图7 注射菌液后死亡小白鼠的剖解结果

图8 小鼠肺脏涂片革兰氏染色镜检结果(10×100)
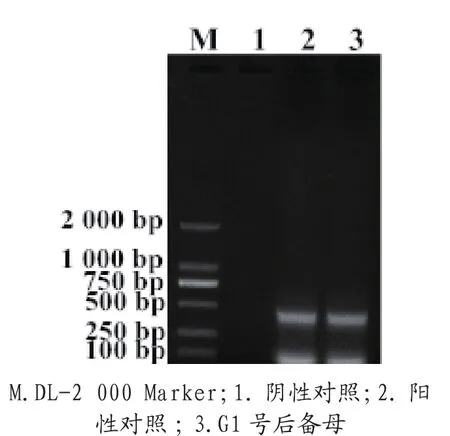
图9 猪高致病性蓝耳病毒RT-PCR扩增结果
将G1号后备母猪的PCR产物胶回收克隆后送昆泰锐(武汉)生物技术有限责任公司测序,应用MegAlign和MEGA软件把测序结果与GenBank上已收录的国内毒株进行进行核苷酸同源性分析及构建遗传进化树。核苷酸同源性分析结果显示(表1):PRRSV-G1株与近几年来国内各个地区流行的12株高致病性猪蓝耳病毒株同源性较高,为99.0%~99.5%,其NSP2基因均缺失了30个氨基酸;与2005年以前的经典猪蓝耳病流行毒株的同源性较低,为88.4%~93.1%。遗传进化树分析结果显示(图10):PRRSV-G1株与2005以前的经典蓝耳病流行毒株亲缘关系较远,与2008年之后流行的高致病性蓝耳病毒株亲缘关系较近,且与2012年湖北分离的YC1202株属于同一遗传进化分支。
3.7 HP-PRRSV- G1 株的致病性试验
将G1号后备母猪的肺脏、肝脏及胃黏膜的病变部位混合研磨,反复冻融3次,匀浆器研磨后收集匀浆液,用MEM按1∶5的比例进行稀释,12 000 r/min 离心 10 min,取上清液用双抗处理,再用0.22 μm的细菌滤器过滤除菌,取0.5 mL接种已长满成单层Marc-145细胞,结果48 h后细胞出现变圆、固缩、折光性改变、聚集,最后脱落(图11)。72 h收毒后反复冻融3次,提取病毒的核酸经RT-PCR检测,检测出HP-PRRSV的特异性条带,说明该病毒能在Marc-145细胞上增值,且能产生CPE现象。
4 诊断结果与讨论
根据发病情况、临床症状、病理解剖、细菌的分离培养、染色镜检、生化特性鉴定、药敏试验、猪传染性胸膜肺炎放线杆菌PCR检测、小鼠致病性试验、猪高致病性猪蓝耳病RT-PCR检测及接种Marc-145细胞,确诊该猪场患病死亡后备母猪为高致病性猪蓝耳病和猪传染性胸膜肺炎放线杆菌混合感染,G1号后备母猪的核酸RT-PCR测序结果与2012年湖北分离的YC1202株(JX144928)属于同一遗传进化分支,且该猪场是从湖北引进的后备母猪,所以该猪场的高致病性猪蓝耳病可能是从湖北引种的猪场传染的。
此研究分离的猪传染性胸膜肺炎放线杆菌对小鼠具有较强的致病性,而马晓平[1]2005年分离的3株猪传染性胸膜肺炎放线杆菌注射小鼠后无明显病变,但注射试验猪后,3株分离的菌株均能导致猪出现体温升高,呼吸极度困难,呈犬坐势,耳朵、四肢等皮肤出现发红,口鼻流出带血的泡沫,双侧肺炎及肺脏大面积坏死,心脏血管充盈,肠系膜淋巴结肿大、充血,肠壁充血等症状。
随着临床生产实践中抗菌药物的大量使用,APP的耐药性也越来越严重。余波等[2]采用药敏纸片法对2014年3月份—2016年3月份在贵州省贵阳市、安顺市、遵义市、凯里市、兴义市、铜仁市、六盘水市、瓮安县15个规模化养猪场分离得到的31株猪传染性胸膜肺炎放线杆菌进行耐药性检测,结果18种抗生素中只有头孢噻吩、头孢拉定、氟苯尼考、泰乐菌素敏感。该研究从贵州福泉某猪场分离的菌株FA仅对磺胺甲基异唑和头孢曲松敏感,对链霉素、卡那霉素、环丙沙星、多西环素、阿莫西林、青霉素、庆大霉素等抗生素耐药。菌株FA分离于贵州省某猪场病变猪的肺脏,该猪场用过泰乐菌素、氨苄西林,阿莫西林等药物,这可能与养殖场在猪病的防治上滥用抗生素有关。

表1 PRRSV-G1株的核苷酸同源性分析

图10 PRRSV-G1株的遗传进化树分析
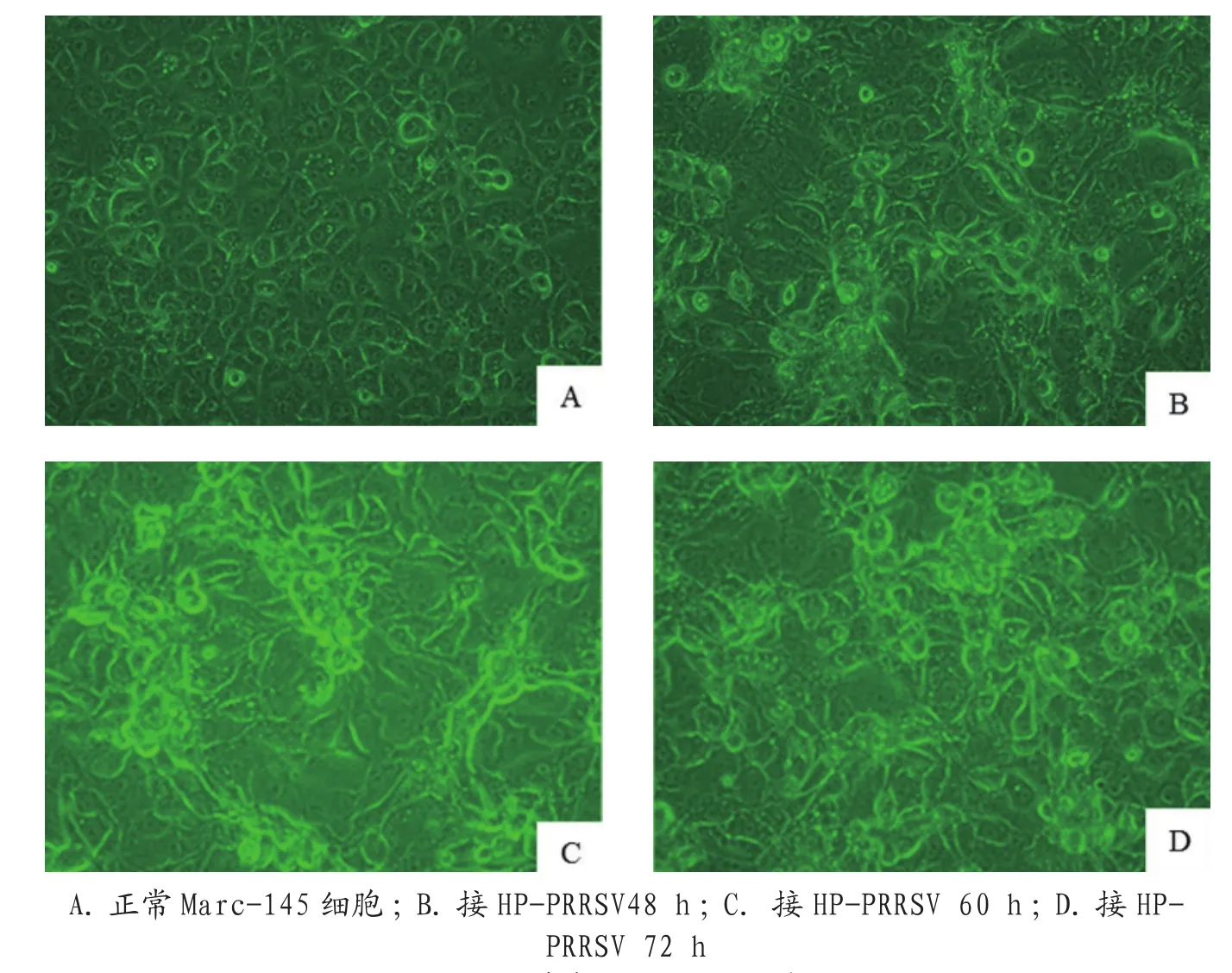
图11 HP-PRRSV-G1株在Mark-145细胞上的病变结果
2006年5 月,我国的江西省暴发了“猪高热病”,仔猪发病率100%、死亡率达50%以上,母猪流产率达30%以上,育肥猪也可发病死亡是其一个特征。该病自首次暴发后便在我国主要养猪省份迅速暴发,导致超过100万头猪死亡,给我国养猪业造成了极大的经济损失。经研究证实,引起此次疫病的主要病原是变异的美洲型PRRSV,称为高致病性猪繁殖与呼吸综合征病毒[3-4]。由其引起的疾病被称为高致病性猪繁殖与呼吸 综 合 征(Highly pathogenic porcine reproductive and respiratory syndrome,HP-PRRS)。通过血清中和试验和基因序列分析,确定高致病性猪蓝耳病病毒为美洲型PRRSV。其蛋白(NSP2)存在2处不连续的缺失,其缺失位点为第481位和532~560位氨基酸;3’UTR非编码区第17位碱基缺失;其他基因未见缺失[5]。此研究的HP-PRRSV-G1株与近几年来国内各个地区流行的12株高致病性猪蓝耳病毒株同源性较高,为99.0%~99.5%,其NSP2基因均缺失了30个氨基酸;与2005年以前的经典猪蓝耳病流行毒株的同源性较低,为88.4%~93.1%。据原农业部统计,截至2007年12月9日,共有26个省份的310个县市发生高致病性猪蓝耳病疫情,发病猪31.26万头,死亡8.21万头[6];并且在临床表现上与以前一般的猪蓝耳病有很大不同。有如下特征症状:高热(40~42℃)、瘀点和红疹等等。尤其在暴发期间,很多成年猪和一些怀孕母猪也死于感染。然而在以前PRRSV感染造成的死亡大部分是小猪。
该猪场应结合本场生产实际情况,紧急接种高致病性猪蓝耳病(TJM-F92株)疫苗,同时根据药敏试验结果投喂敏感的药物,磺胺甲基异唑和头孢曲松,避免继发感染。猪场最好坚持自繁自养的原则,创建稳定的种猪群,不要随意引种。如必须引种,首先要弄清所引猪场的疫情,此外,还应进行血清学检测,阴性猪才可以引入,引入后必须建立适当的隔离区,做好监测工作,一般需隔离检疫4~5周,健康者才可混群饲养。最后,要定期对猪舍和环境进行消毒,保持猪舍、饲养管理器械及环境的清洁卫生,做好其他疫病的免疫接种,控制好其他疫病,特别是猪瘟、猪伪狂犬病、猪传染性胸膜肺炎、猪气喘病的控制。
