甘草黄酮对脂多糖诱导小胶质细胞iNOS表达和NF-кB活化影响☆
2019-02-26陈浩张皓洁师亮李滢昊任衍康景玮王燕宏李新毅
陈浩 张皓洁 师亮 李滢昊 任衍康 景玮 王燕宏 李新毅○☆
帕金森病(Parkinson disease,PD)是以中脑黑质多巴胺(dopamine,DA)能神经元渐进性减少为主要特征的中枢神经系统退变性疾病。近年来研究显示:小胶质细胞介导的脑内炎症与DA能神经元的丢失关系密切[1-2]。诱导型一氧化氮合酶(inducible nitric oxide,iNOS)是炎症反应主要的限速酶;NF-кB则是炎症信号通路关键的调节因子[3]。最新研究[4]显示:中药甘草的主要成分——甘草黄酮(glabridin,Gla)可减少PD小鼠中脑 DA能神经元的丢失,但其作用机制尚未完全阐明。本研究用 PD造模剂脂多糖(lipopolysaccharides,LPS)处理体外培养的小胶质细胞,模拟脑内炎症环境,观察Gla对LPS诱导的小胶质细胞iNOS和NF-кB表达影响,以期明确Gla神经保护效应的分子机制。
1 材料与方法
1.1 研究对象采用DMEM培养基(Hyclone)培养BV-2小胶质细胞(上海容创生物),置于5%CO2培养箱,37℃培养传代。取对数生长期细胞,调整浓度至4×105个/mL,接种于细胞爬片和24孔板,加DMEM培养基,培养3 d后随机分4组:Control组、LPS 组、3 μg/mL 和 5 μg/mL Gla处理组。 每组设6个复孔。Control组不进行药物处理;LPS组用1.0 μg/mL LPS(Sigma)处理 12 h;Gla 处理组分别用 3 μg/mL 和 5 μg/mL Gla(中国食药检验院)预处理BV-2细胞 2 h,再加 1.0 μg/mL LPS处理12h。
1.2 iNOS免疫荧光染色用4%多聚甲醛将培养的细胞爬片固定20 min,冲洗3次后,用山羊血清室温保湿封闭40 min,倾去不要冲洗,直接滴加iNOS 抗体(1:500,Neomarkers,兔单克隆抗体),4℃孵育过夜。次日冲洗后,滴加山羊抗兔IgG-FITC(1:150,武汉博士德生物),室温保湿孵育1 h,冲洗3次,DAPI复染后,用水与甘油混合液封片,荧光显微镜下观察照相,采用IPP(6.0版本)图像软件计数iNOS阳性细胞数量。
1.3 iNOS和NF-кB p65免疫蛋白印迹按照上述分组处理完成后,收集各组细胞,用核-浆蛋白提取试剂盒(南京凯基生物)分别提取胞浆蛋白和胞核蛋白,并进行蛋白定量。取样进行SDS-PAGE凝胶电泳分离蛋白,半干法电转移至PVDF膜,据分子量切取条带,脱脂奶粉封闭1 h,分别滴加iNOS 抗体 (1:800) 和 NF-кB p65 抗体(1:200,CST,兔多克隆抗体),胞浆蛋白内参为β-actin(1:1000,CST,兔多克隆抗体),胞核蛋白内参为PARP(1:500,上海生工,兔多克隆抗体),4℃孵育过夜,再滴加山羊抗兔IgG(1:500,武汉博士德生物),室温2 h,发光剂显色,X线暗盒成像。重复6次实验,采用Image J(1.44P版本)软件测量显影条带灰度,以目的蛋白与对应内参蛋白灰度比值表示目的蛋白表达水平。
1.4 统计学方法实验数据以均数±标准差(±s)表示,用SPSS 16.0进行统计学分析,组间比较采用单因素方差分析,两两比较采用LSD法,检验水准α=0.05,双侧检验。
2 结果
2.1 iNOS免疫荧光染色结果组间iNOS阳性BV-2细胞数量差异有统计学意义 (F=8.09,P<0.01),其中Control组iNOS阳性BV-2细胞数量较少,细胞突起较多,呈细长状(图1-A箭头);被LPS刺激后,大量 BV-2细胞呈iNOS阳性,与Control组相比差异有统计学意义 (表 1,P<0.01),iNOS表达于BV-2细胞胞体和突起,同时部分细胞胞体变圆钝,突起变少变粗短(图1-B箭头);经3 μg/mL 和 5 μg/mL 浓度 Gla 分别处理后,iNOS阳性BV-2细胞数量均较LPS组有明显减少 (表1,P<0.01),同时胞体逐渐缩小,细胞突起增多(图1-C,D箭头)。但两个不同浓度药物处理组iNOS阳性细胞数量差异无统计学意义(表1,P>0.05)。
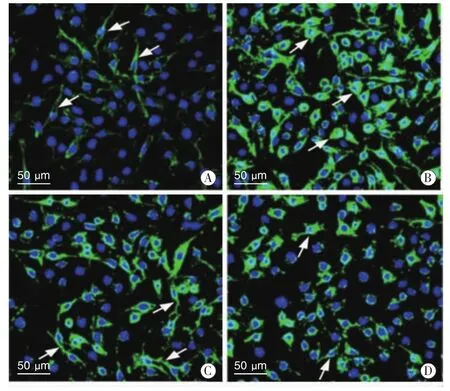
图1 免疫荧光技术检测iNOS在BV-2细胞的表达 (400×)。 A为Control组,箭头示突起细长;B为LPS组,箭头示胞体圆钝,突起粗短;C和D分别为3和5 μg/mL Gla处理组,箭头示胞体缩小,突起增多。
2.2 iNOS和NF-кB p65免疫蛋白印迹检测结果各组细胞胞浆 iNOS 蛋白(F=7.89,P<0.01)和胞核NF-кB p65 蛋白(F=6.12,P<0.01)水平差异有统计学意义。Control组BV-2细胞胞浆中有少量iNOS蛋白表达,胞核中NF-кB p65蛋白含量也很少(图2,表 1);经 LPS刺激后,BV-2细胞胞浆中iNOS 蛋白表达量急剧增加(图 2,表 1,P<0.01),同时胞核中NF-кB p65蛋白含量也显著增加(图2,表 1,P<0.01);给予 3 μg/mL 和 5 μg/mL Gla 处理后,胞浆中iNOS蛋白表达量均较LPS组有明显下降(图 2,表 1,P<0.01),同时胞核 NF-кB p65蛋白含量也均较LPS组有一定程度降低(图2,表1,P<0.01);但两个浓度组细胞胞浆iNOS蛋白和胞核NF-кB p65蛋白含量差异均无统计学意义(图 2,表 1,P>0.05)。
3 讨论

图2 免疫蛋白印迹检测BV-2细胞胞浆iNOS和胞核NF-кB p65表达
表1 Gla对BV-2细胞iNOS和NF-кB p65蛋白表达影响(n=6,±s)
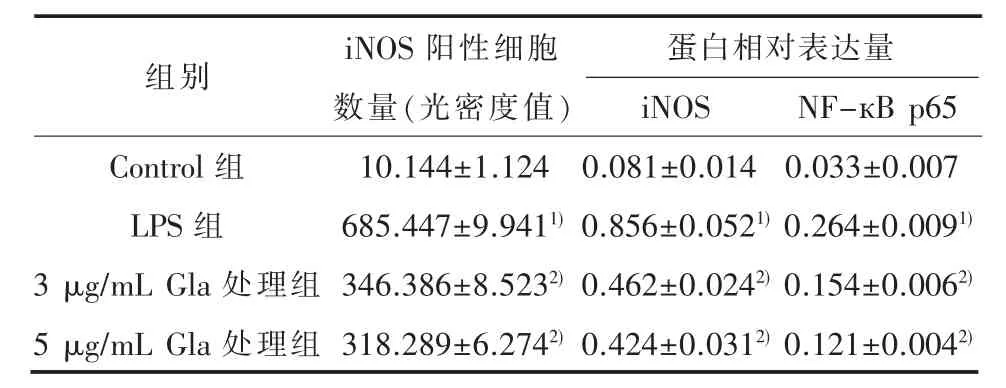
表1 Gla对BV-2细胞iNOS和NF-кB p65蛋白表达影响(n=6,±s)
1)与 Control组比较,P<0.01;2)与 LPS 组比较,P<0.01
组别 蛋白相对表达量Control组LPS组3 μg/mL Gla 处理组5 μg/mL Gla 处理组iNOS阳性细胞数量(光密度值)10.144±1.124 685.447±9.9411)346.386±8.5232)318.289±6.2742)iNOS 0.081±0.014 0.856±0.0521)0.462±0.0242)0.424±0.0312)NF-кB p65 0.033±0.007 0.264±0.0091)0.154±0.0062)0.121±0.0042)
小胶质细胞是脑内炎症主要的效应细胞,尤以中脑黑质分布最为密集[5]。PD患者尸检标本发现黑质存在小胶质细胞异常活化和炎症指标大幅升高[1,5]。iNOS是炎症反应过程中重要的限速酶,NOS基因突变的小鼠可明显抵抗PD造模剂的神经毒性。我们用LPS处理体外培养的BV-2小胶质细胞,发现小胶质细胞大量表达iNOS,与体内研究的实验结果一致[6]。iNOS大量表达是小胶质细胞活化的标志,其可导致大量炎性因子和氧化分子产生,造成DA能神经元继发损害[3]。形态学研究发现:被LPS刺激后,大量BV-2细胞胞体和突起均呈iNOS阳性,且胞体变圆钝,突起变少变粗短,也提示小胶质细胞正从静止的分支样向活化的阿米巴样转变。鉴于NF-кB是炎症信号调节网络的关键核心因子,且iNOS基因启动子受NF-кB亚单位 p65调控[7],我们检测了BV-2细胞核内NF-кB p65蛋白表达情况,以便明确iNOS表达的调控机制。结果发现在BV-2细胞胞质iNOS蛋白表达增加同时,伴有胞核内NF-кB p65蛋白含量升高。提示LPS可能通过激活BV-2细胞胞质内NF-кB,促进p65亚单位解离,并转位入核,启动iNOS基因表达和小胶质细胞活化。
传统中药甘草常被用于治疗PD的中药复方[8]。Gla是甘草所含两大组分中最具生物活性的一种。本课题组和其他团队用Gla处理PD小鼠模型,发现其可显著减少黑质DA能神经元的丢失[4,8],本文继续探讨其作用的分子机制。在肺炎、肠炎、关节炎等疾病研究中,甘草及其提取物表现出良好抗炎活性[9]。我们着重研究体外Gla对小胶质细胞活化的影响。根据文献[10]选用对细胞较为安全的3 μg/mL和 5 μg/mL浓度 Gla处理体外培养的BV-2小胶质细胞,结果显示两种浓度的Gla均可明显减少LPS诱导的iNOS阳性细胞数量增加和胞浆内iNOS蛋白表达水平升高,提示Gla对LPS诱导的小胶质细胞iNOS表达和细胞活化具有抑制作用。形态学观察也发现经Gla处理后小胶质细胞胞体减小,突起增多,向静止状态转变。有研究也证实用甘草提取物处理体外培养的单核巨噬细胞 (与小胶质细胞属同一种类)可抑制炎性因子分泌[11]。同时我们也注意到:3和5μg/mL浓度Gla对BV-2细胞iNOS表达影响不具有显著性差异,提示3 μg/mL浓度Gla即可发挥较大的生物学效益。此外甘草提取物还被报道可阻断内皮细胞NF-кB信号通路[12]。我们对比了 Gla处理前后 BV-2细胞核NF-кB p65蛋白含量的变化,结果显示Gla在减少LPS诱导的BV-2细胞iNOS表达同时,也降低了胞核NF-кB p65蛋白含量,提示Gla对LPS诱导的小胶质细胞NF-кB激活具有抑制作用。
综上所述,我们的研究结果说明Gla可能通过减少小胶质细胞NF-кB激活,调节LPS诱导的iNOS表达,从而抑制小胶质细胞活化,减轻黑质DA能神经元的免疫炎症损害。但是Gla对NF-кB信号通路的具体作用靶点和信号转导机制,以及Gla对PD患者的实际临床应用效果尚有待于进一步研究确定。
