5株猪流行性腹泻病毒流行株的遗传变异分析
2019-02-25朱海侠福州大北农生物技术有限公司福州350014
朱海侠 福州大北农生物技术有限公司 福州 350014
猪流行性腹泻(Porcine epidemic diarrhea,PED)是由猪流行性腹泻病毒引起的以腹泻、呕吐、脱水以及哺乳仔猪高致死率为特征的高度接触性肠道传染病[1]。主要表现为:7日龄仔猪死亡率高达100%;保育猪和育肥猪感染PEDV后出现腹泻、消瘦;母猪腹泻、无乳等,给猪场造成巨大的经济损失。猪流行性腹泻于1971年首次报道于英国,随后在比利时发现该病[2]。我国于1976年首次报道PED,并于1980年首次分离到PEDV[3]。2009年,韩国报道了PEDV毒株S基因发生变异[4]。我国于2010年底出现了高致病性猪流行性腹泻病毒变异株,且在以后的流行病学调查分析中均发现有PEDV变异株的流行[5]。2013年美国出现S-INDEL变异株OH851[6-7],Yamamoto等[8]也报道了一种低致病性PEDV S-INDEL。目前变异株S-INDEL和Non S-INDEL在美国、中国和日本流行[9]。PEDV变异株持续席卷养猪业,其致病力及致死率达到了空前高度,因此,探究PEDV在分子水平上的变异是防控该病的基础。本研究对福建、浙江、山东、河南4个省份5家猪场疑似猪流行性腹泻猪群的肝、脾、肺及肺门淋巴结、肠绒毛、肠系膜淋巴结等病料样品进行RT-PCR扩增,并对阳性样品S1基因及ORF3基因进行序列测定。通过对5家暴发PED猪场猪流行性腹泻抗原检测及序列分析,分析当前PED的流行情况、遗传变异规律及其免疫失败的可能原因,为更好地防控该病提供依据。
1 材料与方法
1.1 病料 病料采自福建、浙江、山东、河南地区猪场疑似猪流行性腹泻猪群的肝脏、脾脏、肺脏、肺门淋巴结、肠绒毛、肠系膜淋巴结等。
1.2 主要试剂 taco TMDNA/RNA Extraction Kit购自金瑞鸿捷(厦门)生物科技有限公司;AMV反转录酶、HPRI、Random primer、DL1000 DNA Marker和dNTPs(2.5 mmol/L)、prime STAR○RMax(2×)均购自宝生物工程(大连)有限公司。
1.3 方法
1.3.1 阳性样品抗原的确定 采用检测引物对5家猪场的 送检样品进 行PEDV、PCV、PRRSV、HCV、TGEV、PRV抗原常规的RT-PCR(PCR)检测,确定样品中抗原的感染情况及PEDV阳性样品。
1.3.2 S1、ORF3基因引物设计与合成及病毒核酸的提取 参照GenBank中登录的PEDV S基因及ORF3基因序列,通过Primer Permier 5.0和Oligo 7.0软件在其保守区设计引物,引物序列及病毒核酸提取参照[10-11]。
1.3.3 PEDV S1、ORF3基因的RT-PCR扩增与测序以PEDV阳性样品的cDNA为模板,用所设计的特异性引物进行RT-PCR扩增,反应体系50μL:其中2×Max 25μL、上下游引物(20μmol/m L)各1μL、cDNA 1μL,补充去离子水至终体积为50μL。PCR反应条件:98℃预变性2 min,98℃变性10 s;58℃退火5 s,72℃延伸5 s,30个循环。反应结束后,扩增产物用1.0%琼脂糖凝胶电泳检测。扩增产物送上海立菲生物技术有限公司进行序列测定。
1.4 序列分析 应用Lasergene 7.0软件、MEGA4.0软件对PEDV流行株S1部分基因及ORF3基因进行核苷酸同源性及遗传进化分析。
2 结果与分析
2.1 阳性样品的确定 采用检测引物对5家猪场的送检样品进行PEDV、PCV、PRRSV、HCV、TGEV、PRV抗原常规的RT-PCR(PCR)检测,确定5份阳性样品中均存在PEDV。其中pedv-ZJL、pedv-HeNY存在与PRRSV和HCV混合感染,pedv-SML存在与PRRSV混合感染,pedv-SDCH存在与HCV混合感染的情况,检测结果见表1。
2.2 S1基因、ORF3基因的PCR扩增 采用RTPCR方法对5株PEDV S1部分基因及ORF3基因进行扩增,结果获得与预期结果一致的目的条带。其中S1基因目的条带大小1 129 bp,ORF3基因目的条带大小728 bp(见图1)。
2.3 S1基因、ORF3基因遗传进化及核苷酸同源性分析 S1基因核苷酸同源性及遗传进化分析发现,构建的进化树分为两大分支GⅠ、GⅡ;5株流行株均位于GⅡ分支,其中pedv-SML株、pedv-SDCH株同属于S-INDEL, 与Italy/69979-25/2015株(KY009941)、OH851 株(KJ399978)、270SVN2015株(KT206205),IA2-2013株(KF468754)亲缘关系较近,其核苷酸同源性高达99.1%以上;pedv-HeNZ株、pedv-ZJL株同属于Non S-INDEL,与TW-ping-Tung-52 -2014 株 (KP276252)、AH2012 株(KC210145)、LZW2012(KJ777677)亲缘关系较近,其核苷酸同源性高达98.5%以上。5株流行株相互间核苷酸同源性为97.2%~98.5%(见图2-图3)。
ORF3基因核苷酸同源性及遗传进化分析发现,5株流行株均属于野毒株,其中pedv-ZJL株、pedv-HeNY株、pedv-SML株与变异株Tottori2/JPN/2014(LC022792)、KNU-141112-P10株(KR873435)亲缘关系较近,其核苷酸同源性高达100%,其相互间的核苷酸同源性高达99.6%~99.7%(见图4-图6)。

表1 5份送检样品不同类型抗原检测结果

图1 5份样品S1基因、ORF3基因RT-PCR扩增结果
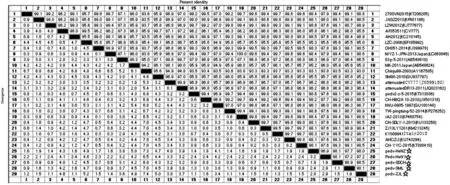
图2 5株PEDV流行株S1基因核苷酸同源性分析

图3 5株PEDV流行株S1基因遗传进化分析
3 讨 论

图4 5株PEDV流行株ORF3基因核苷酸同源性分析
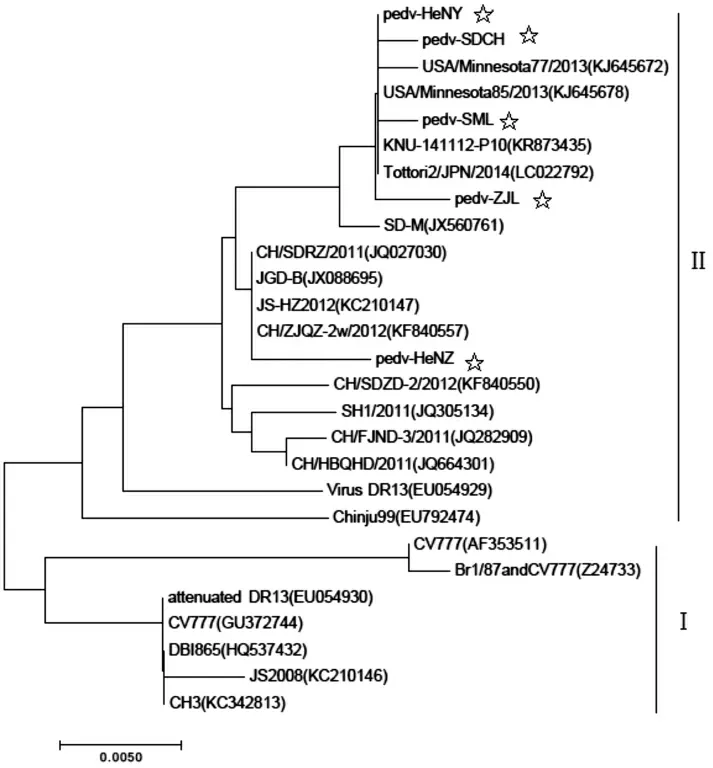
图5 5株PEDV流行株ORF3基因遗传进化分析
本研究对4个不同省份5家猪场送检的样品进行PEDV、PCV、PRRSV、HCV、TGEV、PRV等病原检测,结果发现:PED的流行大多伴随着猪瘟病毒和猪蓝耳病病毒的混合感染;对PEDV阳性样品ORF3基因及其S1部分基因生物信息学分析发现:5株PEDV毒株与当前中国猪流行性腹泻病毒变异株亲缘关系较近,与参考株CV777株及早期的分离株亲缘关系较远。S1基因遗传进化分析发现:5株PEDV病毒株同属于GⅡ分支,其中pedv-SML、pedv-SDCH属 于S-INDEL;pedv-HeNY、pedv-HeNZ、pedv-ZJL属于Non-S-INDEL;ORF3基因核苷酸同源性及遗传进化分析发现5株病毒株处于同一个大分支,其相互间核苷酸同源性为98.5%~99.9%;利用MEGA4.0软件对ORF3基因进行序列比对发现,5株病毒株均为野毒株,均存在49 bp的插入。5株流行株与Tottori/JPN/2014株变异株亲缘关系较近,其核苷酸同源性高达98.8%~100%。提示当前猪流行性腹泻仍以野毒感染为主,且猪流行性腹泻病毒在不断发生变异。

图6 5株PEDV流行株ORF3基因核苷酸比对分析
2010年,我国暴发了以变异株为主的PED[12],也报道了CV777疫苗对变异毒株无法提供完全的免疫保护力[13]。PEDV流行株与疫苗株抗原的差异是导致免疫失败的一个重要原因。本研究对当前PEDV流行株生物信息学分析发现,当前PEDV仍以变异株为主,既存在S-INDEL变异株,也有Non S-INDEL变异株。这一结果与Yamamoto R等[8]报道一致。Wang等[14]对2015年7个区域的PEDV进行分子特征分析,发现41家猪场29株分离株S1基因均属于Non S-INDEL,指出中国出现的S-INDEL株具有遗传多样性,且与Non S-INDEL株循环交替发生。
猪流行性腹泻仍然是导致仔猪高致死率的疾病之一,究其原因,可能是由于猪瘟、猪繁殖障碍与呼吸综合征等免疫抑制病混合感染引起PED免疫失败。与PEDV持续暴发不无关系,新变异株的持续出现使得现有疫苗的免疫保护效果大打折扣。Lin等[15]对YC2014株变异株攻毒保护试验分析发现,传统的灭活苗(DR3或CV777制成的疫苗)不能保护仔猪免受YC2014毒株的侵害,而YC2014株灭活苗可以对仔猪感染YC2014株提供100%的免疫保护。此外,猪流行性腹泻二联活疫苗临床使用情况及市场调查分析发现:免疫PED-TGE二联活疫苗(HB08株+ZJ08株)的猪群与免疫同类产品(经典株)相比,猪场发病的概率和损失均较低,表明流行株对PEDV变异株的免疫保护效果优于经典株。故选择合适毒株的疫苗免疫猪群显得尤为重要。
