视网膜中央静脉阻塞与阻塞性睡眠呼吸暂停综合征的相关性
2019-02-25陈莲王延辉杨帆何珂李晓清姜钊李璐希张鹏
陈莲 王延辉 杨帆 何珂 李晓清 姜钊 李璐希 张鹏
视网膜中央静脉阻塞(central retinal vein occlusion,CRVO)为临床常见的眼底疾病之一,可严重影响患眼视力。病理学研究表明,筛板水平或筛板后部的视网膜中央静脉血栓形成是导致CRVO的重要原因,其形成与多种因素有关,如高血压、糖尿病、动脉硬化、高黏度血症等全身性疾病以及青光眼、视网膜静脉炎等眼部疾病[1]。阻塞性睡眠呼吸暂停综合征(obstructive sleep apnea syndrome,OSAS) 是一组与呼吸中枢神经调节障碍以及上呼吸道狭窄、阻塞有关的睡眠呼吸疾病,其典型的临床特征为夜间睡眠打鼾伴呼吸暂停,可继发反复发作的夜间血氧饱和度降低和高碳酸血症,使患者因严重睡眠质量降低而导致白天嗜睡[2]。目前认为,OSAS是导致心血管疾病、糖尿病以及青光眼的重要危险因素[3-4]。
多导睡眠呼吸监测是目前国际公认的用于诊断OSAS的金标准[5]。由于CRVO为眼部血管性疾病,且其发病危险因素与导致OSAS的系统性病变类似,为了明确CRVO与OSAS的关系,本研究对CRVO患者中OSAS的发病状况进行了分析。
1 资料与方法
1.1一般资料选择2016年12月至2018年4月在西安市第三医院连续就诊的24例CRVO患者(CRVO组),均经双目间接眼底镜、房角镜及荧光素眼底血管造影(fundus fluorescein angiography,FFA)检查后予以确诊,并排除糖尿病、高血压、贫血、白血病、肝肾疾病等。CRVO组患者中,右眼高血压、发病者15例,占62.50%,左眼发病者9例,占37.5%。就诊时患者年龄31~75(50.71±9.49)岁。男17例,占70.83%;女7例,占29.17%。在136例于西安市第三医院耳鼻喉科睡眠实验室进行OSAS检查的眼病患者中,随机选择与CRVO组患者性别及年龄相匹配的24例患者为对照组,包括18例轻度白内障患者、4例原发性闭角型青光眼患者及2例干性年龄相关性黄斑变性患者。排除标准:患者有眼睑疾病(如眼睑松弛、下睑外翻等)、角膜溃疡、中重度白内障、高眼压症、开角型青光眼、眼底疾病(如视神经疾病、视网膜分支静脉阻塞等),或既往接受过内眼或外眼手术者。本研究经西安市第三医院伦理委员会批准同意。CRVO诊断标准[6]:患眼视力下降,其眼底各象限视网膜静脉迂曲、扩张,视网膜内出血呈火焰状沿视网膜静脉分布。视盘和视网膜水肿,黄斑区尤为明显。
1.2方法
1.2.1一般检查在进行夜间睡眠监测前,对CRVO组及对照组患者行晨起空腹血糖、糖化血红蛋白(glycosylated hemoglobin A1c,HbA1c)、静息状态下坐位血压、身高及体质量检查,并进行最佳矫正视力(best corrected visual acuity,BCVA)、眼压、瞳孔对光反射、裂隙灯显微镜下眼前节检查、直接及间接眼底镜下眼底检查、视网膜电图(electroretinogram,ERG)和FFA检查。
若患者在安静状态下收缩压≥140 mmHg(1 kPa=7.5 mmHg)和(或)舒张压≥90 mmHg,则被诊断为高血压[7]。若患者晨起空腹血糖≥7.0 mmol·L-1且HbA1c≥6.5%,则被诊断为糖尿病[8]。根据身高及体质量计算体质量指数(body mass index,BMI)[9]。
根据CRVO患眼是否存在相对传入性瞳孔障碍、BCVA、FFA显示视网膜无灌注面积及ERG所示b波降低幅度,对纳入研究的CRVO患者进行分型[10],24例CRVO患者中,13例为非缺血型CRVO(54.17%),11例为缺血型CRVO(45.83%)。
1.2.2夜间睡眠监测CRVO组及对照组患者于1900前进入西安市第三医院耳鼻喉科睡眠实验室适应环境,并在检查当日禁服安眠药、禁止饮酒、禁止饮用咖啡等兴奋性饮料,禁止午睡以及剧烈运动,以保证夜间睡眠质量。由同一名技师于 2000 将多导睡眠记录仪的电极及信号采集器连接于患者身体特定部位的皮肤表面(多导睡眠记录仪型号:Somté,澳大利亚Compumedics公司),通过多导睡眠记录仪对患者的呼吸暂停低通气指数(apnea-hypopnea index,AHI)、血氧饱和度、脑电图、眼动电图、肌电图、胸式和腹式呼吸张力图、鼻及口腔通气量进行持续记录,于第二日晨700结束睡眠监测。比较两组患者AHI及夜间平均最小氧饱和度。
若AHI≥5,即可诊断为OSAS。根据AHI对OSAS的严重程度进行分级:轻度OSAS:5≤AHI<15,中度OSAS:15≤AHI<30,重度OSAS:AHI≥30。
1.3统计学分析用SPSS 12.0统计软件进行统计分析,其中,对于患病率的比较采用费舍尔精确检验(Fisher’s exact test),对于AHI、夜间平均最小氧饱和度、 BMI等临床指标采用Mann-WhitneyU检验,P<0.05为差异有统计学意义。
2 结果
2.1两组患者的一般资料和多导睡眠监测结果比较两组患者的年龄、性别、OSAS患病率、BMI、AHI及夜间平均最小氧饱和度比较结果见表1,两组间OSAS患病率、BMI、AHI及夜间平均最小氧饱和度差异均有统计学意义(均为P<0.05)。
2.2OSAS患者与非OSAS患者的一般资料和多导睡眠监测结果比较AHI检测结果显示,两组中诊断为OSAS的患者共计27例,占两组总数的56.25%;非OSAS患者21例,占两组总数的43.75%。OSAS患者与非OSAS患者的年龄、性别、BMI、AHI及夜间平均最小氧饱和度比较结果见表2,OSAS患者与非OSAS患者的年龄、BMI、AHI及夜间平均最小氧饱和度差异均有统计学意义(均为P<0.05)。
2.3缺血型与非缺血型CRVO患者的一般资料和多导睡眠监测结果比较13例非缺血型CRVO患者与11例缺血型CRVO患者的年龄、性别、OSAS患病率、BMI、AHI及夜间平均最小氧饱和度比较结果见表3,两组间除年龄相差显著外(P<0.05),性别、OSAS患病率、BMI、AHI及夜间平均最小氧饱和度差异均无统计学意义(均为P>0.05)。

表1 两组患者的一般资料和多导睡眠监测结果比较

表2 OSAS与非OSAS患者的一般资料和多导睡眠监测结果比较
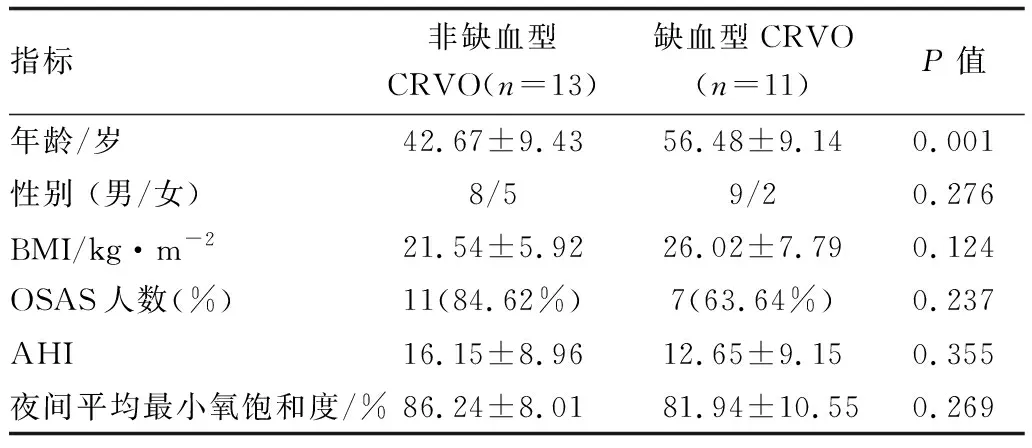
表3 非缺血型CRVO与缺血型CRVO患者的一般资料和多导睡眠监测结果比较
3 讨论
OSAS是睡眠过程中出现的因间歇性上呼吸道阻塞引起的频发性呼吸障碍,对OSAS的诊断主要依靠睡眠呼吸记录装置在患者夜间睡眠后对AHI的记录分析[2,11]。
在本研究中,我们用多导睡眠呼吸记录仪对24例CRVO患者及24例非CRVO患者进行了夜间睡眠呼吸监测。结果发现,18例CRVO患者(75.00%)有OSAS,CRVO组患者的AHI为18.89±14.54。而对照组中则有9例 (37.50%) OSAS患者,对照组的AHI为8.25±6.98。两组OSAS发病率、AHI差异均有统计学意义,这说明OSAS在CRVO患者中的发病率增加。OSAS发作过程中可导致患者动脉血氧分压下降、血二氧化碳分压上升,并进一步刺激肾上腺髓质大量释放儿茶酚胺,使血压升高[12]。本研究中OSAS患者的夜间平均最小氧饱和度较非OSAS者明显降低,证实了OSAS可导致患者处于低氧及二氧化碳潴留状态。
此外,因OSAS造成的缺氧可促使交感神经兴奋,造成小动脉收缩、外周阻力增加、血压下降等。长此以往,OSAS可促使脑血流自主调节障碍、供血不足以致患者出现智力减退、记忆下降、性格改变或行为异常等症状[13-14]。
目前已经证实OSAS与多种系统性疾病有关,如高血压、夜间低血压、糖尿病、动脉粥样硬化等[11]。这类系统性疾病可导致眼动脉或(和)视网膜中央动脉低灌注、眼静脉回流压力降低、血流迟缓、静脉血液呈高凝状态及血管内皮细胞受损,继发视网膜静脉血栓形成[1]。筛板水平或筛板后部的视网膜中央静脉血栓形成是导致CRVO的重要原因[15]。因此,OSAS可能是导致CRVO发病的使动因素。
OSAS多发生于老年人,OSAS在65岁以上人群中的患病率达20%~40%[16]。本研究中27例OSAS患者经多导睡眠呼吸记录仪监测后确诊,年龄为(59.67±9.32) 岁,而非OSAS患者的年龄为(53.31±7.04)岁,OSAS患者与非OSAS患者的年龄相差显著,说明年龄因素是导致OSAS的原因之一。除了年龄,身体肥胖也被认为是诱发OSAS的重要因素。BMI是科学评价体内脂肪总量的指标,是目前国际上常用的衡量人体胖瘦程度以及是否健康的标准[17]。本研究中我们发现CRVO患者的BMI明显高于非CRVO患者,说明肥胖是CRVO的危险因素之一,这可能与肥胖者更易发生高血压、动脉粥样硬化等导致CRVO发生的系统性病变有关。对比OSAS患者及非OSAS患者的BMI后发现,OSAS患者的BMI显著高于非OSAS患者,证实了肥胖在OSAS发病中的重要作用。
OSAS的发生与患者上呼吸道狭窄或堵塞,呼吸时气流不能畅通地进入气管、支气管有关。对于老年人而言,由于其呼吸道组织松弛、肌张力减退,可导致咽壁松弛、塌陷而内移易于引起鼾症或呼吸道异常[18]。对于肥胖者而言,其舌体常肥厚,软腭、悬雍垂和咽壁易有过多的脂肪沉积,这些均可导致肥胖者在睡眠状态时出现气道堵塞。此外,老年人及肥胖者更易发生前鼻孔或鼻咽部狭窄、鼻中隔偏曲、鼻息肉、肥厚性鼻炎、鼻腔及鼻咽肿瘤、腺样体或肥大、悬雍垂过长等是易于导致OSAS的病变发生的因素[19]。
根据视网膜组织损害程度,CRVO在临床上主要分为非缺血型及缺血型。非缺血型CRVO患眼的出血多在3~6个月后逐渐吸收,视力可逐渐提高。部分患者可因黄斑水肿而导致视力下降。缺血型CRVO患眼则因视网膜缺血、出血及水肿程度严重而视力受损严重,甚至部分患者可因眼内新生血管增生导致玻璃体积血、新生血管性青光眼等引起视力丧失[10]。
OSAS与CRVO的严重程度是否相关?在本研究中,我们对非缺血及缺血型CRVO患者中OSAS的发病率及年龄、性别等进行了对比分析。结果显示,除年龄外,OSAS未对CRVO的严重程度有影响。由于年龄越长者的系统性病变如高血压、动脉粥样硬化、糖尿病等的发病率越高,其对视网膜循环系统的影响也更为显著,这可能是缺血型CRVO患者的年龄高于非缺血型CRVO患者的原因[20]。
鉴于OSAS可能是CRVO发病的使动因素,或者与OSAS相关的系统性病变,如夜间低血压、高血压、动脉粥样硬化等可导致CRVO发生,因此有必要将OSAS的筛查及治疗作为预防和治疗CRVO发生的手段之一。对于OSAS的诊断主要依靠多导睡眠呼吸记录仪对患者睡眠过程进行连续的睡眠及呼吸状态观察和监测,其治疗可采用调整睡眠姿势减少舌根后附、减轻体质量、采用呼吸面罩进行鼻腔持续正压通气,以及实施腭垂腭咽成形术、扁桃体切除术及腺样体刮除术等以改善呼吸道通气状态[21]。
综上所述,OSAS与CRVO以及心脑血管性疾病、糖尿病等系统性疾病的发生发展密切相关。眼科医师必须高度重视OSAS与眼病的关系,在临床上加强与耳鼻喉科医技人员的合作,通过对OSAS的早期诊断及治疗以期减少CRVO的发生及发展。然而本研究尚有不足之处,如研究中的样本量较小,因此仍需进行大样本量的多中心性研究以进一步佐证OSAS在CRVO发病中的作用。
