淫羊藿总黄酮含药血浆对雄兔干眼泪腺上皮细胞凋亡模型Caspase-3、Caspase-8 mRNA表达的影响△
2019-02-25邓杰王方张姣姣洪作权万咪咪石玉恒胡文婧
邓杰 王方 张姣姣 洪作权 万咪咪 石玉恒 胡文婧
干眼又称角结膜干燥症,是由于任何原因引起的泪液质和(或)量的异常,或动力学异常而导致泪膜稳定性下降,并伴有眼部不适和眼表组织损害为特征的多种疾病的总称[1]。随着人们生活水平的提高及生活方式的多样化,近年来干眼发病率很高,已成为目前研究的热门问题。引起干眼的病因很多,发病机制尚未完全阐明,炎症及凋亡可能是各种类型干眼发病的关键机制,而雄激素水平的异常可能是此反应发生的重要原因[2]。在《本草纲目》中已有使用淫羊藿治疗眼部疾病的记载。前期研究表明[3],淫羊藿总黄酮可显著减轻炎性反应及细胞凋亡,改善细胞免疫,降低实验动物干眼的发生。其作用机制可能与黄酮类物质发挥抗细胞凋亡有关。本研究观察了淫羊藿总黄酮对雄兔干眼泪腺上皮细胞Caspase-3、Caspase-8 mRNA表达的影响,拟从抑制细胞凋亡治疗干眼的角度出发,结合中西医证候学研究方法,进一步揭示淫羊藿总黄酮治疗雄兔干眼的机制,为临床推广及应用提供科学依据。
1 材料与方法
1.1实验动物SPF级健康无眼疾的1月龄远交系新西兰大耳雄兔(贵阳中医学院动物实验中心提供)61只,体质量2.0~2.5 kg,普通饲料喂养,实验过程遵循国家科学技术委员会颁布的《实验动物管理条例》。
1.2主要试剂及仪器胎牛血清、青霉素/链霉素、胰蛋白酶、DMEM/F12(美国Hyclone公司),DMSO(美国Sigma),SYBR®Premix Ex Taq、PrimeScriptTMRT reagent Kit with gDNA Eraser(RNAiso Plus)(日本Takara公司),朝藿定A(纯度 98.13%)、淫羊藿苷(纯度 99.94%)(成都曼思特生物)。高效液相色谱仪、LC-MS/MS三重四级杆质谱仪(美国Agilent公司),PCR仪、NanoDrop 2000超微量分光光度计、荧光定量PCR(美国Thermo fisher)。引物由通用生物系统(安徽)有限公司合成,引物序列见表1。
1.3方法
1.3.1泪腺上皮细胞的原代培养随机选取1只雄兔,30 g·L-1戊巴比妥钠40 mg·kg-1腹腔注射深度麻醉,耳缘静脉注射空气处死,妥布霉素冲洗兔眼,常规无菌操作取出泪腺,用PBS平衡液清洗3遍;剥离其上的血管及纤维结缔组织,PBS平衡液中漂洗后将其剪成1 mm×2 mm的3小块。加入现配制的2 g·L-1II型胶原酶,37 ℃电热恒温振荡器中振荡消化25 min,离心,接种于培养瓶中,反复贴壁3次(每次15~20 min)纯化泪腺上皮细胞,置于37 ℃、含体积分数5%CO2培养箱中培养。36 h后首次半量换液,48 h后全量换液1次。以后每4 d换液1次。10 d后进行第一次传代。取第3代泪腺上皮细胞用于实验。

表1 引物序列表
1.3.2淫羊藿总黄酮含药血浆的获取60只新西兰大白兔随机分为淫羊藿总黄酮10.0倍组、5.0倍组、2.5倍组和空白对照组,每组各15只。按体表面积换算的方法计算每只兔的灌药量[单倍兔的剂量=X×70×0.07/1.5=3.27X(mg·kg-1);其中,X为人的剂量,即26 mg·kg-1],空白对照组灌同等剂量的生理盐水。各组灌胃1周后,用100 g·L-1水合氯醛腹腔注射麻醉,心脏穿刺抽取动脉血,在盛血的离心管中加入38 g·L-1枸橼酸钠溶液,颠倒混匀。3000 r·min-1离心10 min,收集上清液。0.45 μm手控式负压过滤器过滤分装后于-80 ℃超低温冰箱储存备用。
1.3.3含药血浆加入量的摸索(MTT法) 泪腺上皮细胞用DMEM/F12配成细胞悬液(100×103个·mL-1)加入96孔板,每孔90 μL,培养48 h后,吸尽孔中培养液。加入不同浓度的含药血浆,每孔总体积为200 μL,继续培养24 h,另以未加含药血浆的DMEM/F12培养液培养的同期传代的泪腺上皮细胞作对照。细胞培养至预定时间后,吸去各孔培养基,换上无血清的DMEM/F12 100 μL,并加入MTT(5 g·L-1)10 μL,继续孵育4 h。吸弃培养基,每孔加入二甲基亚砜150 μL,室温下于微量振荡器上振荡5 min。微量板读数仪测定每孔(波长490 nm)吸光度值(A值)。计算各组血浆对细胞的抑制率:细胞抑制率=(1-加药组A值/对照组A值)×100%。选择抑制率为50%左右的浓度,即IC50时的浓度作为干预细胞含药血浆的浓度。公式为LgIC50=Xm-I[P](3-Pm-Pn)/4[注:Xm:Lg 最大剂量;I:Lg(最大剂量/相邻剂量);P:阳性反应率之和;Pm:最大阳性反应率;Pn:最小阳性反应率]。公式中的最大、最小阳性反应率就是最大、最小抑制率。
1.3.4建立细胞模型及含药血浆干预细胞置于含体积分数10%胎牛血清、0.1 U·L-1青霉素和0.1 μg·L-1链霉素的DMEM/F12培养基中,培养在 37 ℃含体积分数5%CO2的细胞培养箱中。所培养泪腺上皮细胞随机分为淫羊藿总黄酮治疗组、含雄激素培养对照组、空白组,共3组。当细胞长至80%~90%融合时,去除培养基,加入PBS洗1~2遍,去除PBS,加入1 mL胰蛋白酶消化1~3 min后,加入3 mL 完全培养基中和胰蛋白酶终止消化,将消化的细胞转移至15 mL 离心管中,1000 r·min-1离心5 min。倒掉上清,加入3 mL培养基重悬细胞,13传代至培养皿中培养。待长到80%~90%融合时用胰蛋白酶消化后1000 r·min-1离心,去除上清,加入完全培养基重悬细胞,将细胞分别种在6孔板中,每孔种106个细胞。待细胞融合2 h之后,分3组加入含药血浆干预,淫羊藿总黄酮治疗组用含体积分数15%胎牛血清的DMEM/F12低糖培养基加含淫羊藿总黄酮血浆进行培养,含雄激素培养对照组用含体积分数15%胎牛血清的DMEM/F12低糖培养基加10-6mol·L-1丙酸睾酮进行培养,空白组用含体积分数15%胎牛血清的DMEM/F12低糖培养基加空白血浆进行培养。48 h后,淫羊藿总黄酮治疗组、含雄激素培养对照组、空白组分别加入100 μmol·L-1H2O2继续培养 60 min,诱导凋亡。去除培养基,PBS洗一遍,去除PBS,加入1 mL Trizol,室温放置2 min,将Trizol 转移至无RNA酶的EP管中。加入氯仿1 mL,用力振摇 15 s,室温静置15 min,离心(4 ℃,12 000 r·min-1,15 min)。离心后液体分为三层,小心吸取上层无色液体移入一新的 EP 管中。加入等体积异丙醇,上下颠倒混匀,室温静置 5 min,离心(4 ℃,12 000 r·min-1,10 min)。去上清,沉淀加入体积分数75%乙醇1 mL,轻微振荡15 s,离心(4 ℃,7500 r·min-1,5 min)。小心去上清,管内沉淀在超净台中鼓风静置干燥 3~5 min,用枪头吸弃上清,尽量去除干净。加入0.05 mL DEPC水溶解,使用NanoDrop 2000超微量分光光度计检测浓度,-80 ℃冰箱保存。
1.3.5血药浓度的检测取各组血浆样品50 μL,加入甲醇0.3 mL,涡旋振摇3 min,12 000 r·min-1离心5 min。吸取上清液,40 ℃氮气流吹干,加0.1 mL体积分数30%乙腈复溶,12 000 r·min-1离心5 min,取上清液50 μL进样LC-MS/MS分析。
1.3.6RT-PCR检测RT-PCR检测细胞凋亡相关基因Caspase-3、Caspase-8 mRNA的表达,具体步骤按试剂盒说明书进行。

2 结果
2.1泪腺上皮细胞的培养原代细胞培养第2天,细胞形态舒展,呈长三角形,培养基中悬浮一些死细胞,待细胞慢慢增殖经胰蛋白酶消化传代,第1代、第2代、第3代均无明显漂浮死细胞,细胞呈长三角形,形态舒展。具体见图1。
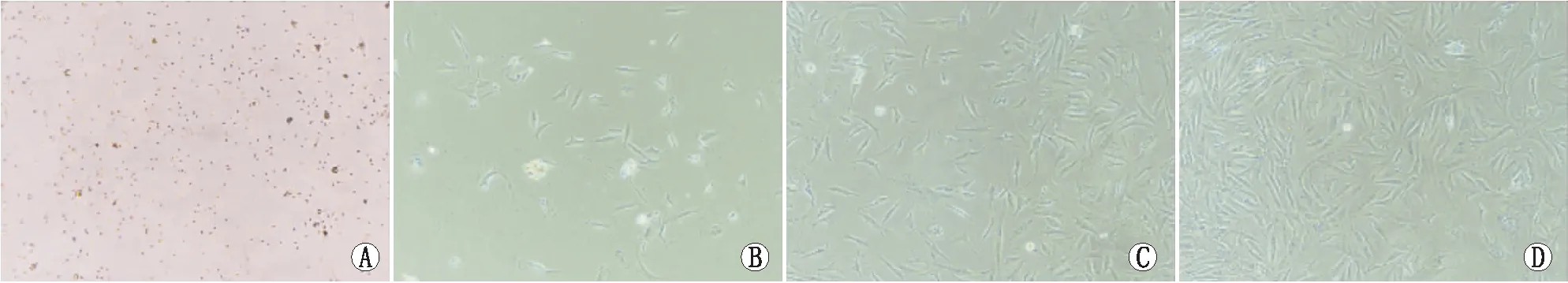
图1 泪腺上皮细胞培养图。A:原代泪腺上皮细胞;B:第1代泪腺上皮细胞;C:第2代泪腺上皮细胞;D:第3代泪腺上皮细胞
2.2含药血浆加入量的确定淫羊藿总黄酮10.0倍组、5.0倍组、2.5倍组和空白对照组细胞抑制率分别为(0.08±0.09)%、(0.09±0.06)%、(0.05±0.06)%、(0.02±0.06)%,故选取淫羊藿总黄酮2.5倍组作为干预细胞含药血浆的浓度。
2.3血药浓度的检测在本实验所采用的LC-MS/MS条件下,朝藿定A、淫羊藿苷的保留时间分别为3.1 min、3.7 min。朝藿定A和淫羊藿苷互不干扰,峰形良好,无杂峰干扰,基线平稳(图2)。淫羊藿总黄酮10.0倍组、5.0倍组、2.5倍组和空白对照组兔血浆中朝藿定A浓度分别为120.5 μg·L-1、65.7 μg·L-1、21.9 μg·L-1、0 μg·L-1,淫羊藿苷浓度分别为130.8 μg·L-1、45.3 μg·L-1、18.9 μg·L-1、0 μg·L-1。
2.4RT-PCR检测GAPDH在不同样本中的扩增曲线和熔解曲线见图3。从Ct值及其图像可知,内参基因GAPDH在各个样本中扩增效果良好,说明各样本的反转录等没有问题。各组Caspase-3、Caspase-8 mRNA扩增曲线和熔解曲线见图4、图5。淫羊藿总黄酮治疗组、含雄激素培养对照组、空白组的Caspase-3 mRNA相对含量分别为0.35±0.07、0.68±0.18、1.00±0.19,Caspase-8 mRNA相对含量分别为0.27±0.21、0.72±0.10、1.00±0.15。空白组Caspase-3、Caspase-8 mRNA的表达均高于含雄激素培养组,空白组和含雄激素培养组Caspase-3、Caspase-8 mRNA的表达均高于淫羊藿总黄酮治疗组,差异均有统计学意义(均为P<0.05)。
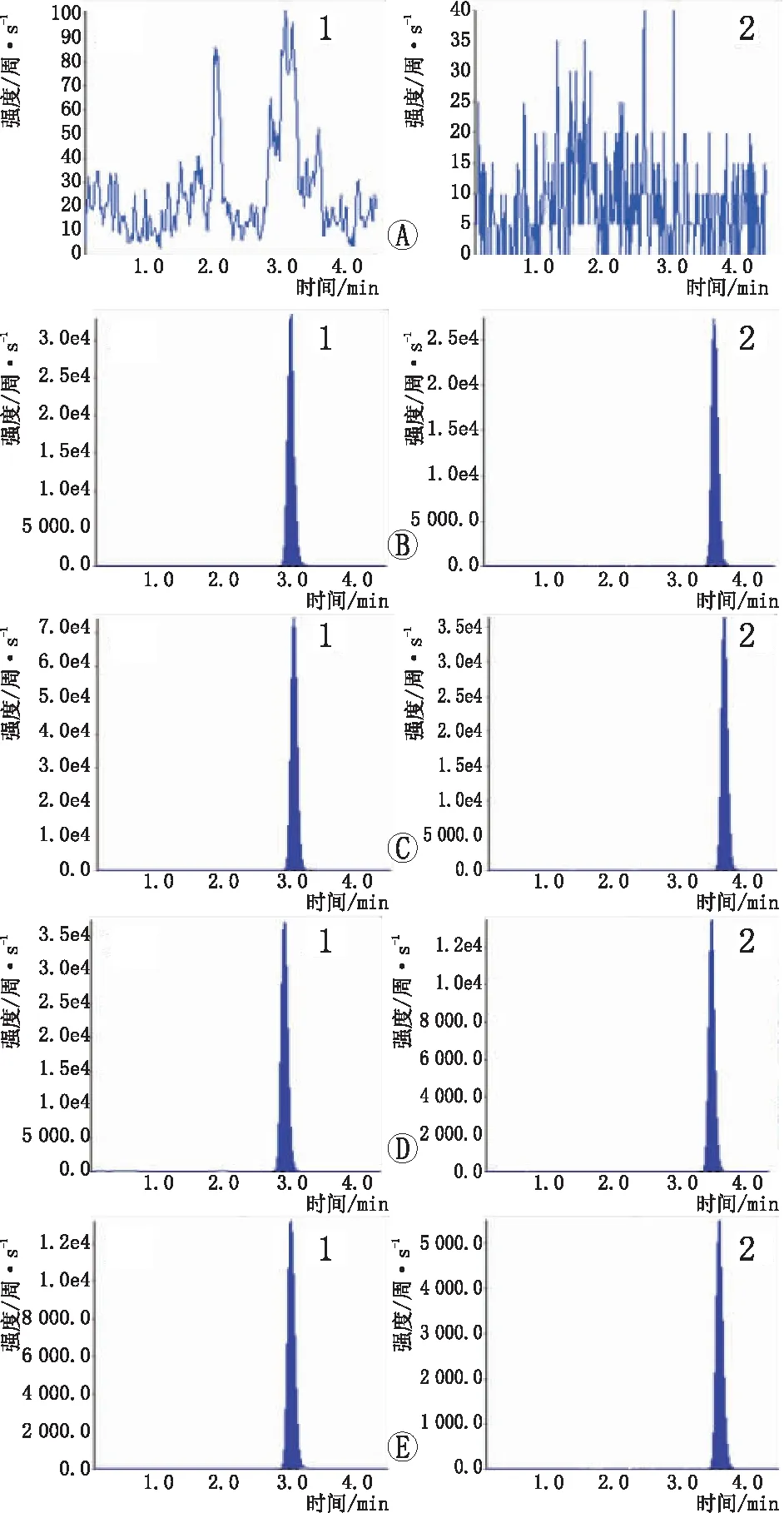
图2 各组血浆液-质联用离子流图。A:空白对照组;B:混合对照品;C:淫羊藿总黄酮10.0倍组;D:淫羊藿总黄酮5.0倍组;E:淫羊藿总黄酮2.5倍组;1:朝藿定A;2:淫羊藿苷
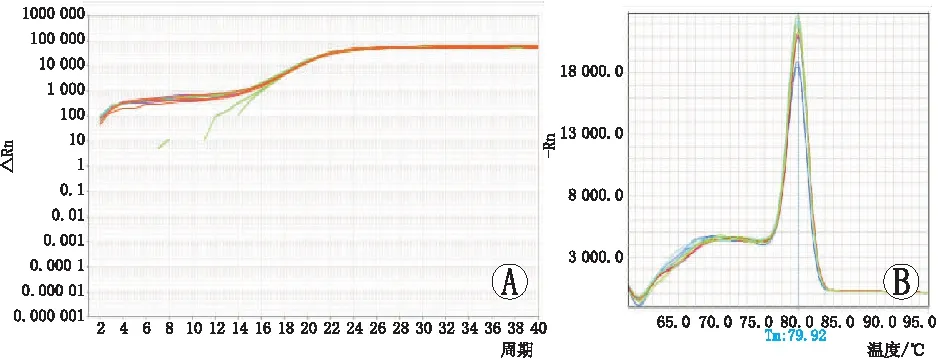
图3 GAPDH扩增和熔解图。A:扩增曲线;B:熔解曲线
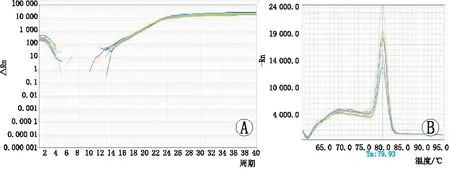
图4 Caspase-3 mRNA扩增和熔解图。A:扩增曲线;B:熔解曲线
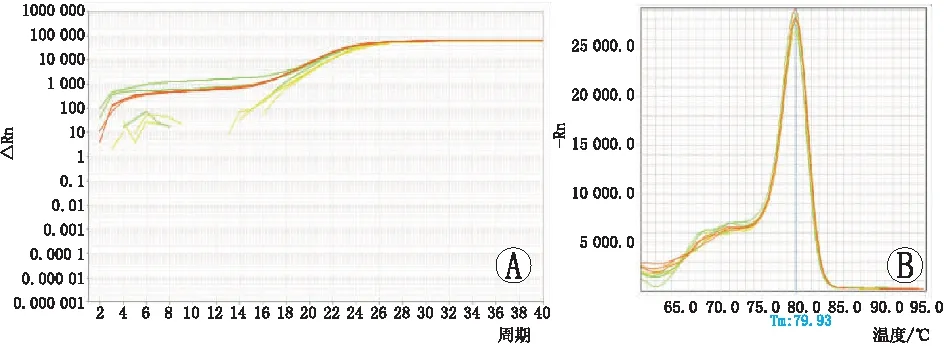
图5 Caspase-8 mRNA扩增和熔解图。A:扩增曲线;B:熔解曲线
3 讨论
近年来研究表明,炎性反应、细胞凋亡及雄激素水平的异常是导致干眼发病的共同机制[4]。而Caspase-3、Caspase-8在细胞凋亡中有着不可忽视的作用,是细胞凋亡发生的关键步骤及一切凋亡转导的共同通路[5]。Caspase-3、Caspase-8属于天冬氨酸特异酶切的半胱氨酸蛋白酶。Caspase-3广泛分布于各种不同类型的细胞中,在细胞凋亡中处于执行者的核心位置,是Caspase家族中最重要的凋亡执行者之一,是细胞凋亡过程中的主要效应因子,它的活化是细胞进入不可逆凋亡的标志[6]。Caspase-8在细胞凋亡中处于起始者的关键位置,主要介导由受体诱发的细胞凋亡,Caspase-8的活化可诱导细胞凋亡的发生。干眼患者泪腺上皮细胞中的许多细胞凋亡因子,如Caspase-3、Caspase-8等表达的增加与干眼的发病密切相关,并且与疾病的严重程度呈正比[7]。研究表明[8],淫羊藿总黄酮具有调节机体免疫、抗炎、抑制细胞凋亡等作用。推测淫羊藿总黄酮治疗肾阳虚干眼的发病机制为消除泪腺局部炎症及抑制细胞凋亡,发挥拟雄激素作用。通过观察泪腺上皮细胞Caspase-3、Caspase-8的表达变化,判断淫羊藿总黄酮抑制细胞凋亡的效果,以此观察淫羊藿总黄酮治疗肾阳虚型干眼的实验疗效。
淫羊藿具有补肾壮阳的功效,其中的主要有效成分是淫羊藿总黄酮。现在药理研究认为,淫羊藿总黄酮具有促进雄性激素分泌的作用[9]。目前中国淫羊藿资源相当丰富,淫羊藿总黄酮的工业分离提纯工艺比较成熟,淫羊藿总黄酮的应用有更加广阔的前景[10]。淫羊藿总黄酮是淫羊藿中促进免疫功能的有效成分,淫羊藿及其提取物可以通过影响巨噬细胞因子的分泌而调节免疫功能。本研究以此为基础,进一步探讨了干眼的发病机制,并对肾阳虚细胞模型的建立提供了新的思路,通过细胞实验探讨淫羊藿总黄酮对肾阳虚型干眼的治疗作用。
虽然现有的治疗干眼的方法多种多样[11],如使用人工泪液替代治疗维持眼表湿润,通过封闭泪小点等减少泪液的流失,使用M型胆碱受体激动剂等药物促进泪液分泌;但上述这些方法都只是对症治疗,不能从病因上解决问题,疗效有限,且用药时间长,患者依从性差。此外,促进泪液分泌疗法对于泪腺器质性病变、泪液无法正常分泌者无效;泪液补充治疗对于重度干眼无效;手术治疗对于干眼炎症未控制及泪道有感染者则是禁忌。抗炎及免疫疗法是针对病因的治疗方法,但无论是局部用药或全身用药,其副作用都不可避免。而其他对症治疗方法均不能从病因上治疗免疫炎症性干眼,只能暂时缓解症状。因此,作为临床一线的中医眼科工作者,思考一种安全有效的中医药治疗方法,在常用中草药中探求一种植物性免疫抑制药物,是亟待解决的课题。
通过本实验发现,空白组Caspase-3、Caspase-8 mRNA的表达均高于含雄激素培养组,空白组和含雄激素培养组Caspase-3、Caspase-8 mRNA的表达均高于淫羊藿总黄酮治疗组,说明淫羊藿总黄酮和雄激素均能够有效抑制Caspase-3、Caspase-8的合成,且淫羊藿总黄酮的效果优于雄激素。本实验为干眼探求了一种新的、有效针对病因的中药免疫抑制药物,为中医治疗干眼提供了理论支持,为中医辨证论治提供了现代科学依据。
