四氢嘧啶高产菌株的筛选及发酵条件的优化
2019-02-25王冠凤石艳丽钱晓路董艳美栾贻宏郭学平
王冠凤,石艳丽,钱晓路,董艳美,陈 晨,栾贻宏,郭学平
(华熙福瑞达生物医药有限公司,山东 济南 250100)
为了维持细胞内外的渗透压平衡,防止细胞脱水,极端环境中的微生物在细胞中会积累一些物质以抵抗外界的高渗环境,这类物质主要包括氨基酸及其衍生物、多元醇、糖类、甜菜碱及四氢嘧啶类[1-5]。
四氢嘧啶(1,4,5,6-四氢-2-甲基-4-嘧啶羧酸)作为一类渗透压补偿溶质,是细菌体内一种相容性溶质,它与细胞内的新陈代谢相容,并不影响细胞的生物大分子功能或生理过程,且对处于高温、高盐、冷冻、干燥、辐射、自由基等不良环境刺激下的细胞和生物大分子(生物膜、蛋白质、酶和核酸)具有保护作用[6-7],因此四氢嘧啶在细胞保护剂、生物制剂稳定剂、药物制剂、化妆品等领域有重要的应用价值和广阔的应用前景。其中,四氢嘧啶在医药产业中的应用已有大量研究与实例,如一种四氢嘧啶乳霜的临床研究表明,四氢嘧啶可用于治疗特异反应性皮炎和神经性皮炎。环境中悬浮微粒可诱发气道炎症反应,Sydlik等[8]研究表明,四氢嘧啶能抑制纳米颗粒诱导的促炎症反应信号,并剂量依赖性降低肺部中性粒细胞炎症。Grein等[9]采用无血清细胞培养基培养人间质干细胞,发现四氢嘧啶是一种优良的人间质干细胞冷冻保护剂。
四氢嘧啶于1985年在极度嗜盐光合细菌Ectothiorhodospira halochloris strainDSM 1059中首次被Galinsk等[5]发现并鉴定结构,是一种环化的氨基酸衍生物,性质稳定,不易分解,分子式C6H10O2N2,分子量为142.16,结构式见图1,外观为白色粉末,2 %溶液的pH值为6~8,溶于水、甘油、甲醇、乙醇、丙二醇等,不溶于二甲基亚砜、三氯甲烷。

图1 四氢嘧啶结构式
化学合成四氢嘧啶的前体物(如二氨基丁酸)价格昂贵,且四氢嘧啶分子中有一个手性碳原子,很难用化学方法合成。目前四氢嘧啶的生产方法包括发酵法和酶催化法。嗜盐微生物中有四氢嘧啶的合成途径,因此广泛用于四氢嘧啶的发酵法生产。目前已发现有许多耐盐菌及嗜盐菌细胞内可合成四氢嘧啶,包括Halomonas elongata,Brevibacterium epidermis,Marinococcus strain M52,Halomonas boliviensis,Chromohalobacter salexigens,Halomonasvenusta[10-15]等。可利用这些微生物采用“细菌挤奶”工艺生产四氢嘧啶,即高盐诱导下在细胞内合成四氢嘧啶,然后经低渗冲击细胞释放四氢嘧啶,维持细胞内外渗透压平衡。另外,有研究人员用重组工程菌如Escherichia coli[16-18]和Corynebacterium glutamicum[19],或嗜盐菌如Halomonas salina[20-21]连续合成并分泌四氢嘧啶。目前文献报道的四氢嘧啶发酵产率最高的是重组大肠杆菌ECT05(pTrcECT,pSTVLysC-CG),产率达25.1 g/L[22]。
当细胞内四氢嘧啶达到一定浓度时,合成即受抑制,四氢嘧啶的合成量受胞内四氢嘧啶浓度阈值的限制[23],因此选择四氢嘧啶胞内浓度阈值较高的菌株,可提高四氢嘧啶的发酵效率。本研究选择Halomonas neptunia为研究对象,通过人工诱变育种方法,改变其胞内四氢嘧啶的浓度阈值,目的在于诱变选育适合于商业化生产的四氢嘧啶优良菌株。
1 材料
1.1 菌株
Halomonas neptuniaATCC BAA-805购自美国ATCC。
1.2 培养基
富集与高盐选择性培养基选用OSM培养基[24](g/L):蛋白胨10.0,酵母粉2.0,氯化钠 50.0,氯化钾2.0,无水硫酸镁9.7,柠檬酸钠3.0,无水氯化钙0.2,pH调至7.5,固体培养基加琼脂20.0,121 ℃灭菌15 min。
低盐培养基(g/L):蛋白胨10.0,酵母粉2.0,氯化钠 5.0,氯化钾2.0,无水硫酸镁9.7,柠檬酸钠3.0,无水氯化钙0.2,pH调至7.5,固体培养基加琼脂20.0,121 ℃灭菌15 min。
摇瓶培养基(g/L):葡萄糖10.0,酵母粉3.0,氯化钠45.0,无水硫酸镁2.0,磷酸氢二钾0.55,七水硫酸亚铁0.005,柠檬酸钠3.0,无水氯化钙0.2,pH调至7.5,121 ℃灭菌15 min。
发酵培养基(g/L):葡萄糖20.0,酵母粉3.0,氯化钠50.0,无水硫酸镁6.0,磷酸氢二钾3.5,七水硫酸亚铁0.01,柠檬酸钠3.0,pH调至7.5,葡萄糖115 ℃单独灭菌,其余成分121 ℃灭菌15 min。
补料培养基(g/L):葡萄糖800,酵母粉150,磷酸氢二钾35,葡萄糖115 ℃单独灭菌,其余成分121 ℃灭菌15 min。
1.3 溶液与试剂
四氢嘧啶抽提剂:80 %乙醇;TCL展层剂:正丁醇-甲酸-水混合液(75:15:10);四氢嘧啶对照品购自Sigma公司。
2 方法
2.1 菌株诱变
2.1.1 菌悬液的制备 用预先灭菌的10 ml PBS缓冲液洗下新鲜斜面上的菌体,转移至盛有无菌玻璃珠的三角瓶,摇床振荡30 min,然后用PBS缓冲液梯度稀释至菌浓度约1×107cfu/ml。
2.1.2 复合诱变 紫外线诱变:取5 ml菌悬液置于无菌平皿(直径9 cm),磁力搅拌下,18 W紫外灯下30 cm处照射60 s。
亚硝基胍诱变:将上述经紫外线照射后的菌液用0.4 g/L亚硝基胍30 ℃处理50 min后,离心收集菌体,PBS缓冲液洗涤3次,除去残留的亚硝基胍,然后用富集培养基稀释至合适浓度后,涂布富集培养基平板,30 ℃培养24 h,计算致死率。复合诱变设3个平行。
2.2 正向突变株的筛选
2.2.1 初筛 经复合诱变的菌液适当稀释后涂布于高盐选择性培养基平板,30 ℃倒置培养24 h,筛选长势良好的菌株,分别接种至低盐培养基,筛选能快速生长的菌株。
2.2.2 复筛 将初筛得到的菌株接种至富集培养基,经过夜培养活化后,以1 %接种量接种至摇瓶培养基,150 r/min,30 ℃振荡培养24 h,然后10 000 r/min离心5 min收集菌体后,用等渗氯化钠溶液充分洗涤3次,10 000 r/min离心5 min,采用乙醇法抽提胞内四氢嘧啶[25]。用GF254型硅胶板薄层层析,展层剂为正丁醇-甲酸-水混合液(75:15:10,v/v),显色剂为水合茚三酮溶于正丁醇溶液,以四氢嘧啶对照品作对照,加热至130 ℃,时间5 min,观察结果,计算迁移率。根据样品圈大小粗略筛选出四氢嘧啶产量较高菌株。
2.2.3 遗传稳定性测定 将复筛得到的四氢嘧啶发酵产量最高的菌株连续传代5次培养,测定每代发酵液中四氢嘧啶含量,考察菌株的遗传稳定性。
2.3 四氢嘧啶含量测定及结构鉴定
2.3.1 HPLC法测定四氢嘧啶 四氢嘧啶对照品溶液浓度分别为0,2.5,5,10,20,40 μg/ml,根据谱图的峰面积和浓度对应关系绘制四氢嘧啶标准曲线。色谱柱为Capcell PAK C18(5 μm,4.6 mm×250 mm),外标法计算图谱的峰面积。检测条件:波长210 nm,流动相为色谱级乙腈/水(v/v:98/2),柱温35 ℃,进样量20 μl,流速0.8 ml/min。根据HPLC图谱中四氢嘧啶目标物的峰面积,代入线性回归方程Y=91 897X-0.66(R2=0.9990),计算HPLC检测样品中四氢嘧啶的含量。其中,Y为HPLC图谱中四氢嘧啶的峰面积;X为检测样品中四氢嘧啶的含量,单位g/L。结合检测样品的稀释比例,计算出原待测样品溶液中四氢嘧啶的含量。
2.3.2 红外光谱分析 采用傅立叶变换红外光谱仪(型号:NICOLET IR200 FT-IR)检测四氢嘧啶标准品与样品,并对比两者的红外光谱图。
2.3.31H-NMR方法 采用核磁共振波谱仪(型号:INOVA 600)检测四氢嘧啶标准品与样品,并对比两者的1H-NMR谱图,采用的溶剂为甲醇。
2.4 分批补料发酵
2.4.1 种子培养 将菌株接种至装液量为150 ml摇瓶培养基的1 L三角瓶内,30 ℃,200 r/min,振荡培养13 h。
2.4.2 高密度发酵 将种子培养液按5 %接种量接种至装液量为3 L发酵培养基的5 L生物反应器内进行补料分批发酵,温度维持30 ℃,5 mol/L HCl/NaOH调节pH 7.5~7.8。搅拌转速初始200 r/min,通风量初始3 Nl/min,然后不断调整,维持溶氧在20 %~50 %,最高转速和通风量不超过800 r/min和15 Nl/min。通过调整补料液维持葡萄糖浓度20 g/L,发酵24 h。
2.4.3 乙醇法抽提胞内四氢嘧啶 补料分批发酵结束后,8000 r/min离心10 min收集菌体,用等渗NaCl溶液充分洗涤菌体沉淀2次,8000 r/min离心10 min,用80 %乙醇抽提胞内四氢嘧啶。经减压蒸发浓缩后,真空干燥得干品。
2.4.4 细胞干重测定方法 取3 ml发酵液离心,用3 ml与四氢嘧啶生产用的相同盐浓度溶液洗涤细胞1次,70 ℃烘干至恒重。
2.5 发酵培养基及发酵条件的优化
2.5.1 氮源 将发酵培养基中的酵母粉分别用蛋白胨、大豆肽、硫酸铵、谷氨酸钠代替,终浓度0.3 %,30 ℃发酵24 h,收集菌体,抽提并测定四氢嘧啶含量,检测菌体干重。筛选出最佳氮源,将此氮源分别按1.0,2.0,3.0,4.0,5.0,6.0 g/L添加量发酵,考察氮源的最适浓度。
2.5.2 碳源 将发酵培养基中的葡萄糖分别用乳糖、蔗糖代替,终浓度2 %,30 ℃发酵24 h,收集菌体,抽提并测定四氢嘧啶含量,检测菌体干重。筛选得最佳碳源,将此碳源分别按10,15,20,25,30,35 g/L添加量发酵,考察碳源的最适浓度。
2.5.3 NaCl浓度 在发酵培养基中加入不同量NaCl,浓度分别为2 %,5 %,7 %,10 %,15 %,30 ℃发酵24 h,收集菌体,抽提并测定四氢嘧啶含量,检测菌体干重。考察四氢嘧啶发酵的最佳NaCl浓度。
2.5.4 pH 在上述最优培养基浓度下,考察pH分别为6.0,6.5,7.0,7.5,8.0时对四氢嘧啶产量和菌体生长的影响。
3 结果
3.1 菌株诱变
最终致死率为92.1 %。
3.2 筛选结果
3.2.1 初筛 筛选到8株能快速生长的菌株,分别命名为UN-1~UN-8。
3.2.2 复筛 结果见表1。菌株UN-2细胞内四氢嘧啶含量最高,达1.8 g/L,比原始出发菌株含量(1.17 g/L)高53.8 %,因此选择UN-2菌株为对象作进一步研究。

表1 筛选菌株细胞内的四氢嘧啶含量
3.2.3 遗传稳定性 以相对于未经传代诱变菌株的四氢嘧啶产量变化率为评价指标,变化率±5 %以内的菌株具有遗传稳定性。结果见表2。诱变菌株的四氢嘧啶发酵产量变化率小于5 %,表明该菌株的遗传性能稳定。

表2 突变株UN-2经5次传代的遗传稳定性结果
3.3 四氢嘧啶的结构鉴定
3.3.1 红外光谱分析结果 结果见图1。

图1 四氢嘧啶标准品与UN-2胞内四氢嘧啶的红外光谱图对比
3.3.21H-NMR测定结果 结果见图2。
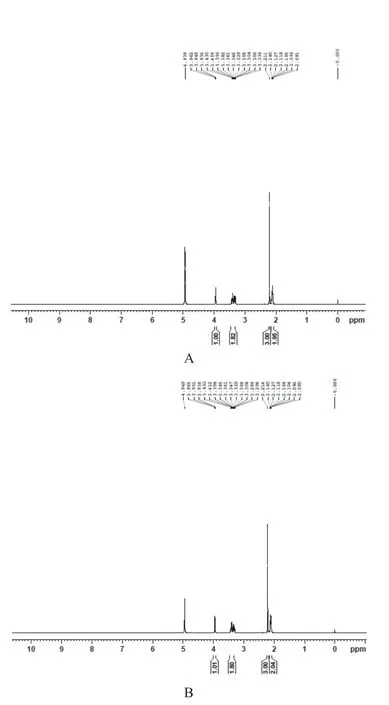
图2 四氢嘧啶标准品与UN-2胞内四氢嘧啶的1H-NMR谱图对比
由图1、图2可见,UN-2菌株胞内提取物与四氢嘧啶标准品的红外光谱图和1H-NMR谱图均一致,可初步判定UN-2胞内分泌提取得到的是四氢嘧啶。
3.4 分批补料发酵结果
UN-2菌株分批补料发酵,细胞干重33 g/L,四氢嘧啶产量3.72 g/L。
3.5 UN-2菌株产四氢嘧啶发酵条件的优化
3.5.1 氮源 结果见图3。

图3 不同氮源对生物量和四氢嘧啶产量的影响
由图3可见,酵母粉最有利于菌体生长,同时可使四氢嘧啶的产量达到最大,是菌株UN-2的最佳氮源,其次是谷氨酸钠、大豆肽和蛋白胨,无机氮源硫酸铵为氮源时菌体量和四氢嘧啶产量最低。分析原因可能为天然的有机氮源在为微生物生长代谢提供氮成分的同时,还提供微生物生长代谢所需的部分微量元素、生长因子与维生素等。

图4 不同浓度的酵母粉对生物量和四氢嘧啶产量的影响
图4表明,当酵母粉浓度1.0~4.0 g/L时,四氢嘧啶产量随酵母粉浓度增加而增加,当酵母粉浓度4.0 g/L时,四氢嘧啶产量最高,达4.4 g/L;当酵母粉浓度高于4.0 g/L时,四氢嘧啶产量随酵母粉浓度增加而明显下降,故酵母粉最佳浓度为4.0 g/L。
3.5.2 碳源 结果见图5。
由图5可见,碳源是葡萄糖时,四氢嘧啶的产量和生物量最高,乳糖和蔗糖为碳源时的产物和生物量均较低。20 g/L葡萄糖作碳源时,四氢嘧啶发酵产量达4.4 g/L, 远高于乳糖和蔗糖。因此确定葡萄糖为四氢嘧啶发酵的最佳碳源。
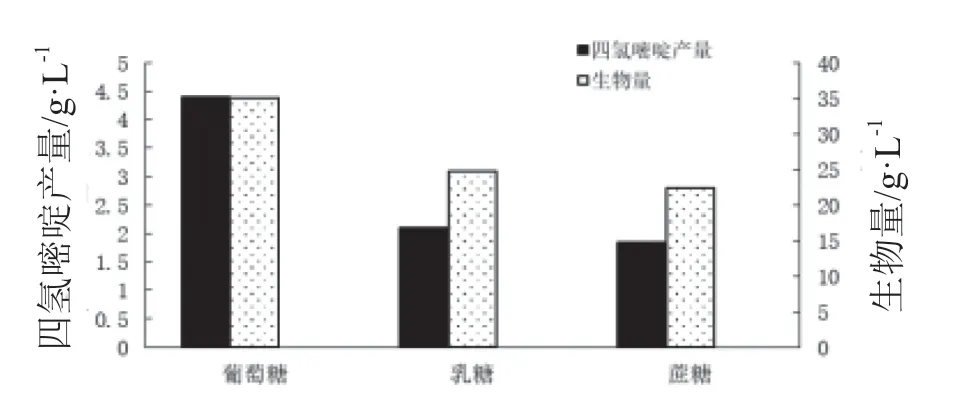
图5 不同碳源对生物量和四氢嘧啶产量的影响

图6 不同浓度的葡萄糖对生物量和四氢嘧啶产量的影响
由图6可见,葡萄糖浓度10~35 g/L时,随浓度升高,生物量和四氢嘧啶产量的变化趋势是一致的,均先增后降;20 g/L时,生物量和四氢嘧啶产量最高。表明适量的葡萄糖利于菌体生长及四氢嘧啶合成,但当葡萄糖浓度过高时,则抑制菌体生长,四氢嘧啶产量也相应降低。
3.5.3 NaCl浓度 在确定了浓度为4.0 g/L的酵母粉和浓度为20 g/L的葡萄糖分别为发酵培养基的最优氮源和碳源后,按2.5.3项操作,结果见图7。

图7 不同浓度的NaCl对生物量和四氢嘧啶产量的影响
由图7可见,随培养基中NaCl浓度增加,四氢嘧啶的产量先增后减,NaCl 2 %~7 %时,培养基的高渗透压刺激菌体在细胞内合成四氢嘧啶;7 %~15 %时,已达到胞内四氢嘧啶的浓度阈值,四氢嘧啶的合成量不再增加,故四氢嘧啶产量随生物量的降低而下降。细菌生长受到培养基中高渗透压抑制,生物量逐渐降低。因此,有利于四氢嘧啶合成的最佳NaCl浓度为7 %,此时四氢嘧啶产量为5.53 g/L,生物量33.46 g/L。
3.5.4 pH 在上述最优发酵培养基配方的基础上,调整pH至不同值,考察发酵培养基pH对生物量和四氢嘧啶产量的影响,结果见图8。
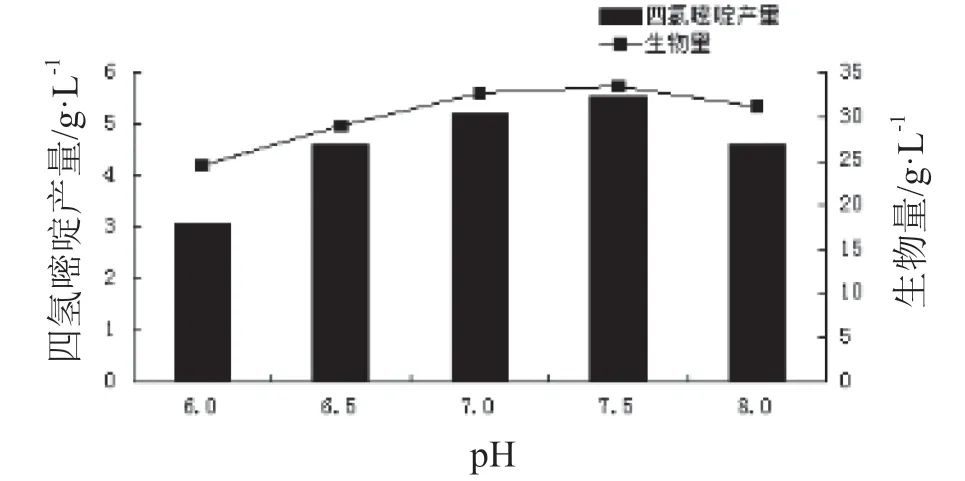
图8 pH对四氢嘧啶产量和生物量的影响
由图8可见,pH 6.0~7.5时,四氢嘧啶产量和生物量均随pH升高而增加,至pH为7.5时,两者达到最高值,分别为5.53 g/L和33.46 g/L;但当pH>7.5时,四氢嘧啶产量和生物量均有所下降。当pH为7.5时,四氢嘧啶产量最高,原因可能是参与四氢嘧啶合成途径的酶在pH7.5时的活性最高,也可能是由于此pH条件下的生物量最高,导致单位发酵液中四氢嘧啶的量最高。
4 讨论
本文通过紫外线及亚硝基胍的复合诱变筛选到了突变株UN-2,摇瓶发酵条件下,与出发菌株相比,四氢嘧啶产量提高了53.8 %,并初步探讨了不同氮源、碳源、NaCl浓度、pH对胞内四氢嘧啶合成的影响。研究确立了UN-2胞内四氢嘧啶合成的最佳单因素条件为酵母粉浓度4.0 g/L,葡萄糖浓度20 g/L,NaCl浓度7 %(w/v),pH 7.5。在优化条件下,UN-2合成四氢嘧啶的最高产率为5.53 g/L。因菌株UN-2易于培养,NaCl浓度要求范围宽,且在低氯化钠浓度下即可合成高产量的四氢嘧啶,具有潜在的商业应用开发价值。且本文在细菌挤奶工艺的基础上,采用分批补料发酵技术实现细菌的高密度发酵,在一定程度上提高了发酵产率。
下一步可开展温度、接种量、搅拌转速、生物素、氨基酸、金属离子等相关因素对发酵影响的研究工作,以及利用正交试验或响应面法综合研究各因素对发酵的影响,为进一步实现商业化开发提供更多数据。
