花期高温胁迫下TaERECTA基因对小麦生理特性和光合作用的影响
2019-02-25郑甲成尤依锦李杰勤程昕昕詹秋文
郑甲成,尤依锦,刘 婷,徐 祥,李杰勤,王 歆,程昕昕,许 峰,詹秋文
(安徽科技学院农学院,安徽凤阳 233100)
黄淮海地区是小麦的主产区之一,在小麦生长季节尤其是生育后期(开花期和灌浆期),经常出现干热风等高温天气,出现“高温逼熟”严重灾害,导致小麦籽粒产量下降和品质变劣。ERECTA是分离自拟南芥的类受体激酶(RLKs),主要参与植物的细胞分裂和组织发育[1]。ERECTA参与调控拟南芥AS1/AS2基因信号通路中叶片上下表皮极性发育进程,降低拟南芥植株对热胁迫的敏感性[2]。在拟南芥、番茄和水稻中分别过量表达ERECTA基因后,转基因株系耐热性显著增加,而拟南芥er突变体对热胁迫敏感[3]。小麦是全球最重要的粮食作物之一,世界上40%的人口以小麦为主粮[4]。因此,研究小麦TaERECTA基因提高小麦耐热性的生理机制,对改良黄淮海地区小麦耐热性、培育耐热性小麦新品种具有重要意义。
小麦属于喜凉作物,高温对整个生育期都会产生影响,但以抽穗扬花期最敏感[5]。高温胁迫会导致小麦产生大量活性氧,丙二醛(MDA)含量增加,膜脂过氧化加剧,植株功能期缩短,甚至死亡[6]。超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)等被认为是清除植物体内活性氧的主要抗氧化物质,可使植物对胁迫产生一定的耐受力[7]。相对电导率(relative electrical conductivity,REC)是评价植物遭受逆境胁迫时电解质外渗率的重要指标,可以反映逆境胁迫对植物细胞膜的损坏程度[8]。本研究以T3代转TaERECTA基因小麦为材料,在扬花期(Z65)[9]进行高温胁迫处理,测定其抗氧化酶活性、REC、MDA含量等,以及扬花期的相关光合参数,以明确TaERECTA基因在小麦开花期调控耐热性的生理机制。
1 材料与方法
1.1 试验材料
转TaERECTA基因小麦株系的选育在英国洛桑研究所的小麦遗传转化平台完成,受体为半冬性小麦品种Cadenza。于2015、2016和2017年对转TaERECTA基因小麦的T0、T1和T2代,连续进行PCR阳性检测和过表达鉴定,获得稳定遗传的30个小麦单株(分为12个转基因小麦株系)。2017年11月,通过盆栽方式将对照株系(CK,转Bar基因)、野生型株系(WT)以及3个超表达水平稳定的转基因小麦株系L3、L6和L15种植于安徽科技学院隔离室。
1.2 T3代转基因材料中TaERECTA基因的超表达分析
通过试剂盒(天根,北京)提取转基因小麦幼苗的总RNA,并反转录合成cDNA(TaKaRa,日本)。采用半定量和实时定量(qRT-PCR)方法同时检测TaERECTA的超表达水平。内参基因TaActin的引物为TaActin-F:TTGCTGACCGT ATGAGCAAG和TaActin-R:ACCCTCCAAT CCAGACACTG;目标基因TaERECTA的引物为TaERECTAQ-F:CAACGAGTACGTGAGC CTGCG和TaERECTAQ-R:GACTGACTACC TGCTTGCTGCATC。半定量和定量的实施步骤、数据分析参见Zheng等[10-11]的方法。
1.3 转基因株系高温胁迫处理
参照国际小麦生育期的划分标准[9]设定小麦取样生育时期和取样日期。在抽穗前期(Z49),将各株系移至光照培养室(室温22~25 ℃,白天光照16 h,光强525 μmol·s-1·m-2,夜间暗培养8 h)培养1周,每个株系种植4盆,每盆2株。于扬花中期(Z65)[9]9:00开始进行40 ℃高温胁迫处理,分别在处理的1、2、3、4和5 h取样测定相关生理指标。
1.4 小麦生理指标的测定
选择小麦倒二叶进行生理指标测定。超氧化物酶(SOD)活性测定采用氮蓝四唑(NBT)法[12],过氧化物酶(POD)活性测定采用愈创木酚显色法[13],过氧化氢酶(CAT)活性测定采用紫外吸收比色法[14],丙二醛(MDA)含量测定采用硫代巴比妥酸法[15],相对含水量(RWC)测定参照黄芬肖等[16]的方法,相对电导率(REC)测定参照张宪政[17]的方法。
1.5 光合作用参数的测定
扬花中期(Z65)[9]高温胁迫处理5h后,将各株系移回光照培养室,继续培养3 d后,在早晨9:00-11:00,用光合仪(美国, Li-6400)测定胁迫后小麦植株旗叶的光合速率、气孔导度、蒸腾速率和胞间CO2浓度。温室内采用内置光源,光强设定1 000 μmol·m-2·s-1,CO2参比浓度为400 μmol·mol-1,相对湿度为50%~70%,气室温度为25 ℃。每株系测定6个单株。同时,高温胁迫后测定小麦植株的SPAD值,测定方法参照仪器(SPAD-502plus,Minoda)说明书,每株系测定6个单株。
1.6 数据处理与制图
采用Microsoft Excel 2010、SPSS 18.0进行数据处理、差异显著性分析及图表绘制。
2 结果与分析
2.1 转基因小麦超表达水平稳定性分析
qRT-PCR分析结果(图1A)显示,3个转基因小麦株系(L3、L6和L15)中,TaERECTA基因的表达水平均极显著(P<0.001)增加,分别为CK株系的9.5倍、6.1倍和9.9倍,而内参基因TaActin的表达水平在各株系间无显著差异。半定量分析结果(图1B)显示,TaERECTA在转基因株系中电泳带型明亮,在CK株系和WT株系中电泳带型微弱,而内参基因TaActin在各株系中电泳带型亮度一致,无明显差异,此结果与qRT-PCR结果一致,进一步证实TaERECTA基因在转基因小麦株系中均可以稳定超表达。说明TaERECTA基因转入小麦可以显著增加其在小麦中的转录水平。
2.2 扬花期高温胁迫对转基因小麦抗氧化酶活性的影响
由表1可知,高温胁迫下3个转基因株系的SOD活性均较高,胁迫1、2、4和5 h后,3个转基因株系的SOD活性均显著(P<0.05)高于野生型株系。高温胁迫1 h后,L3和L6株系的SOD活性显著高于CK株系(P<0.05);高温胁迫2、3和5 h 后,L15株系的SOD活性均显著高于CK株系(P<0.05);胁迫4 h后,L6株系的SOD活性显著高于CK株系(P<0.05)。
由表2可知,高温胁迫处理下,3个转基因株系的POD活性基本上都显著高于野生型株系和CK株系(P<0.05),其中,胁迫1 h后,转基因株系L3和L15的POD活性分别较CK株系高24%和45%;高温胁迫处理2、3和4 h后,3个转基因株系的POD活性平均值分别较CK株系高24%、49%和63%;而处理5 h后,L3和L6株系的POD活性分别较CK株系高18%和59%。
由表3可知,不同处理时间段内,3个转基因株系的CAT活性均显著高于野生型株系和CK株系(P<0.05)。高温胁迫处理1、2、3、4和5 h后,3个转基因株系的CAT活性平均值分别较CK株系高68%、42%、53%、59%和24%,差异均达到显著水平(P<0.05)。
植物体内的SOD、POD和CAT对清除活性氧有重要作用,可使植物对高温胁迫产生一定的抵抗力。在扬花期高温胁迫下,转TaERECTA基因小麦具有较高的SOD、POD和CAT活性,说明TaERECTA基因在小麦中超表达对小麦的耐热性有一定的调控作用。

WT:野生型小麦;CK:转bar基因的对照株系; L3、L6和L15:转TaERECTA基因株系;***表示与对照之间有极显著差异(P<0.001)。下同。
WT:Wild type of Cadenza; CK:Thebartransgenic plants; L3,L6 and L15:TaERECTAtransgenic plants; *** means significant difference between transgenic lines and control at 0.001 level.The same in other figures and tables.
图1转基因小麦株系中TaERECTA基因超表达水平的qRT-PCR分析(A)和半定量分析(B)结果
Fig.1qRT-PCRandRT-PCRanalysisofTaERECTAgeneoverexpressionintransgenicwheatlines
2.3 扬花期高温胁迫对转基因小麦叶片膜透性的影响
表1高温胁迫下转基因小麦的SOD活性
Table1SODactivityoftransgenicwheatlinesunderhigh-temperaturestress

U·g-1FW·min-1
同列数据后小写字母不同表示在0.05水平差异显著(P<0.05)。下同。
The lower-case letters in the same column indicate significant difference at 0.05 level. The same in tables 2~4.
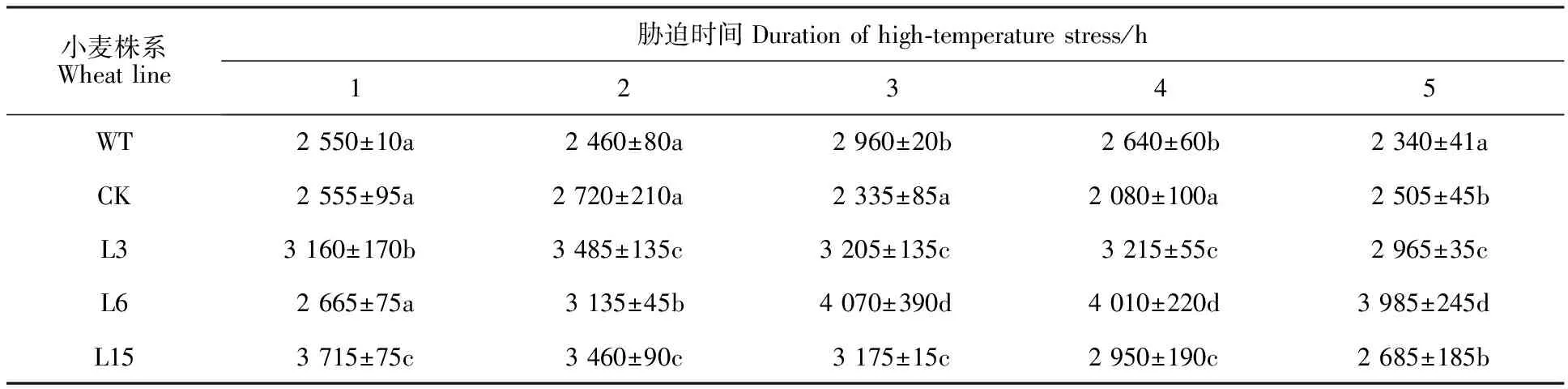
表2 高温胁迫下转基因小麦的POD活性

表3 高温胁迫下转基因小麦的CAT活性

表4 高温胁迫下转基因小麦的MDA含量Table 4 MDA content in transgenic wheat lines under high-temperature stress μmol·g-1 FW
MDA是植物器官在遭受逆境或衰老时脂膜过氧化作用的产物之一,通常把它作为脂膜过氧化的指标,用以反映细胞脂膜过氧化程度和植物对逆境响应的强弱[18]。由表4可知,高温胁迫下,各小麦叶片的MDA含量整体呈先增后降的变化趋势。在高温胁迫处理1~4 h后,3个转基因株系的MDA含量均显著低于野生型株系(P<0.05);且高温胁迫1、2和4 h 后,L3、L6和L15株系的MDA含量平均值分别较CK株系低22%、39%和31%,差异达到显著水平(P<0.05),而高温胁迫3 h和5 h后,仅L6株系的MDA含量与CK株系间的差异达到显著水平(P<0.05)。
高温经常伴随植物体内水分散失和叶片卷曲。本研究中,随高温胁迫时间延长,小麦植株的相对水分含量(RWC)呈降低趋势。胁迫3 h后,小麦各株系叶片卷曲严重,个别植株底部叶片出现枯死,株系间RWC差异不明显,故本文只分析了高温胁迫3 h以内RWC的变化。由图2可知,胁迫1 h后,仅L3株系的RWC与CK株系间的差异达到显著水平(P<0.05);胁迫2 h后,L3、L6和L15株系的RWC均显著(P<0.01)高于CK株系; 胁迫3 h后,各小麦株系的RWC均明显降低,仅L6转基因株系的RWC显著高于CK(P<0.05)。说明短时间高温胁迫下, 转TaERECTA基因小麦具有较高的相对水分含量。
相对电导率是评价细胞膜透性的有效方法。有研究表明,小麦叶片在高温胁迫71 min后,相对电导率达50%,植物组织就已经死亡[8],故本研究只检测了高温胁迫30、60和120 min后小麦叶片相对电导率的变化情况。由图3可知,高温胁迫下,转基因小麦的REC明显低于CK株系。高温胁迫30 min后, L3和L15株系的REC显著低于对照株系(P<0.05);60 min后,L6和L15株系的REC分别显著(P<0.05)和极显著(P<0.01)低于对照株系;120 min后,L3和L5株系的REC极显著低于CK株系(P<0.01),而L6株系的REC显著低于CK株系(P<0.05)。说明高温胁迫下,转基因小麦脂膜的损伤较小,这与MDA测定显示的结果基本一致。
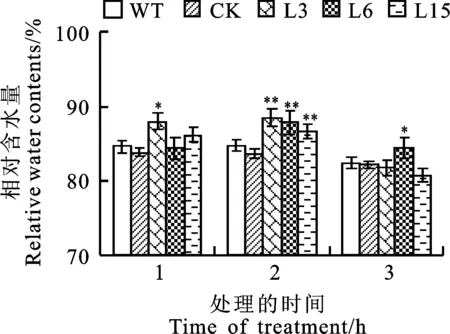
同一处理时间段图柱上的*和**分别表示转基因小麦株系与对照(CK)株系间在0.05和0.01水平上差异显著。图3同。
* and ** in the same treatment stage indicate significant difference between transgenic lines and control at 0.05 and 0.01 levels,respectively.The same in figure 3.
图2高温胁迫下转基因小麦的相对含水量
Fig.2Relativewatercontentintransgenicwheatlinesunderhigh-temperaturestress

图3 高温胁迫下转基因小麦的相对电导率
2.4 扬花期高温胁迫对转基因小麦SPAD值及光合作用参数的影响
高温胁迫能影响小麦叶片叶绿素的合成。由图4可知,随高温胁迫时间延长,各处理小麦叶片的SPAD值整体呈下降趋势,但转TaERECTA基因株系的SPAD与CK株系间的差异均未达到显著水平(P>0.05)。说明高温胁迫下,TaERECTA基因对小麦叶绿素含量无明显影响。
由表5可知,在扬花期高温胁迫5 h后,与对照(CK)株系相比,转基因小麦L3、L6和L15株系的光合速率(A)分别较CK株系增加35%、33%和51%,而三个转基因株系瞬时水分利用效率分别较CK株系增加53%、67%和47%,差异均达到极显著水平(P<0.01),胞间CO2浓度(Ci)和蒸腾速率(Tr)在转基因株系中均降低,仅有L6株系与CK株系间差异达到显著水平(P<0.05)。气孔导度(Gs)在转基因株系和CK株系间无显著差异。这说明TaERECTA基因过表达可以显著提高小麦的光合速率和瞬时水分利用效率。

图4 高温胁迫下转基因小麦的SPAD值

小麦株系Wheat line高温胁迫下转基因小麦的光合参数Photosynthetic parameters of transgenic wheat lines under high-temperature stress光合速率A/(μmol·m-2·s-1)气孔导度Gs/(mmol·m-2·s-1)胞间CO2浓度Ci /(μmol·mol-1)蒸腾速率Tr/(mmol·m-2·s-1) 瞬时水分利用效率 WUEi/(μmol·mmol-1)WT12.77±0.310.12±0.01204.89±17.072.83±0.324.52±0.05CK13.74±0.200.20±0.01266.71±11.403.87±0.233.66±0.11L318.48±0.34∗∗0.18±0.01215.81±7.643.30±0.475.61±0.03∗∗L618.29±0.57∗∗0.16±0.00183.45±8.01∗2.99±0.39∗6.12±0.39∗∗L1520.78±0.46∗∗0.23±0.00233.53±1.553.75±0.285.37±0.15∗∗
表中同列数据后*和**分别表示转基因小麦株系与对照(CK)株系间在0.05和0.01水平上差异显著。
* and ** in the same column indicate significant difference between transgenic lines and control at 0.05 and 0.01 levels,respectively.
3 讨 论
本研究表明,花期高温胁迫下,转TaERECTA基因的小麦株系叶片中SOD、POD和CAT活性明显高于CK株系,暗示转TaERECTA基因小麦活性氧的清除能力较强。TaERECTA基因参与调控植物细胞内电子传递链[19],推测可能会影响细胞内SOD活性,提高小麦耐热性,但其具体机理还需进一步研究。
本研究表明,高温胁迫导致小麦叶片的MDA含量和REC迅速增加,说明高温胁迫打破了小麦叶片自由基产生和清除的动态平衡,使膜脂过氧化程度加剧,质膜透性加大,电解质外渗;本研究还显示,高温胁迫3 h后各株系小麦叶片RWC迅速降低,说明随高温胁迫时间延长,蒸腾速率升高,小麦叶片RWC迅速减少。与CK株系相比,转TaERECTA基因小麦的MDA含量相对较低,两者之间差异显著;同时, 转TaERECTA基因小麦的REC也较低,且随胁迫时间延长,与CK株系间的差异更加明显。高温胁迫2 h后,转TaERECTA基因小麦的RWC极显著高于CK株系,但随高温延续,小麦蒸腾速率加快,此差异逐渐消失。说明高温胁迫下TaERECTA基因可能参与调控细胞膜结构的相对稳定性,减少细胞内容物外渗,降低高温对叶片的伤害。
ERECTA基因在拟南芥、水稻和番茄中超量表达后,能够显著提高植株的耐热性,而拟南芥er突变体植株中H2O2含量较高,对热胁迫特别敏感,推测是由于ERECTA可以保护细胞膜免受高温胁迫引起的细胞损伤和细胞死亡,保护脂膜的完整性[3]。本研究表明TaERECTA基因可能参与调控小麦细胞膜的稳定性。然而,关于ERECTA通过调控作物光合电子传递和呼吸电子传递,影响逆境下细胞膜稳定,提高作物耐热性的分子机制却没有报道,也缺乏ERECTA基因在高温胁迫下降低作物叶片细胞等离子膜发生起泡、褶皱、质壁分离等损害的直接证据,这些均亟待后续研究。
高温胁迫5 h后,转TaERECTA基因小麦的A和WUEi均显著高于CK株系,说明高温胁迫下TaERECTA超表达可以提高小麦的光合能力,这与前期转TaERECTA基因小麦在正常条件下具有较高光合效率的研究结果一致。小麦光合作用变化既受气孔因素影响也受非气孔因素影响,Ci和Gs均降低导致光合作用下降主要是由气孔因素引起的,而Ci升高和Gs下降则是非气孔因素引起的[20],高温胁迫下转TaERECTA基因小麦光合较低主要是由非气孔因素引起,进一步补充说明TaERECTA基因功能与拟南芥ERECTA家族成员不同,并不是通过调控小麦叶片的气孔发育途径来提高小麦耐热性,应该有其他独立的调控通路。
