环孢素A对大鼠急性脊髓损伤后炎症反应的影响
2019-02-24吴贤良黄建军杨智明许卫红
吴贤良, 黄建军, 杨智明, 许卫红
脊髓损伤(spinal cord injury,SCI)是临床常见的一类中枢神经系统创伤。SCI根据其病理生理机制的不同而分为原发性损伤及继发性损伤,继发性损伤是在原发性损伤的基础上伴发的多种生化级联反应。神经炎症作为继发性损伤的主要机制之一,会加重继发性SCI,部分研究已通过靶向干预,证实了抑制机体免疫可减轻炎症对继发性损伤的影响[1-2]。文献报道,SCI后,清除或抑制中性粒细胞、巨噬细胞等炎症细胞,或者抑制白细胞介素(interleukin,IL)-1β,IL-6等促炎因子均能促进脊髓神经功能恢复[3-4]。因此,抑制SCI后的炎症反应可以减少神经组织的进一步损伤并为神经修复提供适宜的环境。环孢素A(cyclosporin A,CsA)是选择性抑制T淋巴细胞的免疫抑制剂,主要是通过抑制辅助性T细胞增殖而发挥作用。正常脊髓组织中仅有极少数T淋巴细胞存在,而SCI后,T淋巴细胞数量急剧上升[5-6],并浸润中枢神经系统组织导致促炎细胞因子大量释放[7-8]。因此,CsA选择性抑制T淋巴细胞增殖可显著减轻促炎因子的释放而在神经系统中发挥抗炎作用,进而减轻继发性SCI。既往SCI的热点研究主要集中在轴突的再生及干细胞的移植等方面[9]。本研究将大鼠SCI后的行为学评估和损伤脊髓的组织学评估相结合,通过CsA的干预控制神经炎症反应,探讨CsA在大鼠继发性SCI中可能的作用机制,为CsA用于临床SCI的治疗提供理论基础。
1 材料与方法
1.1动物 健康成年雄性SD大鼠75 只,体质量220~260 g[福建医科大学实验动物中心,许可证号SCXK(沪)2007-0005],单笼饲养,饲养环境温度控制于20~23 ℃,湿度50%~60%,自由昼夜光线照明,动物自由进食,进水。
1.2动物模型制备 大鼠于术前禁食8 h,紫外线消毒手术台及相关物品30 min,手术器械经蒸汽高压消毒。10%水合氯醛(4 mL/kg)腹腔注射麻醉,针刺下肢确认麻醉成功后剔除背部毛发,将动物俯卧位固定于手术台。定位T10手术节段后,常规消毒。以T10为中心,行长约3 cm背部正中切口,依次切开皮肤、皮下,分离两侧椎旁肌肉,显露T9~T11节段棘突及椎板,小型拉钩撑开。组织钳轻轻提起T10棘突,显露T10与T11间椎间隙,小型椎板咬骨钳咬除T11棘突及T10椎板,显露T10节段脊髓。用一打击面直径为3 mm的圆形薄垫片覆盖于T10脊髓表面,以重10 g的铁棒经垂直圆柱套筒自25 mm高度自由坠落打击该垫片,造成T10节段脊髓挫伤。建模成功后,予生理盐水冲洗伤口,3-0丝线逐层缝合切口,待麻醉苏醒后单笼饲养。
1.3动物分组 75 只大鼠随机分为3 组,假手术组(sham组,n=25):仅摘除椎板,不进行脊髓打击及术后干预;CsA治疗组(CsA组,n=25):SCI建模后1 h尾静脉注射2.5 mg/kg体质量浓度CsA;生理盐水治疗组(NS组,n=25):SCI建模后1 h尾静脉注射与CsA等体积的生理盐水。
1.4行为学评分 采用Basso-Beattie-Bresnahan评分法则(BBB score)评估SCI后大鼠后肢运动功能[10]。BBB评分0~21 分,将大鼠后肢运动分为22个等级。术后护理完成后将各组动物置于约2 mm2面积的场地中自由活动5 min,由两位熟悉掌握BBB评分细则的实验人员从后肢关节运动、步态、协调运动和精细运动等方面细致观察大鼠后肢及尾部运动情况并评分,取两位评分人员的评分平均值作为每只大鼠在每个时间点的最终BBB评分。参照BBB评分细则对各组大鼠于术后1,3,7,14,21,28 d行BBB评分。
1.5实时荧光定量PCR(qRT-PCR)检测 用Trizol溶液提取脊髓组织的总RNA后,按逆转录试剂盒(PrimeScriptTMRT reagent Kit,日本Takara公司)说明操作获取cDNA,按Real-time PCR试剂盒(SYBR®Premix Ex TaqTM,日本TakaRa公司)进行PCR反应。IL-1β,IL-6及肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)和GAPDH的引物序列见表1。以GAPDH作为内参,用2-ΔΔCt法将IL-1β,IL-6及TNF-α的Ct值换算成升高或降低的倍数,以sham组各基因的表达作为对照分析qRT-PCR数据。

表1 引物序列Tab 1 Primer sequence
IL:白细胞介素;TNF-α:肿瘤坏死因子-α.
1.6苏木精-伊红(H-E)染色与损伤面积计算 脊髓标本经过常规脱水,透明,包埋后切取横切片(片厚5 μm),切片常规脱蜡至水,丙酮固定苏木精染色,1%盐酸酒精液分化,伊红染色,切片脱水,二甲苯中再次透明,中性树脂封片,晾干后观察。观察与评估:光学显微镜下观察并选取高倍镜视野(×400)拍照,利用photoshop软件进行高倍镜照片拼接,IPP 6.0软件分析各拼接照片的损伤面积和总面积。计算:每张切片的损伤面积百分比=(切片损伤面积/切片总面积)×100%。将损伤面积百分比最大的那张切片定义为该标本的损伤中心。统计分析各组损伤中心H-E染色切片的损伤面积百分比。
1.7免疫组织化学染色 切片常规脱蜡至水,3%过氧化氢溶液消除内源性过氧化物酶,在柠檬酸盐(pH=6.0)修复液中95 ℃水浴高温进行抗原修复,10%山羊血清封闭以减少非特异性染色,滴加一抗IL-1β(1∶500),IL-6(1∶300),TNF-α(1∶100)(兔抗大鼠IL-1β,IL-6,TNF-α多克隆抗体为美国Abcam公司),4 ℃孵育过夜,用PBS替代相应的一抗作阴性对照,滴加生物素标记的山羊抗兔二抗,室温下孵育15 min,滴加辣根酶标记链酶卵白素工作液(S-A/HRP),室温下孵育10~15 min,利用DAB显色试剂盒进行显色,苏木精复染细胞核。光学显微镜下观察,阳性细胞的染色呈棕褐色。每个标本取两张切片,每张切片取5个不重叠的随机视野,采用IPP 6.0软件计数每个视野中的阳性细胞数及总细胞数。每只实验动物的阳性细胞数为每个视野中阳性细胞个数的平均值。每组实验动物阳性细胞数为该组该时间点3只实验动物的阳性细胞数平均值。每个视野的阳性细胞百分比=(阳性细胞数/总细胞数)×100%。每组实验动物阳性细胞百分比取该组3只实验动物的阳性细胞百分比平均值。
1.8统计学处理 除BBB评分数据采用(均数±标准误)表示外,其余各组数据均采用(均数±标准差)表示,采用SPSS 13.0软件包进行统计分析,BBB评分采用重复测量方差分析,其余结果采用单因素方差分析。P<0.05为差别具有统计学意义。
2 结 果
2.1行为学评估结果 SCI后1,3,7,14,21及28 d,观察各组大鼠后肢运动功能并进行BBB评分。sham组BBB评分21 分,各时间点间比较,差别无统计学意义(P>0.05,图1),说明sham组建模成功,未损伤脊髓。SCI后,CsA组及NS组大鼠后肢截瘫,BBB评分在所有观察时间点均显著低于sham组,差别具有统计学意义(P<0.01,图1)。随着观察时间点推移,CsA组及NS组大鼠后肢运动功能逐渐恢复,两组的BBB评分在损伤后1,3,7 d比较,差别无统计学意义(P>0.05,图1)。但CsA组大鼠的BBB评分自SCI后14 d起均显著高于NS组,差别具有统计学意义(P<0.01,图1)。

sham组:假手术组;CsA组:环孢素A治疗组; NS组:生理盐水治疗组. 与sham组比较,+:P<0.05;与CsA组比较,△:P<0.05.图1 各组各时间点的BBB评分比较Fig 1 BBB score at each time in each group
2.2SCI晚期H-E染色结果及各组损伤面积比较 SCI后28 d,结束大鼠行为学观察后,取各组标本行H-E染色并统计损伤面积百分比。sham组未见明显结构破坏、炎性细胞浸润、出血、胶质瘢痕形成等病理改变;而CsA组和NS组均可见明显的程度不等的组织结构破坏、炎性细胞浸润、胶质瘢痕形成、组织空腔形成等病理改变。SCI后28 d,CsA组及NS组的脊髓组织均有坏死空腔形成,胶质瘢痕包裹,晚期炎症细胞浸润等病理改变(图2)。采用IPP 6.0软件对损伤中心区的面积进行统计,发现CsA组的损伤面积百分比显著低于NS组(P<0.01,图3)。结合BBB评分结果及H-E染色定量结果分析,SCI后大鼠会出现明显的运动功能障碍及病理性组织损伤,但CsA治疗可显著改善SCI大鼠的运动功能并减轻组织的继发性损伤。
2.3CsA治疗对SCI后大鼠髓内促炎因子IL-1β,IL-6和TNF-α的mRNA水平的影响 SCI后6 h,CsA组与NS组脊髓组织的IL-1β,IL-6及TNF-α的mRNA水平均显著高于sham组(P<0.01),但CsA组脊髓的IL-1β,IL-6及TNF-α的mRNA水平却显著低于NS组(P<0.01,图4)。SCI后1 d各促炎因子的mRNA表达趋势与伤后6 h类似,CsA组与NS组脊髓组织的IL-1β,IL-6及TNF-α的mRNA水平均显著高于sham组(P<0.01),CsA组脊髓的IL-1β,IL-6及TNF-α的mRNA水平却显著低于NS组(P<0.01,图5)。
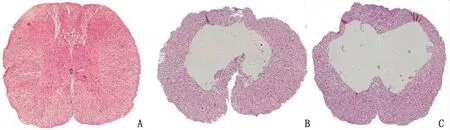
A:sham组(假手术组); B:CsA组(环孢素A治疗组); C:NS组(生理盐水治疗组).图2 各组大鼠SCI中心区横切片比较Fig 2 Contrast of transverse sections of the central area of SCI in rats of each group

sham组:假手术组;CsA组:环孢素A治疗组; NS组:生理盐水治疗组. 与sham组比较,+:P<0.05;与CsA组比较,△:P<0.05.图3 各组大鼠脊髓损伤中心区损伤面积百分比比较Fig 3 Comparison of the percentage of injured area in the central area of SCI in rats of each group
2.4CsA治疗对SCI后大鼠髓内促炎因子IL-1β,IL-6及TNF-α蛋白水平的影响 对SCI后6 h各组的免疫组织化学染色切片阳性表达细胞数及总细胞数计数(图6)。各组各因子的阳性细胞百分比统计显示,CsA组与NS组脊髓组织的IL-1β,IL-6及TNF-α的阳性细胞百分比均显著高于sham组(P<0.01),而CsA组脊髓的IL-1β,IL-6及TNF-α的阳性细胞百分比却显著低于NS组(P<0.01,图7A)。对SCI后1 d各组各因子的阳性细胞百分比统计显示,CsA组与NS组脊髓组织的IL-1β,IL-6及TNF-α的阳性细胞百分比均显著高于sham组(P<0.01),CsA组脊髓的IL-1β,IL-6及TNF-α的阳性细胞百分比却显著低于NS组(P<0.01,图7B)。结合qRT-PCR结果与免疫组织化学半定量结果综合分析,SCI会诱导明显的局部炎症反应,但CsA治疗可显著降低SCI大鼠促炎因子IL-1β,IL-6及TNF-α的表达。

sham组:假手术组; CsA组:环孢素A治疗组; NS组:生理盐水治疗组; CsA:环孢素A;IL:白细胞介素;TNF-α:肿瘤坏死因子-α.与sham组比较,☆:P<0.05.图4 脊髓损伤后6 h各组大鼠IL-1β,IL-6及TNF-α的mRNA水平比较Fig 4 6 h after SCI, the levels of IL-1β,IL-6 and TNF-α in rats of each group were compared
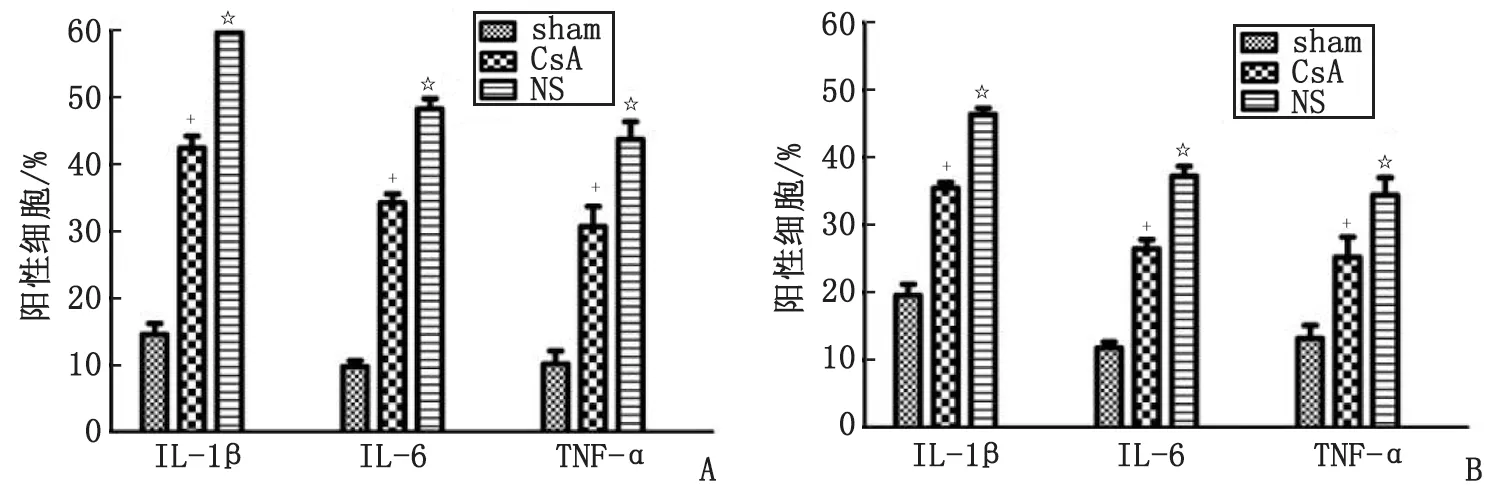
sham组:假手术组; CsA组:环孢素A治疗组; NS组:生理盐水治疗组; IL:白细胞介素; TNF-α:肿瘤坏死因子-α; CsA:环孢素A. A:脊髓损伤后6 h; B:脊髓损伤后1 d. 与sham组比较,+:P<0.05;与CsA组比较,☆:P<0.05.图5 脊髓损伤后1 d各组大鼠IL-1β,IL-6及TNF-α的mRNA水平比较Fig 5 1 d after SCI, the levels of IL-1β,IL-6 and TNF-α in rats of each group were compared
3 讨 论
促进SCI后神经功能恢复的药物治疗,既要能够避免残存的神经元受原发性损伤的波及,又要促进损伤组织的修复[11-12]。许多学者已探讨如何减轻SCI所诱导的组织损伤机制[13-15]。但至今仍然没有有效的治疗手段能减轻继发性SCI。甲基强的松龙为一种合成的糖皮质激素,能够直接抑制脂质过氧化反应,减轻神经元凋亡,促进SCI后的神经功能恢复[16-20]。目前甲基强的松龙对人类SCI后神经功能恢复的有利效应尚未被完全证实[21-25]。研究表明,免疫抑制剂CsA及他克莫司(FK-506)这两种磷酸酶抑制剂对中枢神经系统创伤有潜在的神经保护作用[26-27]。CsA是一类含11个氨基酸的环状多肽,可选择性抑制T淋巴细胞增殖,减轻机体免疫反应。CsA已被证实具有抵抗寄生虫、促进肝细胞及神经元再生和神经保护作用[28]。而CsA的神经保护作用主要是通过抑制脂质过氧化反应而发挥[29]。
研究发现,无论是SCI还是脑损伤,CsA能减少促炎因子、自由基及一氧化氮合酶的产生,同时也可以抑制小胶质细胞和巨噬细胞的活化,减少细胞凋亡,起到保护神经作用[30-33]。不仅如此,CsA还可维持线粒体内Ca2+稳态及膜电位,从而为受损神经细胞提供能量,也可以通过抑制水通道蛋白-4在神经细胞的表达来减轻神经细胞水肿。同时,CsA不仅能够降低损伤后血脑屏障的通透性,还能够抑制天门冬氨酸介导的神经毒性。因此,CsA能够通过脊髓继发性损伤的各个环节发挥其保护神经作用。CsA作为一种临床常用的免疫抑制剂,主要通过调控炎症反应而发挥各种生物学效应。
炎症反应是把“双刃剑”,炎症因子包括两大类即促炎因子和抗炎因子,促炎因子包括IL-1β,IL-6及TNF-α,而抗炎因子(包括IL-4,IL-10,IL-13,TGF-β)抑制SCI后的继发性炎症反应是减轻脊髓继发性损伤的重要措施。本研究发现,无论是SCI后6 h还是伤后1 d,各促炎因子的mRNA表达水平均升高,促炎因子IL-1β,IL-6及TNF-α表达水平的升高可使损伤的脊髓出现水肿及局部炎症反应,增加炎性细胞的浸润,抑制SCI后的神经功能恢复,而且各促炎因子之间可相互作用导致更强烈的的炎症级联效应,加重SCI。CsA为钙依赖磷酸酶抑制剂,特异性抑制T淋巴细胞活性,既可抑制宿主细胞免疫也可抑制体液免疫,CsA进入细胞内形成复合物与钙依赖磷酸酶结合,抑制其活性,因此抑制IL-1β,IL-6及TNF-α等促炎因子的基因转录,干扰T细胞活化,抑制IL-1β,IL-6及TNF-α等毒性细胞因子的产生。既往的SCI的热点研究主要集中在轴突的再生及干细胞的移植等方面,本研究创新运用临床上常见的免疫抑制药物CsA,取材方便,应用CsA能减轻神经炎症反应,而不是研究如何消除胶质瘢痕、重建脊髓微循环、重构髓鞘等目前尚存争议的问题,取得了预期的实验效果。

sham组:假手术组; CsA组:环孢素A治疗组; NS组:生理盐水治疗组; IL:白细胞介素; TNF-α:肿瘤坏死因子-α;sham组:假手术组; CsA组:环孢素A治疗组; NS组:生理盐水治疗组.图6 脊髓损伤后6 h各组大鼠IL-1β,IL-6,TNF-α的免疫组织化学比较Fig 6 6 h after SCI, immunohistochemical comparison of IL-1β,IL-6,TNF-α in rats of each group

sham组:假手术组; CsA组:环孢素A治疗组; NS组:生理盐水治疗组; IL:白细胞介素; TNF-α:肿瘤坏死因子-α. A:脊髓损伤后6 h;B:脊髓损伤后1 d. 与sham组比较,+:P<0.05;与CsA组比较,☆:P<0.05.图7 脊髓损伤后6 h及1 d各组大鼠IL-1β,IL-6及TNF-α的蛋白水平比较Fig 7 6 h and 1 d after SCI, comparison of protein levels of IL-1β,IL-6,TNF-α in rats of each group
与以往的研究比较,本研究发现,CsA可促进SCI大鼠的运动功能恢复并减轻脊髓组织的进一步病理性损伤,通过SCI面积比较,发现CsA治疗可减轻脊髓的病理损伤程度;通过损伤脊髓的促炎因子mRNA水平比较,发现SCI可诱导大量促炎因子的转录,且CsA治疗可降低SCI后6 h及1 d的髓内促炎因子的转录水平及局部炎症反应。SCI的急性期,在损伤局部确实存在剧烈的炎症反应,而CsA治疗可显著抑制促炎因子的mRNA表达及局部炎症反应;通过损伤脊髓的促炎因子的蛋白水平比较,发现SCI可诱导大量促炎因子的蛋白表达,而CsA治疗可降低髓内促炎因子的蛋白表达及局部炎症反应;免疫组织化学的半定量蛋白水平结果提示,无论是SCI后6 h还是伤后1 d,各促炎因子的蛋白表达均升高,这说明SCI的急性期在损伤局部存在剧烈的炎症反应,而CsA治疗可显著抑制促炎因子的蛋白表达及局部炎症反应。CsA治疗有利于SCI的恢复,是一种用于减轻神经损伤的切实可行的治疗方法,同时也探讨了CsA对SCI后炎症反应的影响,发现CsA可减少损伤局部促炎因子的表达,从而在中枢神经系统创伤后发挥抗炎及神经保护作用。
