烟草KNOX基因家族的结构与表达模式分析
2019-02-23刘向真王根发金立锋李泽锋王宇博杨永锋
刘向真,王根发,金立锋,张 林,魏 攀,王 晨,李泽锋,王宇博,王 燃,杨永锋,王 中*
1.河南中烟工业有限责任公司技术中心,郑州经济技术开发区第三大街9号 450000
2.中国烟草总公司郑州烟草研究院,郑州高新技术产业开发区枫杨街2号 450001
3.河南农业大学烟草学院,郑州市金水区农业路63号 450002
4.郑州大学生命科学学院,郑州高新技术产业开发区科学大道100号 450001
植物 KNOX(KNOTTED1-like homeobox)基因属于同源异型盒(Homeobox)基因家族,该家族成员编码一类具有同源异型盒结构域的转录因子,广泛参与调控植物体的形态建成、模式形成等生理活动[1-2]。典型的同源异型盒结构域包含由60个氨基酸残基组成的3个螺旋区,其中前两个螺旋区结合形成环(Loop)结构,第2和第3个螺旋区形成螺旋-转角-螺旋结构[3]。但也存在一些非典型的同源异型盒结构域,由63个氨基酸组成非典型的DNA结合域,在其第1个与第2个螺旋之间存在3个额外的氨基酸(P-Y-P),因此该类型基因也被称为TABLE(Three Amino-acid Loop Extension)基因家族[4-5]。在植物中,TABLE基因主要包括KNOX和BELL(BEL1-like homeodomain)两大类。KNOX基因几乎在所有的植物中均有分布[1],第1个植物KNOX基因是在玉米(Zea mays)中发现的Knotted1(Kn1)基因[6],随后陆续从多种植物中克隆出了KNOX基因,并且发现该基因家族成员的数量随着多细胞二倍体(Multicellular diploid)植物的进化而逐渐增加[1,7-10]。单细胞绿藻和红藻植物只含有1个KNOX基因,而在陆生植物中KNOX蛋白一般是由多个成员的基因家族编码[11]。根据结构和进化关系,可以将这些成员分为两组(ClassⅠ和Ⅱ),随后又发现了双子叶植物特有的第3个组(Class Ⅲ)[12-13]。在单细胞绿藻(Chlamydomonas reinhardtii)中,KNOX蛋白的主要功能是调控配子体的性别,以及受精卵的发育[14-15]。在苔藓植物(Physcomitrella patens)中,尽管两组KNOX基因主要在孢子体中表达,但其编码的KNOX蛋白功能发生了明显分化。ClassⅠKNOX蛋白能够促进细胞的增殖[16],而ClassⅡKNOX蛋白抑制配子体的发育[17]。被子植物中ClassⅠ在顶端分生组织(Shoot apical meristem,SAM)的形成和保持过程中发挥着重要作用[18-19],此外还参与了诸如复合叶种叶剥离、节间伸长、花序形态结构建成、寄生植物与宿主间的维管连接等生理过程[20-23]。ClassⅡKNOX基因在被子植物的根、茎、叶和花中有表达,该组基因主要参与调控了植物器官的分化[24],同时能够抑制花序茎中维管束纤维次生壁的合成[25-26]。
除了上述的功能分化外,ClassⅠ和ClassⅡKNOX蛋白还表现出功能上的拮抗作用。ClassⅠKNOX基因主要在分生组织表达,但当其在叶片组织异位表达时,植株表现出ClassⅡKNOX基因功能缺失的表型;相反ClassⅡKNOX基因主要在发育的叶片中表达,当其在SAM人为表达时,会产生stm(ClassⅠKNOX)功能缺失的表型[24]。KNOX蛋白还参与调控了多种物质的合成代谢,包括赤霉 素(Gibberellicacid,GA)、细 胞 分 裂 素(Cytokinin,CK)、木质素(Lignin)等[25,27]。研究表明ClassⅠKNOX蛋白能够抑制活性GA的合成,同时促进CK的积累。如烟草NTH15(Nicotiana tabacum homeobox 15)通过直接抑制GA20ox(GA 20-oxidase gene)基因的表达,进而抑制赤霉素的合成[28]。玉米 KNOTTED1(KN1)则能够直接诱导ga2ox1基因的表达,后者编码的酶能将活性赤霉素转化为非活性赤霉素[29],同时玉米KNOX蛋白还能抑制木质素的合成[30]。在拟南芥和水稻中则发现KNOX蛋白能够促进CK合成相关基因的转录[31-32]。
烟草是一种重要的模式植物,因此烟草基因组学研究具有重要理论和现实意义。目前,烟草中克隆到的KNOX基因有两个,除NTH15基因外还发现NtKNATM1基因在腋芽和顶芽中高量表达[33]。利用烟草基因组数据库,鉴定烟草KNOX家族所有成员,通过序列分析、系统进化分析以及基因表达模式分析,旨在为揭示烟草KNOX基因在植物形态建成、激素信号、物质合成代谢过程中的功能提供理论依据。
1 材料与方法
1.1 材料与仪器、试剂
利用普通烟草品种红花大金元(Nicotiana tabacum L.)、林烟草(Nicotiana sylvestris)和绒毛状烟草(Nicotiana tomentosiformis)为试验材料。2017年3月播种,烟苗长出4片真叶时移栽入独立的盆钵中置于国家烟草基因研究中心温室内。生长条件设定为28℃光照16 h,23℃黑暗8 h。红花大金元烟苗正常生长至盛花期,分别采集花、花蕾、顶芽、叶、茎和根等组织样品,液氮速冻后放入-80℃冰箱备用。分别采集苗期、旺长期和成熟期的林烟草和绒毛状烟草的根、茎样品,液氮速冻后立即放入-80℃冰箱中保存,备用。
植物多酚RNA提取试剂盒、实时荧光定量试剂盒以及凝胶回收试剂盒均购自北京艾德莱生物科技有限公司;反转录试剂盒购自北京康润诚业生物科技有限公司;限制性内切酶购自宝生物工程(大连)有限责任公司;TransTaq®高保真Taq酶试剂盒购于北京全式金生物技术有限公司;其他常规试剂均为国产分析纯试剂,引物由北京六合华大基因科技有限公司合成。核酸提取、浓度测定和基因表达水平检测分别采用混合型碾磨仪MM400(德国Retsch公司)、超 微 量 分 光 光 度 计Nanodrop 2000(美国Thermo公司)和荧光定量PCR仪C1000TMThermal Cycler(美国BIO-RAD公司)。
1.2 方法
1.2.1 RNA提取和cDNA合成
利用植物多酚RNA提取试剂盒,严格按照操作说明书提取植物材料的总RNA。提取过程中,用RNase-free DNase I去除基因组DNA的污染。提取完成后,分别用琼脂糖凝胶电泳和Nanodrop 2000检测RNA样品的质量和浓度。cDNA第一链的合成按照Gene Star M-MLV反转录试剂盒说明书进行,转录完成后再次用Nanodrop 2000检测cDNA样品的浓度,并将其稀释至40 ng/μL,保存于-20℃冰箱备用。
1.2.2 生物信息学分析
以Knotted-1-like为关键词检索中国烟草基因组数据库V4.0,获得普通烟草、林烟草和绒毛状烟草中的候选KNOX基因。接着用Pfam(http://pfam.xfam.org/search)检测各候选基因编码蛋白质的功能域,剔除功能域缺失基因。随后用MEME(http://meme-suite.org/)进一步确认烟草KNOX保守功能域的序列,用ExPASY's Compute Pi/Mw(http://web.expasy.org/compute-pi)计 算 各 烟 草KNOX蛋白的分子量和等电点。基因的外显子/内含子结构用 GSDS(http://gsds.cbi.p-ku.edu.cn/)进行分析。随后用DNAMAN V6.0比对各基因的基因序列和编码区序列(Coding sequence,CDS),并进行验证。
根据数据库中各基因所在的染色体信息,利用MapInsect软件绘制各基因的染色体定位图。用Knotted-1-like为关键词搜索NCBI GeneBank数据库,获得其他植物中的KNOX同源基因。本研究中使用的同源基因分别来自拟南芥(Arabidopsis thaliana,AtKNAT1/NP_192555、AtKNAT2/NP_177208、AtKNAT3/NP_197904、AtKNAT4/NP_196667、AtKNAT5/NP_194932、AtKNAT6/AAF87007、AtKNAT7/AAG 408 58、AtSTM/Q38874)、石 斛 兰(Dendrobium grex,DgDOH1/CAB88029)、牵牛花(Ipomoea nil,InPKn2/AB016000)、西 红 柿(Lycopersiconesculentum,LeThox2/NP_001298112.1、 LeTKn3/AAD00252、Solyc07g007120、Solyc12g010410、Solyc08g041820、Solyc08g080120、Solyc04g077210、Solyc02g081120、Solyc01g100510)、水稻(Oryza sativa,OsHOS58/BAB 55658、OsHOS59/AB007628、OsHOS66/BAB55660、OsJNBa0035I24.10/AAR87205、OsJNB b0094O03.2/AAP68879、OsOSH1/JQ2379、OsOSH10/XP_469241、OsOSH15/NP_911093、OsOSH45/T03874、 OsOSH6/NP_914102、OsOSH71/BAA79226、Osrough_sheath1/BAA79225)、杨树(Populus tremula,Pt568092/XP_002317151.3、Pt570713/XP_002318951.2、Pt581961/XP_024456722.1、Pt61066/XP_002304900.2、Pt658310/XP_002315682.3、 Pt662050/XP_024437653.1、 Pt 672778/XP_002324571.2、Pt738080/XP_002324571.2、Pt88373/PNT01023.1、PtKN1/XP_002301134.1、PtKN AT3/XP_024459660.1、PtKNAT3b/PNS92233.1、PtKN AT4/AKE81086.1、PtKNAT6/PNT25501.1、PtKNAT7/XP_002299569.2)、卷柏(Selaginella moellendorffii,SmKNOX1/EFJ21442、SmKNOX2/EFJ07541、SmKN OX3/EFJ05362、SmKNOX4/XP_002969147)、马铃薯(Solanum tuberosum,StPOTH1/T07777)、玉 米(Zea mays,ZmAZM440326/NP_001105852.1、 ZmAZM 459391/NP_001150419.1、Zmgn1/AAP76320、Zmkn1/AAP76321、Zmlg3/AAD13611、Zmlg4a/AAP31409、ZmRS1/Q41853)。利用Clustal X比对收集到的植物KNOX氨基酸序列,将比对结果导入MEGA5,采用Neighbor-joining方法(自举检验1 000次)构建植物KNOX的系统进化树。
1.2.3 基因表达分析
采用荧光定量PCR方法检测烟草KNOX基因在不同组织中的表达水平,各基因特异性引物见表1。qPCR反应体系20µL,包括2×SYBR Green Master 10µL、基因上下游引物(10µmol/L)各1µL、cDNA模板(40 ng/µL)3 µL,加ddH2O补足至20 µL。qPCR反 应 程 序:95℃ 3 min;95℃ 10 s,60℃30 s,45个循环;信号采集,最后运行熔解(65~95℃)程序。采集3株植物样品混合为1个生物学重复,每个植物组织设置3个生物学重复,每个生物学重复样品各检测3次。反应结束后根据循环阈值(CT值),用 2-ΔΔCT或者 2-ΔCT
方法计算基因的相对表达量[34]。
2 结果与分析
2.1 烟草KNOX基因的鉴定
通过检索中国烟草基因组数据库V4.0中普通烟草基因组的数据,共获得24个注释为Homeobox protein knotted-1-like的基因,通过Pfam分析发现其中6个基因编码的蛋白缺少KNOX典型的KNOX I、KNOXⅡ或者ELK功能域。剔除后,共在普通烟草基因组中鉴定出18个NtKONX基因。分别在两个二倍体祖先种绒毛状烟草和林烟草中鉴定出5和8个KNOX基因。如表2所示,普通烟草NtKNOX基因编码区长度在903~1 281 bp之间,编码的氨基酸长度为300~426个,蛋白质分子量为33.87~47.10 kD,等电点4.61~6.58。祖先种绒毛状烟草NtomKNOX基因均含有5个外显子,林烟草中7个NsylKNOX基因含有5个外显子,1个NsylKNOX基因含有6个外显子。大多数普通烟草NtKNOX基因均含有至少5个外显子,只有Ntab0202830和Ntab0782930基因ID含有4个外显子,表明这两个基因可能在四倍体烟草形成后发生了内含子丢失。根据烟草KNOX基因之间以及与其他物种同源KNOX基因间的序列相似性,将普通烟草NtKNOX基因分为9组,分别命名为NtSTM和 NtKNAT1~8(表 3)。 林 烟 草 基 因 组 中 没 有NsylKNAT1基因,而绒毛状烟草中缺少NtomSTM、NtomKNAT1、NtomKNAT2和 NtomKNAT8基因。这表明绒毛状烟草中KNOX基因家族可能发生了基因丢失现象。比对普通烟草NtKNOX基因序列与祖先种同源基因序列的相似性,发现每对NtKNOX基因中有1个与林烟草同源基因相似度更高,另外1个与绒毛状烟草同源基因的相似性更高。因此,进一步将普通烟草KNOX基因命名为NtKNOXS或NtKNOX-T(表3)。

表1 基因表达水平检测引物Tab.1 Primers for detecting gene expression
2.2 烟草KNOX基因的染色体定位及进化分析
为了明确各NtKNOX基因在普通烟草染色体组上的分布,绘制了18个NtKNOX基因在普通烟草各染色体上的分布图,见图1。18个NtKNOX基因有15个已经明确定位到染色体上,分别分布在12条不同的染色体上,而NtKNAT3-T、NtKNAT6和NtKNAT7-S基因则位于目前尚未定位的片段重叠群(Scaffold)上。NtKNOX基因在12条染色体上的分布很分散,只有第4、6和18号染色体上含有两个NtKNOX基因,其余9条染色体上各含有1个NtKNOX基 因(图 1)。 其 中 NtKNAT2-TA/NtKNAT2-TB、NtKNAT8-TA/NtKNAT8-TB两对基因序列几乎完全一致,而且在4号和6号染色体上的距离非常接近,表明这两对基因可能由同源基因复制产生。

表2 3个烟草种中KNOX基因信息Tab.2 Characteristics of KNOX genes in three tobacco species

表3 3个烟草种中KNOX同源基因的命名Tab.3 Homologous KNOX genes in three tobacco species

图1 普通烟草NtKNOX基因的染色体分布Fig.1 Chromosome location of NtKNOX genes
根据玉米、拟南芥、石斛兰、牵牛花、西红柿、水稻、杨树、卷柏、马铃薯和3个烟草种中KNOX的氨基酸序列,经序列比对后用MEGA5软件构建植物KNOX的系统进化树,如图2所示。植物KNOX基因家族被明显地分为两支:KNOXⅠ和KNOXⅡ。KNOXⅠ又可以被进一步分为KNOXⅠ-A、KNOXⅠ-B和KNOXⅠ-C 3组。同样,KNOXⅡ也可以继续分为KNOXⅡ-A和KNOXⅡ-B两组。KNOXⅠ和KNOXⅡ两个大的分支均包含来自于单子叶植物和双子叶植物的成员,表明这两个分支的形成可能发生在单双子叶植物分离之前。但KNOXⅠ-A和KNOXⅡ-A分支中的成员都来自于双子叶植物,表明这两支可能是双子叶植物特有的KNOX蛋白。KNOXⅠ-B分支虽然包括单子叶植物和双子叶植物成员,但成员数目和植物种类较少,拟南芥AtKNOX在该分支中则没有分布,表明这个分支在植物中的分布可能不十分普遍。烟草KNOX蛋白在所有分支中均有分布,但在每个分支中其分布的数量并不相同。如烟草KNAT2和KNAT6分布在KNOXⅠ-A分支,该分支还包括来自拟南芥的AtKNAT2和AtKNAT6,这与之前对基因的命名一致。烟草KNAT8位于KNOXⅠ-B分支,STM和KNAT1位于KNOXⅠ-C分支;KNAT2、KNAT4和KNAT5位于KNOXⅡ-A分支,而KNAT7则位于KNOXⅡ-B分支(图2)。
2.3 烟草KNOX基因结构及蛋白结构域
通过分析烟草KNOX基因结构发现,所有烟草KNOX基因长度都在4 kb以上,并且均含有3个以上的内含子和4个以上的外显子(图3)。不同组烟草KNOX基因中内含子长度变化非常大,如KNOXⅠ-A组中各烟草KNOX基因包含的最大内含子长度在 5.6~22.8 kb,而 KNOXⅠ-B、KNOXⅠ-C和KNOXⅡ-B组中各烟草KNOX基因包含的最大内含子长度为3~3.6 kb;而KNOXⅡ-A组中各烟草KNOX基因中最大的内含子长度只有2.5 kb左右(图3)。KNOXⅠ中各外显子的长度比较保守,如第1个外显子(以KNOXⅠ-B中各基因排序)长度为234~381 bp,第2个外显子长度为117~123 bp,第3个外显子长度为106~142 bp,第4个外显子长度为230~254 bp,第5个外显子长度为152~207 bp(图3)。其中第2和第3个外显子之间的内含子在KNOXⅠ-C组中发生了丢失,形成了1个247 bp的外显子。KNOXⅡ组中各烟草KNOX基因的第1个外显子长度变化较大,其余外显子的长度都比较保守。如各基因间第1个外显子的长度为318~699 bp,而第2个外显子长度均为121 bp,第3、4、5个外显子长度分别为190、132和141 bp。

图2 植物KNOX家族系统进化分析Fig.2 Phylogenetic analysis of KNOX family in plants
通过序列的多重比对分析发现,烟草KNOX蛋白序列有4个相对保守的区域(图4A),进一步的功能域分析证实这4个区域依次是KNOX1、KNOX2、ELK和HOX(Homeobox KN)结构域,并确定了每个位置上最大可能的氨基酸频率(图4B)。其中HOX结构域的保守性最高,表现出TALE同源异型盒蛋白家族的典型结构特征,即第1和第2个螺旋间插入3个额外的氨基酸(P-Y-P)。这4个功能域在烟草KNOX基因上的分布与进化分组密切相关,如KNOX1功能域的编码区分布在KNOXⅠ组各基因的第1和第2个外显子上,而KNOXⅡ各基因的KNOX1功能域编码区只存在于第1个外显子上(图3)。除了KNOXⅠ-C组中的基因外,几乎所有烟草KNOX2功能域的编码区都能被内含子分开。ELK功能域的编码区在KNOXⅠ组各基因中分布在同一外显子上,而在KNOXⅡ各基因中是被内含子分割成两段。所有基因的HOX功能域编码区都被最后1个内含子分为两部分(图3)。
2.4 烟草KNOX基因的表达
普通烟草盛花期的叶、茎、根、花蕾、花和顶芽中NtKNOX基因的表达水平检测结果如图5A和5B所示,所有烟草NtKNOX基因均在顶芽组织中的表达水平最高,而且各组织中KNOXⅡ类基因的表达水平整体高于KNOXⅠ类基因。此外,所有的NtKNOXⅡ类基因还在根和花中表现出较高的表达水平,而大多数NtKNOXⅠ类基因在其他组织中的表达水平均很低,除了根中高表达的NtKNAT1和NtKNAT8基因(图5A)。在不同发育时期的林烟草中,NsylKNAT4基因的表达水平在根中始终最高,而在叶片中表达水平最高的是NsylKNAT3和NsylKNAT5基因(图5C)。NsylKNAT3和NsylKNAT5基因在幼苗期根中的表达水平很低,但在成熟期根中明显升高,同样的成熟期叶片中NsylKNAT7基因的表达水平也明显升高。绒毛状烟草中NtomKNAT3基因在根和叶中表达水平均很高(图5D),而NtomKNAT7主要在根中表达,NtomKNAT5主要在叶中表达。这种组织表达的差异性表明烟草KNOX基因的功能存在明显分化。

图3 烟草KNOX基因的外显子和内含子结构Fig.3 Gene structures of KNOX genes from tobacco
3 讨论
普通烟草被认为是由两个二倍体祖先种林烟草和绒毛状烟草杂交后,经染色体加倍形成的异源四倍体[35]。理论上普通烟草中NtKNOX同源基因的数目应等于林烟草和绒毛状烟草中KNOX同源基因数目的总和,但序列比对和进化分析发现,林烟草基因组中没有NsylKNAT1基因,而绒毛状烟草中则缺少NtomSTM、NtomKNAT1、NtomKNAT2和NtomKNAT8基因。相反,普通烟草中NtKNAT2-T和NtKNAT7-T则进一步发生了同源复制,表明在二倍体烟草(尤其是绒毛状烟草)中KNOX基因家族趋于缩减,而在四倍体烟草中则逐渐扩张。烟草KNOXⅠ类成员的进化途径可分为3个分支(即KNOXⅠ-A、KNOXⅠ-B和KNOXⅠ-C),而KNOXⅡ类成员的进化则分为2个分支,各分支成员间的基因结构(包括长度、内含子数目等)发生了明显变化。前人研究表明,KNOX基因结构与基因表达间存在很好的对应关系[36],因此这种基因结构的变化可能导致烟草各KNOX同源基因的功能分化及产生新的功能。基因表达的分析结果也证实了这一结论,普通烟草中NtKNOXⅡ基因几乎在所有组织中的表达水平都高于NtKNOXⅠ基因,而NtKNOXⅠ基因除了在顶芽中表达水平很高之外,在其他组织中表达水平均很低。这种KNOX基因的表达模式与已报道的其他物种一致,表明植物KNOX蛋白在功能上可能具有高度的保守性[5,37]。此外,还发现二倍体烟草根和茎中有不同的基因表现出最高的表达水平,预示着其功能的明确分化。而在普通烟草中所有NtKNOX基因的表达模式很接近,表明与野生祖先种相比,NtKNOX各成员的功能在普通烟草形成过程中发生了变化。目前,越来越多的植物KNOX基因以及与其相互作用的基因被陆续鉴定出来[38]。KNOX的功能除了最初的调控植物形态发育外[18],还调控了植物多种激素[5]和次生代谢物[27]的合成代谢。因此,深入分析烟草KNOX基因家族成员的结构和表达模式,将有助于进一步揭示不同植物中KNOX基因的进化关系,为研究该类基因在烟草中的功能奠定基础。
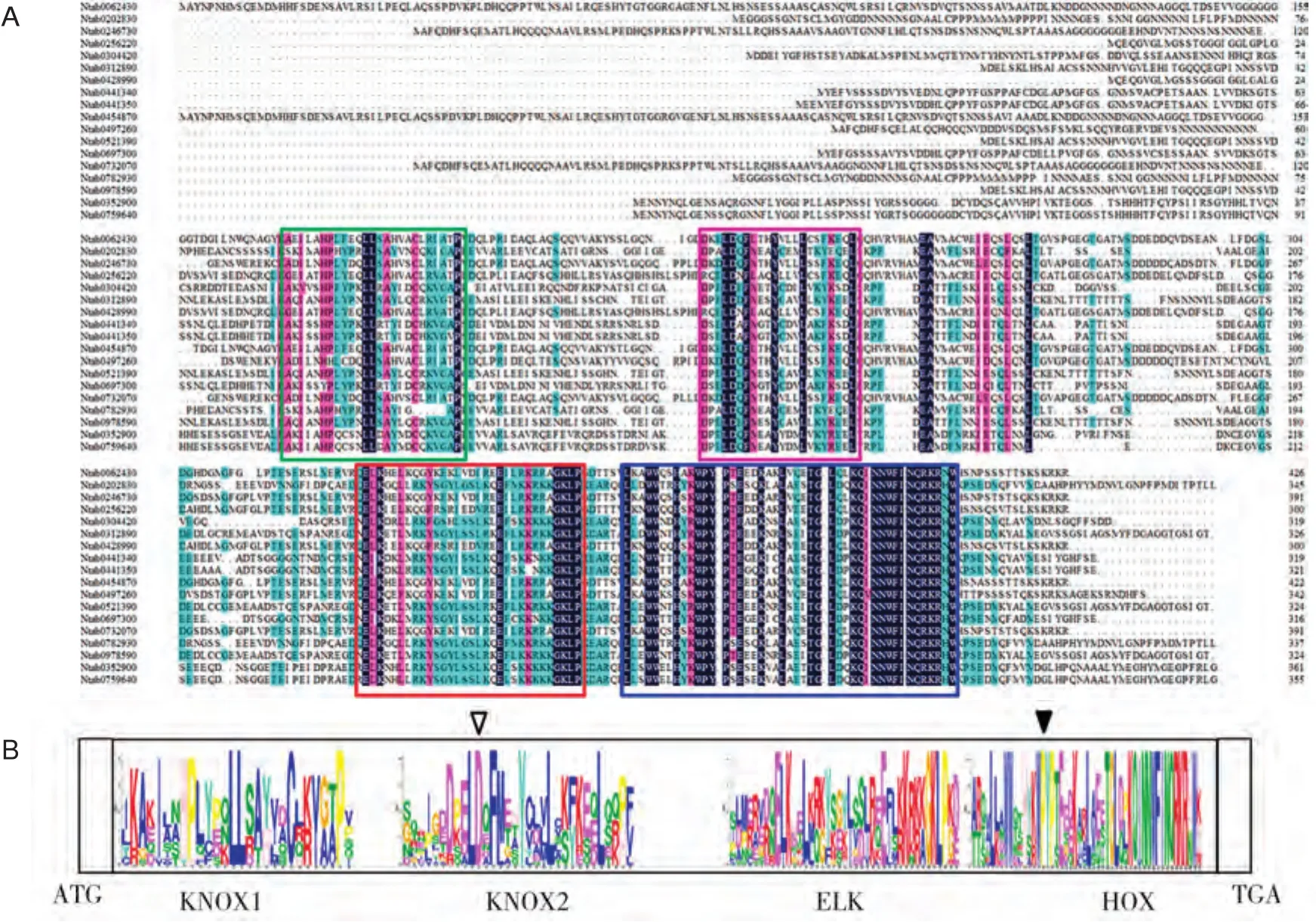
图4 烟草KNOX蛋白功能域分析Fig.4 Functional domain analysis of KNOX proteins from tobacco

图5 烟草KNOX基因的表达水平Fig.5 Expression levels of KNOX genes from tobacco
4 结论
本研究中分别从普通烟草、林烟草和绒毛状烟草中鉴定出18、8和5个KONX基因。根据序列的相似性,将烟草KNOX基因分为9组,分别命名为STM和KNAT1~8。系统进化分析表明,烟草KNOX蛋白在所有分支中均有分布,但是每个分支中分布的数量并不相同,表明烟草KNOX的进化是连续而又有所偏重。同一进化分支中烟草KNOX蛋白的功能域以及其编码序列在基因结构上的分布高度保守,预示着其功能的冗余。普通烟草中NtKNOXⅡ类基因的表达水平整体高于NtKNOXⅠ类基因,林烟草根和叶片中表达水平最高的基因分别是NsylKNAT4和NsylKNAT3/NsylKNAT5,绒毛状烟草中NtomKNAT3基因在根和叶中表达水平均很高,而NtomKNAT7主要在根中表达,NtomKNAT5主要在叶中表达。
