CD19+CD24hiCD38hi调节性B细胞在复发性流产合并抗磷脂综合征患者中的表达及意义
2019-02-23陈现何书贵连若纯林蓉何来宾曾勇
陈现,何书贵,连若纯,林蓉,何来宾,曾勇
(深圳中山泌尿外科医院生殖医学中心,深圳市围着床期生殖免疫重点实验室,深圳中山生殖与遗传研究所,深圳 518045)
复发性流产(recurrent miscarriage,RM)是妊娠期常见的一种并发症,也是妇产科中较难处理的疾病,是指在同一性伴侣的情况下连续发生2次及2次以上的自然流产,在育龄女性中发病率为1%~3%[1]。RM的病因主要包括遗传、内分泌和解剖结构异常、感染等因素,另外还有约40%~50%的RM患者病因不明确。目前,人们普遍认为抗磷脂综合征(antiphospholipid syndrome,APS)是RM的重要病因之一[2]。APS的发病机制被认为主要与血小板活化以及内皮细胞受损等有关[3]。因此,目前临床上对患有APS的RM患者的治疗主要关注于如何预防血栓的形成,然而,抗凝治疗只对部分患者有效[3-4]。而早期的研究表明APS患者炎性反应异常[5-6],但是其具体机制尚不清楚。近年来随着对自身免疫性疾病的不断深入,人们发现调节性B细胞(regulatory B cells,Breg)是一类具有免疫调节功能的B淋巴细胞亚群,在自身免疫性疾病中起重要的免疫调节作用,Breg细胞的缺失可加重自身免疫反应[7-8]。而APS作为一种系统性的自身免疫性疾病,同时又可继发于SLE或者其它自身免疫性疾病[3]。因此,本研究应用流式细胞术检测RM合并APS患者外周血Breg细胞比例以及表达IFN-γ和TNF-α的辅助性T细胞(T helper cells,Th)的比例,探讨RM合并APS患者外周血Breg细胞参与调控免疫炎症反应的分子机制,为患有APS的RM患者的治疗提供新思路。
资料与方法
一、研究对象
选取2017年1月至2018年3月首次来本院治疗的18例RM合并APS患者(APS/RM组)和37例非APS的RM患者(Non-APS/RM组)为研究对象,所有患者均经过详细询问病史、染色体核型分析、全身及妇科检查、宫腔感染和宫腔镜以及内分泌等系统性检查。同时选取在本中心工作的具有至少1次以上正常妊娠史的女性,共11例为对照组。
APS/RM患者的入选标准:(1)符合RM的定义:是指在同一性伴侣的情况下连续发生2次及2次以上的自然流产;(2)实验室标准:至少间隔12周的2次或2次以上发现血清中存在中等或者高滴度的IgG型和/或IgM型抗心磷脂抗体或抗β2糖蛋白I抗体;(3)夫妇双方染色体正常;(4)女方生殖解剖结构正常、内分泌正常、无其它自身免疫性疾病。
Non-APS/RM患者的入选标准:(1)符合RM的定义:是指在同一性伴侣的情况下连续发生2次及2次以上的自然流产;(2)夫妇双方染色体正常;(3)女方生殖解剖结构正常、内分泌正常;(4)无自身免疫性疾病、抗磷脂抗体阴性、无高凝倾向。
对照组的入选标准:(1)夫妇双方染色体正常;(2)女方生殖解剖结构正常、内分泌正常、无自身免疫性疾病,月经规律;(3)经自然受孕且有正常生育史者。
所有研究对象均在月经周期的黄体中期首次抽取外周血,并于当天分别检测Breg细胞比例,以及表达IFN-γ和TNF-α的Th细胞比例。本研究入选患者均签署了知情同意书,实验流程获得医院学术与伦理学委员会许可。
二、实验方法
1.流式细胞术检测CD19+CD24hiCD38hiBreg细胞的数量:将100 μl 乙二胺四乙酸(EDTA)抗凝全血加入到流式管中;然后加入CD19-APC (BD,美国)、CD24-PE (BD,美国)、CD38-PE-Cy7 (BD,美国),振荡混匀,避光、室温孵育 15 min;加入红细胞裂解液2 ml,避光孵育10 min;进行1 300 r/min离心6 min,去上清;加入含有5%血清的PBS 2 ml充分混匀,再进行1 300 r/min离心6 min,去上清;加入200 μl PBS 进行细胞重悬;利用DxFLEX流式细胞仪(Beckman Coulter,美国)进行检测,并用CytExpert 1.1软件进行结果分析。
2.流式细胞术检测表达IFN-γ和TNF-α的Th细胞的比例:将 100 μl EDTA抗凝全血加入到流式管中;然后加入CD3-PerCP (BD,美国)、CD8-APC-Cy7 (BD,美国),振荡混匀,避光、室温孵育15 min;加入红细胞裂解液2 ml,避光孵育10 min;1 300 r/min离心6 min,去上清;加入含有5%血清的PBS 2 ml充分混匀,1 300 r/min离心6 min,去上清;加入500 μl Perm2进行破膜10 min;加入含有5%血清的PBS 2 ml充分混匀,1 300 r/min离心6 min,去上清;加入IFN-γ-FITC (BD,美国)和TNF-α-APC (BD,美国),避光、室温孵育15 min,加入PBS 2 ml充分混匀,1 300 r/min离心6 min去上清;加入200 μl PBS进行细胞重悬;利用FACSCanto II流式细胞仪(BD,美国)进行检测,并用 FACSDiva软件进行结果分析。
3.性激素测定:月经第2~3天收集患者外周血,化学发光法检测血清FSH、E2、P及LH水平(Cobas E601,Roche,瑞士)。
三、统计学分析

结 果
一、各组研究对象基本资料比较
与对照组相比,APS/RM组和Non-APS/RM组的年龄、身体质量指数(BMI)、E2、LH、FSH、泌乳素(RPL)和孕酮(P)的表达水平均无统计学差异(P>0.05)(表1)。
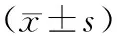
表1 各组基线资料比较
二、外周血CD19+CD24hiCD38hiBreg细胞在APS/RM患者中的变化情况
在黄体中期,收集对照组11例、APS/RM组18例及Non-APS/RM组37例患者的外周血,分析三组中外周血CD19+CD24hiCD38hiBreg细胞的比例。与对照组比较,CD19+CD24hiCD38hiBreg细胞比例在APS/RM组[(3.42±1.31)% vs.(7.16±1.28%)]和Non-APS/RM组[(4.79±1.10)% vs. (7.16±1.28%)]显著降低(P<0.01)。此外,与Non-APS/RM组相比,APS/RM组外周血CD19+CD24hiCD38hiBreg细胞比例显著降低(P<0.01)(图1)。
三、外周血表达IFN-γ或TNF-α的Th细胞在APS/RM患者中的变化情况
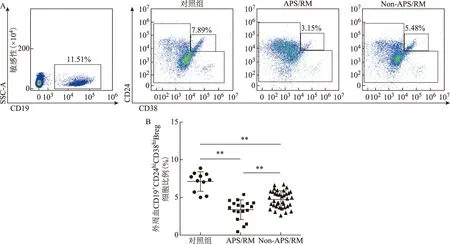
外周血表达IFN-γ的Th细胞比例在APS/RM组[(29.20±8.01)% vs.(20.60±2.63)%,P<0.01]和Non-APS/RM组[(25.00±6.06)% vs. (20.60±2.63%)]中均显著高于对照组(P<0.01),且APS/RM组中表达IFN-γ的Th细胞比例显著高于Non-APS/RM组的比例(P<0.05)(图2B)。同样地,表达TNF-α的Th细胞比例在APS/RM组[(46.30±7.36)% vs. (29.70±3.94)%,P<0.01]和Non-APS/RM组[(39.70±9.35)% vs. (29.70±3.94)%,P<0.01]中显著高于对照组;与Non-APS/RM组相比,APS/RM组中表达TNF-α的Th细胞比例也显著增加(P<0.05)(图2C)。
A:细胞比例的流式散点代表图;B:细胞比例的统计图;相互比较,**P<0.01图1 APS/RM患者外周血CD19+CD24hiCD38hiBreg细胞的比例
A:表达IFN-γ或TNF-α的Th细胞比例的流式散点代表图;B:表达IFN-γ的Th细胞比例统计图;C:表达TNF-α的Th细胞比例统计图;相互比较,**P<0.01,*P<0.05图2 APS/RM患者外周血表达IFN-γ或TNF-α的Th细胞的比例
四、外周血CD19+CD24hiCD38hiBreg细胞比例与表达IFN-γ和TNF-α的Th细胞比例之间的相关性分析
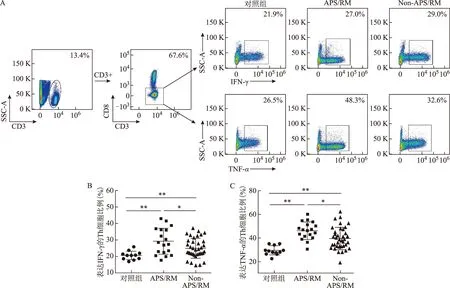
进一步分析CD19+CD24hiCD38hiBreg细胞与表达IFN-γ和TNF-α的Th细胞比例的相关性。在对照组中CD19+CD24hiCD38hiBreg细胞比例与表达IFN-γ (r2=0.38)和TNF-α (r2=0.49)的Th细胞比例均呈显著负相关性(P<0.05),而在APS/RM组和Non-APS/RM组中无显著相关性(P>0.05)(图3)。
图3 外周血CD19+CD24hiCD38hiBreg细胞比例与表达IFN-γ和TNF-α的Th细胞比例的相关性
讨 论
成功的妊娠依赖于母体内由众多免疫细胞及细胞因子参与的精密的免疫调控,使得母体对胎儿产生免疫耐受,维持妊娠,一旦这些调控失衡就可能导致流产等不良妊娠结局[9]。由于B细胞可以产生自身抗体,一直以来多被认为在自身免疫性疾病中发挥着正向免疫调节功能。过去二十年间研究人员也发现了B细胞所具备的其它免疫学功能,包括抗原提呈及依赖于分泌IL-10发挥免疫抑制作用等[10]。Breg细胞是一群可以降低炎症诱导免疫耐受的B细胞新亚群,主要通过以下两种途径来发挥负性调控:一方面,主要通过分泌细胞因子的方式发挥免疫调节作用,其中以IL-10为主导作用,可直接作用于初始CD4+T细胞,通过抑制Th1细胞亚群分泌IFN-γ、TNF-α和IL-12,影响Th细胞的分化与成熟;另一方面,Breg细胞可通过表面分子B7、CD40与T细胞表面的CD28、CD40L分子相互作用来调节免疫应答[11]。研究发现,正常妊娠女性外周血中Breg细胞的比例显著高于复发性流产女性组,而且在正常妊娠女性组中它们可以抑制母体T细胞的活化及炎性因子TNF-α的分泌[12]。本研究数据显示在Non-APS/RM患者外周血中CD19+CD24hiCD38hiBreg细胞比例显著低于对照组,且IFN-γ和TNF-α的表达水平比对照妇女组均显著增加。这些结果均表明Breg细胞在成功妊娠过程中对免疫应答和免疫耐受的调节起着关键的作用。
众所周知,复发性流产是妇产科常见的疾病,发病原因可能与遗传、内分泌、子宫解剖结构、感染和免疫等因素异常有关,其中有很大一部分是与自身免疫异常有关[13]。APS作为一种系统性的自身免疫性疾病,以动静脉血栓形成、复发性流产和血小板减少等为临床表现,以体内产生大量抗磷脂抗体为特征。APS发病机制非常复杂,确切的发病机制尚未阐明,对该病的研究主要集中在自身抗体介导的血栓形成方面,主要包括蛋白C轴抑制、凝血酶生成增多、补体失衡、内皮细胞激活、血小板激活等[3]。近年来,动物模型的证据表明抗磷脂抗体会导致蜕膜和全身性的TNF-α水平迅速增加[5]。且早期对人类的研究发现,抗磷脂抗体阳性的RM女性TNF-α启动子基因水平显著升高[6]。我们的数据也表明在APS/RM组中,IFN-γ和TNF-α的表达水平显著高于对照组和Non-APS/RM组。这些结果均提示APS导致RM可能与免疫炎症反应有关,但是其具体机制目前尚不清楚。
近年来,随着对炎症免疫相关疾病病理机制认识的不断深入,部分小鼠模型试验证实Breg细胞对疾病病情控制和治疗有着至关重要的作用。在人类许多自身免疫性疾病如系统性红斑狼疮(SLE)和多发性硬化病(multiple sclerosis,MS) 中均发现Breg细胞的数量或功能的缺乏或丢失均可加重自身免疫反应[7-8]。在人类MS中发现分泌IL-10的Breg细胞数量减少,但经过治疗后细胞数逐渐恢复正常[14]。来自MS患者外周血的Breg细胞可以抑制T细胞的增殖和IFN-γ的产生,但对Breg细胞采用RNA沉默IL-10后,这种抑制功能丧失[15]。另外,在SLE患者中发现其外周血中CD19+CD24hiCD38hiBreg细胞虽然数量上并没有减少,但在anti-CD40 mAb及CpG的刺激下没有产生IL-10,也不能抑制Th1细胞的反应[7]。在本研究中我们发现,与对照组和Non-APS/RM组比较,APS/RM患者组中CD19+CD24hiCD38hiBreg细胞比例显著降低,同时伴随着IFN-γ和TNF-α的表达水平的升高。而且,相关性分析显示,在对照组中,IFN-γ和TNF-α的表达水平随着CD19+CD24hiCD38hiBreg细胞比例的升高而降低,呈显著负相关性;而在APS/RM组和Non-APS/RM组中无显著负相关性。由此可见,在正常妊娠过程中,Breg细胞数量的平衡对免疫炎症反应的调控有着重要的作用,而在APS/RM组和Non-APS/RM组中,Breg细胞数量可能都发挥了一定的调控作用,特别是在APS/RM组,Breg细胞数量过低而导致了IFN-γ和TNF-α的表达水平的显著升高。这些结果提示,APS/RM患者中CD19+CD24hiCD38hiBreg细胞数量失衡可能在APS介导的免疫炎症反应而导致流产的过程中发挥关键作用。这一发现打破了人们以往对于APS引起RM的病理机制的认识,有助于对RM合并APS患者病情演变及预后的判断提供新的评判指标。因此,深入研究Breg细胞参与APS介导的炎症反应的调控机制,对于探索一种有效的RM合并APS的治疗方法具有非常重要的科学意义。
